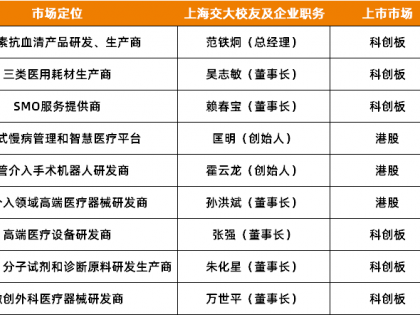
另外,药审中心药物临床试验登记与信息公示平台显示,截至6月27日,平台登记的试验总数为11504项,其中17.37%为生物制品。作为全球生物医药赛道上的新力量,中国生物医药正在加速奔跑。
创新研发开花结果
近年来,全球生物医药产业快速发展,细胞治疗等新技术得到广泛应用,在肿瘤、免疫性疾病治疗等领域进展喜人。
我国生物医药研发正走入全球前沿领域,并取得可圈可点的成绩:2018年12月,两个国产PD-1抗体药物——特瑞普利单抗注射液和信迪利单抗注射液先后获批上市;2019年2月,上海复宏汉霖生物技术股份有限公司的利妥昔单抗注射液(汉利康)获批上市,中国首个生物类似物就此诞生;5月,苏州盛迪亚生物医药有限公司的注射用卡瑞利珠单抗获得上市批准,国产PD-1药物再添一员。上述国产生物药用于黑色素瘤、淋巴瘤等癌症治疗,与进口药品形成竞争,促使后者降价,让中国患者能以更低价格享受更多治疗选择。
国产生物药创新研发能够开花结果,其背后是国家的政策支持和企业的长期投入。我国政府高度重视生物医药产业发展,将生物医药列入《“十三五”国家战略性新兴产业发展规划》。国家药监部门先后出台《生物类似药研发与评价技术指导原则(试行)》《细胞治疗产品研究与评价技术指导原则(试行)》《生物制品批签发管理办法》等文件,促进并规范生物医药产业发展。
随着药品审评审批制度改革深入推进,利好政策不断出台,让企业创新研发劲头更足。“审评速度决定着研发成本和上市速度,最终会对企业产品市场竞争力产生重大影响。” 复宏汉霖联合创始人、总裁兼首席执行官刘世高说,自2015年起,国家药监部门调整审评审批程序、鼓励药品研发创新、加入国际人用药品注册技术协调会(ICH)、加快新药审评审批等,助力中国医药行业加速与国际接轨,我国创新药物研发呈现出新面貌。
《2018年度药品审评报告》直观呈现了我国生物医药产业创新发展的强劲势头。2018年,药审中心受理1类创新药注册申请共264个品种,其中1类生物制品(以药品通用名称计算)创新药注册申请占106个品种,较2017年增长了62%;受理1类生物制品NDA 9个品种,较2017年增长了4.5倍。
本土企业争相进入
市场的激励让企业更有动力投身创新,本土企业蓄势张弓,抢滩生物药研发,这在生物类似药领域表现得尤为突出。
科睿唯安Cortellis数据库显示,从生物类似药研发管线数量来看,中国以251个开发项目的绝对优势领先全球,这一数字是排名第二的欧盟的1.7倍。其中,处于临床阶段项目数为89个,处于临床前阶段的项目达117个。
“这说明我国生物类似药的发展势头良好,但也显示出大量项目的开发重复。以阿达木单抗的生物类似药开发为例,29个活跃项目中,处于注册阶段的有4项、临床阶段的有7项、早期阶段的有18项。”科睿唯安生命科学与制药事业部首席科学家王刚博士分析道。
在王刚看来,生物药领域的竞争将会日趋激烈,选好研发策略对企业至关重要。他认为:“以生物类似药研发为例,企业需要了解全国乃至全球的竞争格局,依据企业自身特点寻求差异化发展,而不应盲目扎堆开发热门产品。同时,要放眼国际市场,积极参与全球竞争。除欧美主流市场外,还可关注对生物类似药接受度较高的新兴市场,如南美、中东和北非地区等。”
“这几年中国生物类似药发展虽然有些过剩,但反映了中国科研人员在早期研发和工艺研究上的实力。”杭州泰格医药科技股份有限公司高级副总裁陈文认为,中国抗体药物的崛起是依靠企业自身实力做起来的,药企人员有坚实的生物学基础和生产工艺开发经验,加上国内临床研究专家对本土创新药的鼎力支持,如果能在新的作用机制和靶点上做一些挑战性尝试,中国生物药在创新方面会有更多突破。
众多生物医药企业也将终极目标锁定原研创新。“我们的产品开发策略是仿创结合,从生物类似药起步,逐步开发创新型单抗产品。”刘世高说。
期待构建创新梯队
曾经有人提出,中国医药行业要赶上发达国家,“突破口”可能就是生物医药。
“我们确实看到了很多新成果,但我们也应看到差距。”中国医药创新促进会秘书长冯岚说,中国生物医药将会实现从跟跑、并跑到领跑的转变,但需要较长时间。
“需要时间,也需要配套政策尽快落地。”冯岚补充道,如专利链接、专利期补偿等制度,是营造创新氛围、培育创新成果的配套条件,其落地实施将会推动中国本土企业的创新和外国创新产品在中国的研发及上市。
冯岚还指出,中国要在生物医药领域赶超发达国家,需要培育创新梯队。“我们有一批本土研发企业在迅速成长,比如百济神州和信达。但想实现‘弯道超车’,不可能仅依靠少数几家企业,应该培育出创新梯队,这需要国家政策的鼓励。”
“我们的基础研究不够扎实。”中国医学科学院、北京协和医学院药物研究院副院长杜冠华直言,中国生物医药行业基础研究的短板亟待补上,要通过加强基础研究,提升对生物药有效物质的认识和创新能力。“还是需要扎扎实实地做些研究,发现真正新的、有效的药物。”杜冠华一再强调基础研究的重要性。
在刘世高看来,中国生物医药要实现“国产替代”并走向世界,制药企业必须有责任意识,产品质量必须和国际接轨。他说:“生物制药遵循药品GMP规范进行的生产和质量管理是一件需要长期坚持、积累和投入的事情。企业要坚守质量,从患者需求出发进行研发创新。”
王刚则认为,创新力的提升是一项系统工程,除关注药物研发本身外,还要对“配件”给予更多关注。“从生物类似药的工艺流程看,我国在配套生产设备、原辅料、纯化设备、耗材等方面还大量依赖进口。”他提醒制药企业关注这些方面,国内相关企业也应加快研发进度,尽早完成国产替代,真正做到中国研发、中国生产,增强中国生物医药行业的综合竞争力。(记者 落楠)