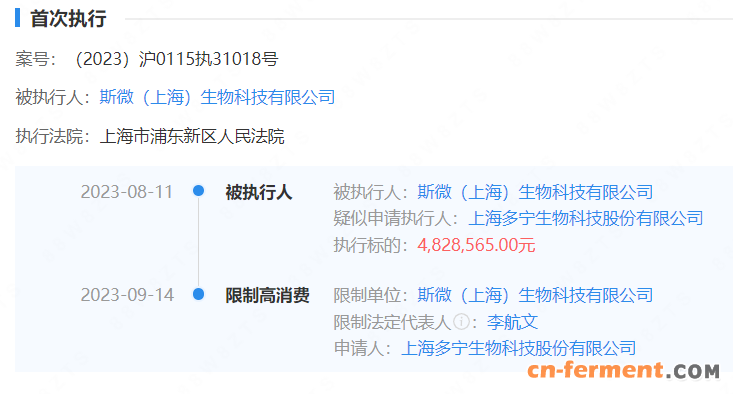
今天美国生物技术公司Halozyme宣布其透明质酸酶制剂PEGPH20在一个叫做HALO-301的胰腺癌三期临床失败。这个试验在吉西他滨和ABRAXANE®背景上比较PEGPH20与安慰剂作为晚期胰腺癌一线药物对OS的影响,结果两组OS分别为11.2和11.5个月、错过试验终点。HALO宣布将终止该产品的临床开发而集中精力经营其ENHANZE®递送平台、并裁员55%,同时宣布HALO未来三年将回购3.5亿美元HALO股票以回赠股东。因为投资者对此试验期望值较低、加上HALO的补救行动及时,今天其股票只有小幅下滑。
药源解析
PEGPH20是透明质酸酶的Peg化人源重组蛋白(又名rHuPH20),能够降解透明质酸。这类多糖暂时可逆降解后可以增加生物大分子的扩散吸收,所以这个技术可以让很多需要静脉滴注的药物改成皮下注射。这不仅增加使用方便性、也可以减少给药次数,患者可以自己在家中而不必到医院请医护人员协助、大大降低了用药成本。据估计有些静脉用药一半的花费来自医院静脉滴注。HALO这个能加快皮下注射吸收的技术受到很多有重磅抗体药物企业的青睐,现在与至少七个抗体药物巨头有合作、其中去年与施贵宝、罗氏的20亿美元合作最为引人注目。这个递送平台已有3个上市产品,所以技术、商业风险都低于按新药开发。
透明质酸由血浆细胞合成,结构相对简单、但功能复杂多样。最初合成的透明质酸分子量较高,但在组织重建和伤口愈合过程中这些高分子透明质酸可以被降解成不同大小的片段,不同片段功能可能相反。肿瘤利用了这个天然机制,一是通过蓄积透明质酸产生耐药,二是利用不同大小的透明质酸驱动肿瘤增长。虽然若干常见实体瘤有透明质酸蓄积,但很多早期工作并未区分不同分子量的透明质酸、令药物干扰缺少针对性。PEGPH20在此前的二期临床仅显示微弱疗效,虽然探索性终点、中值OS有3个月区分,但HR仅为0.96。去年HALO-301因为患者流失较为严重去掉PFS这个共同终点,令投资者怀疑疗效有限。今天HALO说对照组的超常表现是失败原因之一,一般这个人群的OS为8.5个月 、远低于试验中观测到的11.5个月。
胰腺癌是最致命、也是最难治的肿瘤之一。现在吉西他滨和紫杉醇还是标准疗法并非制药界对这个适应症不感兴趣,事实上因为肺癌、乳腺癌等常见肿瘤都有相对有效的靶向疗法或对免疫疗法较为敏感、市场分割严重,胰腺癌因为比赛规则相对简单是新机理药物比较重视的适应症。但遗憾的是几乎所有新机理药物都无法撼动胰腺癌,最近一个重要失败是上个月礼来的Peg-IL10制剂pegilodecakin、住友的Stat3抑制剂napabucasin今年7月也失败一个三期临床。这些药物虽然失败、但随着知识的积累和技术的进步可能被继续优化,有朝一日或许能成为胰腺癌新药发现的垫脚石。
此前相关报道:
研究表明:PEGPH20抑制胰腺癌安全有效
(2017年1月6日)
位于圣地亚哥的生物技术公司Halozyme Therapeutics宣布了2期临床试验HALO 202的优秀综合分析结果,该随机多中心研究在IV期胰腺癌患者中评估联合使用在研新药PEGPH20与ABRAXANE(纳布紫杉醇)和吉西他滨的功效。
Halozyme的前导候选药物PEGPH20是基于Halozyme专有rHuPH20酶的创新型治疗方案。rHuPH20是重组人源透明质酸酶,可以短暂降解积聚在某些肿瘤周围的糖胺聚糖——透明质酸(HA)。临床前研究表明,从肿瘤周围去除HA的手段,能有效增强化疗或免疫治疗制剂穿透肿瘤的能力,抑制肿瘤生长。
HALO 202是一项2期多中心、随机临床试验,评估在研新药PEGPH20作为一线治疗转移性胰腺癌患者的潜在治疗效果。该试验的主要结果是与吉西他滨加上纳布紫杉醇单独治疗相比,测量接受PEGPH20与吉西他滨和纳布紫杉醇组合的患者的无进展生存期(PFS)的改善状况。第二个主要终点评估PEGPH20治疗中的血栓栓塞事件发生率。
在这些研究发现中,与接受纳布紫杉醇和吉西他滨的高水平透明质酸(HA-High)患者相比,总体研究患者群体在用PEGPH20加纳布紫杉醇和吉西他滨治疗的高水平透明质酸的治疗方案中显示出统计意义上显着改善的无进展生存期(PFS)。该研究的第2阶段(在2016年2月完成招募)显示PEGPH20组中HA-High患者的中位PFS改善了91%,达到了8.6个月,而对照组仅为4.5个月,实现了其主要评估终点。同时,数据也证明PEGPH20臂中血栓栓塞事件的发生率有所降低。
Halozyme的总裁兼首席执行官Helen Torley博士说道:“这些发现证实了我们对发展PEGPH20治疗胰腺癌的信心。我们感到高兴的是,有效性和安全性数据的总体一致性支持我们正在进行的3期临床试验——HALO 301——它目前正在全球160多个站点进行。”
关于Halozyme公司2019/10/28
胰腺癌被冠以“癌症之王”之恶名,不管你是社会名流还是普通老百姓,一旦不幸落入它的手中,悲惨的结局似乎便已命中注定。尽管医学技术的不断进步已让很多癌症失去了昔日的威风,但胰腺癌却如隐匿于黑暗中的嗜血幽灵,行迹不定却又凶狠凌厉,令人闻风丧胆。
如何从胰腺癌手中争取更多的生机?总部位于美国圣地亚哥的临床肿瘤公司Halozyme提出了一个创新性解决方案——以改变肿瘤微环境对抗胰腺癌。在今天的这篇文章里,药明康德内容团队邀请到了Halozyme公司研发高级副总裁Alison Armour博士,请她为我们揭开这种创新疗法的神秘面纱。

▲Halozyme公司研发高级副总裁Alison Armour博士
隐匿的“杀手”
胰腺,一个看上去“很不起眼”的器官,长得小巧,还“藏”得很深,与其相关的疾病,千百年来也往往被人们所忽视。胰腺癌起病隐匿,早期症状不典型,但进展迅速。“胰腺癌的早期筛查非常具有挑战性,可靠的生物标志物目前尚未被开发出来。由于胰腺位于腹部深处,常规临床检查很难把胰腺癌给揪出来,同时胰腺癌的症状常表现为非特异性,如恶心、呕吐、体重减轻或疼痛,很容易被误诊。” Armour博士表示。
对于大多数患者而言,在被诊断出罹患胰腺癌时,他们往往已经失去了手术根治的机会,而癌细胞也已转移到身体其他部位;传统的介入、化疗、靶向治疗等治疗手段此时的疗效非常有限。有数据显示,只有20%的胰腺癌患者可以在诊断后活过1年,能活过5年的更是不足5%。令人担忧的是,胰腺癌在全球范围内的发病率呈逐年上升趋势,以美国为例,Cancer Research上的一项研究预计,到2030年,胰腺癌在该国癌症死亡率排行榜上或攀升至第二位,仅次于肺癌。
对手如此凶残,为了争取最大的生存希望,人类发起了一轮又一轮的冲击。在这场与胰腺癌的生死搏斗中,Halozyme开发出了自己的“秘密武器”——PEGPH20。
解码PEGPH20
回顾胰腺癌药物开发之历程,除了吉西他滨等少数药物,人类取得的进展乏善可陈。“我们必须勇于尝试,”Armour博士说道,“胰腺癌患者在发病时往往已经进入晚期,所以需要找到有效且见效快的药物。”巨大的未竟医疗需求成为推动Halozyme努力探索的动力,经过深入研究,Halozyme最终把目光锁定在了一个新领域——肿瘤微环境(TME)。
就像是每个人都生活在特定环境(包括自然环境和社会环境)中,每个肿瘤细胞也生活在自己特定的微环境中。具体而言,肿瘤微环境包括肿瘤内的恶性癌细胞和许多非恶性细胞(如成纤维细胞和免疫细胞)、血管,以及细胞外基质成分——如胶原蛋白和透明质酸(HA)。值得注意的是,癌细胞会利用各种手段“优化”这种微环境,促进恶性细胞生长并产生免疫抑制性。
就胰腺癌的治疗而言,有一个问题让医学界头痛不已:胰腺肿瘤微环境内往往有很高的压力,带来血管受压、血液流动受限、缺氧面积增加等诸多问题,结果阻碍了治疗性干预手段进入肿瘤。“胰腺癌被非常致密的纤维组织所包围,其中仅有约10%的细胞是肿瘤细胞,而这些细胞又被透明质酸包围。透明质酸是一种糖胺聚糖,聚集在肿瘤细胞表面及其周围空间。在免疫细胞向肿瘤的行进中,透明质酸构成了一道屏障,并压迫血管、阻碍化疗的进行。” Armour博士表示。

▲肿瘤周围的HA分子(图片来源:Halozyme官网)
作为Halozyme开发的主打候选药物之一,PEGPH20靶向的正是透明质酸——它基于一种重组人源透明质酸酶,即rHuPH20酶。Armour博士表示,这种创新疗法可以降解积聚在胰腺肿瘤周围的透明质酸,降低肿瘤压力,使血管更容易输送氧气、化疗药物以及肿瘤区域的免疫细胞。在PEGPH20的帮助下,化疗或免疫治疗制剂穿透胰腺肿瘤的能力大获提升,其恶性生长的势头也得以遏制。
从临床实践来看,PEGPH20的表现没有令人失望。在一项名为“HALO 202”的2期多中心、随机临床研究中,与接受标准化疗(纳布紫杉醇和吉西他滨)的高水平透明质酸(HA-High)胰腺癌患者相比,PEGPH20联合纳布紫杉醇和吉西他滨的治疗方案,在无进展生存期(PFS)上显示出统计意义上的显著改善。
实际上,PEGPH20瞄准的绝不仅仅是胰腺癌,Armour博士表示,Halozyme还在推进有关其他实体瘤的研究,以探索PEGPH20降解积聚透明质酸的能力是否有助于提高各种抗癌疗法的有效性。

▲Halozyme的研发管线(图片来源:Halozyme官网)
结语
“千淘万漉虽辛苦,吹尽黄沙始到金。”在抗击癌症的征途中,尽管历经千难万险,但人类前进的步伐从未停止,而PEGPH20已经展现出了光明的前景。
我们期待Halozyme在开发癌症新疗法方面不断取得突破,为千千万万名癌症患者点燃生命之火。
参考资料:
[1] Halozyme Utilizing Unique Tumor Microenvironment Pathway to Fight Pancreatic Cancer. October 8, 2019, from https://wxpress.wuxiapptec.com/halozyme-utilizing-unique-tumor-microenvironment-pathway-to-fight-pancreatic-cancer/
[2] Halozyme Announces Phase 2 Study In Advanced Pancreas Cancer Meets Key Endpoints. Retrieved January 5, 2017, from https://www.halozyme.com/investors/news-releases/news-release-details/2017/Halozyme-Announces-Phase-2-Study-In-Advanced-Pancreas-Cancer-Meets-Key-Endpoints/default.aspx
[3]Pancreatic Cancer Projected to Become Second Leading Cause of Cancer-related Death in the United States by 2030. Retrieved May 19, 2014, from https://www.aacr.org/newsroom/pages/news-release-detail.aspx?ItemID=541