在这一阶段,原料药行业面临挑战也迎来机遇:环保税法的实施以及空气、水、土壤污染防治标准提高,使原料药、中间体成本增加;“4+7”带量采购倒逼原料药产品进一步压缩利润;原料药与制剂关联审评和登记备案制,使原料药和制剂形成更加紧密的产业链关系;部分企业开始发力“原料药+制剂”一体化……在政策引导下,我国原料药行业实现了阶段性转型升级,由粗放型产能扩张向绿色制造、高品质转移。
一、2015~2019年化学原料药行业经济指标
国家统计局、中国医药工业信息中心等发布的历年医药行业相关数据(含原料药行业主营业务收入、利润、产量、出口规模以及变化率)显示,2019年我国原料药宏观指标略有下降。
(一)原料药行业经济指标
相关数据显示,2019年医药行业主营业务收入总额26147亿元,其中化学原料药主营业务收入3804亿元,占全行业比重的14.55%,较之前几年呈下降态势。2019年,化学原料药利润依旧处于全行业较低水平,其利润率为11.81%,较之2018年的10.6%略有提高(表1,表2)。


(二)原料药总产量呈下降态势
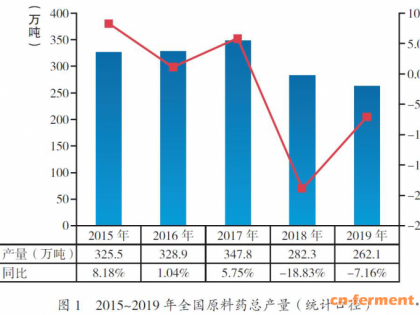
2019年,我国原料药产量262万吨,同比下降7.16%,继续呈下降趋势(图1)。其主要原因是产业结构调整、供给侧改革等宏观政策,对大规模重复建设项目进行了限制;行业内也较少出现大规模新建、扩大产能项目。以上有利于优化产业结构、缓解供需矛盾、减少污染排放等,促使行业良性发展。

二、原料药相关行业政策
2019~2020上半年间,与原料药密切相关的产业政策仍是以绿色制造、环保、产业结构、药品注册审批为主,重点如下。
(1)2019年7月,国家药监局发布《关于进一步完善药品关联审评审批和监管工作有关事宜的公告》,明确原料药、药用辅料、直接接触药品的包装材料和容器与药品制剂关联审评审批和监管有关事宜,该公告是原料药产业发展的重要的转折点。
(2)2019年10月30日,国家发展改革委修订发布《产业结构调整指导目录(2019年本)》。
(3)新修订的《药品管理法》自2019年12月1日起实施。该部法律从药品研制和注册、生产、经营、上市后监管等各个环节完善监管制度,监管理念也从以企业为主转变为以产品为主,从准入资格管理转变为动态监管为主,药品上市许可持有人制度和原辅料登记备案进一步全面推开。
(4)2020年1月2日,工业和信息化部、生态环境部、国家卫生健康委、国家药监局四部门联合发布《推动原料药产业绿色发展的指导意见》。
(5)2020年10月13日,国家市场监管总局就《关于原料药领域的反垄断指南(征求意见稿)》公开征求意见,预防和制止原料药领域垄断行为,引导原料药领域经营者守法合规经营。
(一)国家发改委《产业结构调整指导目录(2019年本)》
1.鼓励类
(1)含氟精细化学品。
(2)原料药生产节能降耗减排技术。
(3)采用现代生物技术改造传统生产工艺。
(4)药物生产过程中的膜分离、超临界萃取、新型结晶、手性合成、酶促合成、连续反应、系统控制等技术开发与应用。
2.限制类
(1)新建、扩建古龙酸和维生素C原粉(包括药用、食品用、饲料用、化妆品用)生产装置,新建药品、食品、饲料、化妆品等用途的维生素B1、维生素B2、维生素B12、维生素E原料生产装置。
(2)新建青霉素工业盐、6-氨基青霉烷酸(6-APA)、化学法生产7-氨基头孢烷酸(7-ACA)、化学法生产7-氨基-3-去乙酰氧基头孢烷酸(7-ADCA)、青霉素V、氨苄青霉素、羟氨苄青霉素、头孢菌素C发酵、土霉素、四环素、氯霉素、安乃近、扑热息痛、林可霉素、庆大霉素、双氢链霉素、丁胺卡那霉素、麦迪霉素、柱晶白霉素、环丙氟哌酸、氟哌酸、氟嗪酸、利福平、咖啡因、柯柯豆碱生产装置。
(3)新建紫杉醇(配套红豆杉种植除外)、植物提取法黄连素(配套黄连种植除外)生产装置。
(4)新建年产5万吨以下柠檬酸生产线;10万吨/年及以下赖氨酸、苏氨酸生产线;20万吨/年及以下谷氨酸生产线。
3.淘汰类
(1)铁粉还原法对乙酰氨基酚(扑热息痛)、咖啡因装置。
(2)年处理15万吨以下、总干物收率97%以下的湿法玉米淀粉生产线(特种玉米淀粉生产线除外)。
(二)工业和信息化部等四部门《推动原料药产业绿色发展的指导意见》
《推动原料药产业绿色发展的指导意见》明确提出,到2025年,突破20项以上绿色关键共性技术,基本实现行业绿色生产技术替代,建立原料药绿色工厂、绿色园区、绿色管理标准评价体系,主要污染物排放强度逐步下降。
《意见》提出4项重点任务。一是调整产业结构。鼓励优化产业资源配置,推进绿色生产技术改造,提高大宗原料药绿色产品比重,加快发展特色原料药和高端定制原料药,依法依规淘汰落后技术和产品等。
二是优化产业布局。按照生态保护红线、环境质量底线、资源利用上线、生态环境准入清单要求,合理规划产业区域布局。加快环境敏感区企业升级改造和产业转移,环境空气质量未达标城市应制定更严格的准入标准等。
三是加快技术创新与应用。加快推进绿色技术攻关和产业化应用,推广高效提取纯化、绿色酶法合成、微通道反应等绿色工艺,突破一批关键核心绿色技术,培育一批高质量创新型企业,打造一批创新平台、战略联盟、示范基地等。
四是推行绿色生产标准。以提高质量、节能降耗、清洁生产、污染治理、循环利用和生态保护为着力点,构建资源节约、环境友好、生态文明的绿色生产体系等。
值得关注的是,《意见》明确提出“原料药基本实现园区化生产”,这就意味着现在仍然处在非园区生产和将来要在非园区建厂的企业在近几年内要重新寻找出路。这类企业为数不少,有国有企业也有民营企业。而对于处于“环境敏感区”的原料药企业来说,只能是要么“搬”,要么“停”。当然,搬迁对企业既是机会也有挑战,一方面可以在新的厂区开展新项目引进、完成老旧项目的升级;另一方面也面临着成本增加、尽快适应园区环境复产、短时间内解决用工和引进高新技术人才等的压力。
(三)关于原料药领域的反垄断指南
为预防和制止原料药领域垄断行为,引导原料药领域经营者守法合规经营,国家市场监管总局起草了《关于原料药领域的反垄断指南(征求意见稿)》,向社会公开征求意见。征求意见稿更加明确、且细化了相关情形。原料药领域的垄断形式多样,包括包销、返点、拒绝供应等多种形式。而滥用市场支配地位导致的结果就是一些常用药品短期内急剧涨价或者断供。
2020年11月17日,国家市场监管总局发布《万邦德制药集团浙江医药销售有限公司滥用市场支配地位案行政处罚决定书》。处罚决定书显示,浙江省市场监管局于2020年8月对万邦德制药集团浙江医药销售有限公司涉嫌滥用市场支配地位行为立案调查。2020年11月,浙江省市场监管局对本案作出行政处罚决定,没收违法所得232205.11元,并处2019年度销售额3%的罚款2241753.58元,共计罚没款2473958.69元。
三、原料药产品登记备案信息
2017年11月,国家药监部门发布了《关于调整原料药、药用辅料和药包材审评审批事项的公告》,拉开了原料药产业改革的序幕。
2019年7月,国家药监局发布《关于进一步完善药品关联审评审批和监管工作有关事宜的公告》,明确原料药、药用辅料、直接接触药品的包装材料和容器与药品制剂关联审评审批和监管有关事宜。
根据上述公告,有关企业或者单位可通过CDE官网上的原料药、药用辅料和药包材登记平台,按要求提交原料药、药用辅料和药包材登记资料,获得原料药、药用辅料和药包材登记号,再待关联药品制剂提出注册申请后一并审评。
根据相关规定,药品制剂在注册时与其关联的原料药通过了技术审评,登记平台标识为“A”;未通过技术审评或尚未与制剂注册进行关联的标识为“I”;2017年11月27日之后仍有效的批准文号的原料药自动转为“A”;仿制或进口境内已上市药品制剂所用的原料药,原料药登记人登记后,可进行单独审评审批等。
实施原料药关联审评和登记备案后出现了几种变化:一是原料药与制剂生产捆绑,上下游之间形成更加紧密的关系。也就是生产商与供应商不仅是商品的供需关系,还是质量共管体。制剂方需要更加严格挑选和监督原料药供应商的产品质量、原材料追溯;而原料药企业也要把好质量关。
二是原料药短缺或垄断现象得到一定的遏制。因为原料药无须像此前那样等待审评批准,理论上说只要有符合质量管理要求和工艺标准的产品,厂家都可以登记备案,由制剂厂家公开挑选。这也让小品种原料药有机会登记备案并被制剂厂家选择。
三是产业整合加快。登记备案制降低了原料药政策准入门槛。原料药供应商需要积极寻找长期稳定下游合作方,包括与制剂企业在资本上合作;制剂方为了更好管理和长期稳定经营考虑有可能把关键原料药掌握在自己手里,从而向上游原料药延伸产业链。上、下游两个领域相向而行加快了产业整合。
数据显示,2017年11月到2020年9月,登记的原料药项目共13314件。其中与制剂共同审评关联的有10089件,含国产原料药9410件,进口原料药675件,港澳台登记的已关联原料药4件。值得一提的是,2019年原料药的登记量达到高峰,共有登记项目9738件(表3,图2)。


在品种方面,通用名药物以及不同成盐形态的产品共有2553个(药品名称),含国产2367个,进口和港澳台749个。最多的品种包括埃索美拉唑钠、盐酸法舒地尔、盐酸莫西沙星、硫酸氢氯吡格雷等,均有超过50件产品登记号(表4)。

四、原料药绿色制造和绿色工厂
自2017年工业和信息化部开展绿色工厂评价以来,医药企业共有83家获得评价。其中典型原料药生产企业有28家获得评价通过。
2017年,天津的凯莱英生命科学技术(天津)有限公司、新疆的伊犁川宁生物技术有限公司、河南的河南甾体生物科技有限公司、河北的神威药业集团有限公司、石药集团欧意药业有限公司5家率先通过绿色工厂评价。
2020年9月上旬,工信部公布了第4批获得绿色工厂评价的企业名单,其中含12家原料药厂家。2020年成为近年来原料药企业评价通过最多的一年。这12家企业包括华北制药先泰药业有限公司、山东鲁抗医药股份有限公司、珠海联邦制药股份有限公司、山东新时代药业有限公司、上海中西三维药业有限公司等(表5)。

五、中国原料药在国际市场既有优势又有阻力
原料药包括化学原料药、生化原料药和植物提取物,是中国医药领域在国际市场的一张名片,以产量大、品种多、具有价格优势而著称,特别是在大宗抗生素、维生素、氨基酸等发酵、半合成类产品领域。
2019年,我国原料药出口额近277亿美元(与2018年同比有1.7%的小幅下降),约占药品类产品出口额的78%。其中原料药产品出口额最高的有肝素、维生素C、维生素E、阿莫西林、6-氨基青霉烷酸等30多种(表6,表7,图3)。



(一)中国原料药在欧美认证和登记分布
我国原料药在国际的销售区域,主要在非法规市场以及欧美的低端市场。但近5年,这一状况正在逐步改变,国内原料药企业纷纷向欧美日等药政法规门槛较高的领域开拓,开展原料药主文档编写和提交登记认证工作。
截至2020年上半年,中国境内原料药在欧洲药品质量管理局(EDQM)获得的原料药欧洲药典适应性证书(CEP)总计355件,目前处于有效期的有313件,其中2019年超过了百件,达到110件,成为仅次于印度的原料药CEP证书来源国家(图4)。

这些证书的产品涉及高血压、消化系统、肿瘤、抗感染、激素、神经系统等领域,约有200多个品种。获得证书的企业约170家,主要集中在浙江、江苏、湖北、山东、河北等省份。其中,浙江华海药业有限公司拥有17件证书,山东安信制药(齐鲁集团)拥有10件(表8)。

截至2020年上半年,在美国FDA登记备案的药品主文件(DMF)处于有效的登记量中,来自于中国生产的原料药共有1700多件,其中2019年共有147件。截至2019年底,持有最多DMF文件号的生产企业是浙江华海药业有限公司、浙江海正药业有限公司、江苏恒瑞医药股份有限公司、山东新华制药、上海迪赛诺化学制药、东阳光药业等(表9)。

(二)中国原料药遇到的新挑战
面对不断崛起的中国医药产业,国际上少数制药大国提出要摆脱对中国原料药的依赖;加之受新冠肺炎疫情影响,全球贸易(包括医药贸易)受到冲击,中国原料药在国际市场上遇到新的挑战。
但纵观种种言论,不难发现:国际市场竞争已不是某个产品的竞争,而是产业链的竞争。2020年初赛诺菲就发布消息,要建立自己的商业化原料药产业基地。当然,大型跨国公司要实现自身产业链内循环是有一定意义的,但不可忽视的是会大大提高管理和生产成本,且分散自身优势。对于大多数制药企业来说,还是专业性分工合作更有利于自身发展。
中国提供的原料药产品,多为上述国家不愿意生产,或者是环保、安全性及成本优势远差于中国。也因为中国提供原料药,为这些国家大大提高了制剂生产效率,同时降低了成本。中国原料药对世界医药行业的贡献有目共睹。
疫情之后,最有可能受到影响的是向欧美高端市场开拓的中国优质原料药,包括创新药和中间体。一是相关国家可能会设置门槛;二是政府通过提高税率、对输入方采取经济措施等,迫使采购方放弃与中国合作。在这种情况下,中国原料药要将成本优势向制剂转移,加快成品药在国际市场的布局;争取获得原研方的专利授权、专利转让等知识产权方面的地位,由仿制药为主转向专利药领域。
对于中国原料药企业来说,首先是要做好自己的事,更加小心和严格管理,实现绿色可持续发展;其次是与合作方积极主动沟通,提高服务质量,同时加大国内产业链完善和市场供应,避免国际市场变化产生的不利影响;第三仍要在创新上下功夫。(摘自中国医药科技出版社《2019年中国药品蓝皮书》)