(1)全球新冠发病率和死亡率
新冠病毒的大流行,使得全球经济陷入1929年大萧条以来最严重的衰退。尽管中国封城措施在新冠疫情初期遭到部分外国舆论的抨击,但是意大利、英国、日本等多个发达国家都在疫情恶化后采取了封城甚至关闭国境的措施。
据世界卫生组织(WHO)统计,截至2021/12/29,全球范围内新冠病毒确诊累计突破2.8亿人,造成了超540万例死亡。因许多国家无法准确记录死于新冠的人数,如印度和其他非洲国家,因此美国流行病学专家Denis Nash称,因新冠致死的真实人数可能被低估了“2到10倍”。自2021年7月初,在当时全球新冠死亡人数达到400万,新冠致死速度略有放缓,尽管自那时起Delta变体迅速蔓延。这表明疫苗的广泛接种可能正在产生效果。新冠病毒用了9个月的时间杀死一百万人,又花了3.5个月的时间累计致死两百万人,又花了3个月的时间达到三百万人,大约2.5个月的时间超过四百万人。全球新冠病毒肺炎累计确诊病例数见图1;全球新冠病毒肺炎累计死亡病例数见图2。
nce="true">
▲图1 全球新冠病毒肺炎确诊病例数
来源;WHO统计,数据截至2021/12/29
nce="true">
▲图2 全球新冠病毒肺炎死亡病例数
来源:WHO统计,数据截至2021/12/29
新冠病毒感染人数中,美国处于“领先”地位,累计确诊病例超5254万。印度和巴西的累计确诊人数分别超3480万和2224万,位列第二、三名。在累计死亡病例数上,美国仍然排在首位,总共确认的死亡人数超过81万。在美国之后,报告死亡人数最多的国家依次是巴西、印度、俄罗斯。
(2)疫情发生的时间线
据相关报道,武汉并非新冠病毒发源地。欧美诸国比武汉华南海鲜市场更早出现新冠阳性病例。但是本文重点并非此,而是更关注针对新冠这一全球流行疾病,全球研发生态的构建上来。全球新冠病毒首波疫情发展的主要时间线,见图3。
nce="true">
▲图3 全球第一波新冠病毒疫情重点时间线
来源:新闻整理
(3)Variants变异毒株演变史
2021年11月9日首次检测到B.1.1.529突变株样本,于非洲南部的博兹瓦纳发现,随后在南非蔓延。2021年11月24日,南非向WHO报告B.1.1.529突变株。2021年11月26日,WHO正式将新冠病毒突变株B.1.1.529升级为令人担忧的突变株(Variant of Concern, VOC);其系统命名定为Omicron(奥密克戎)。
目前,非洲以外的多个国家和地区如中国香港、以色列、比利时、荷兰、意大利、英国、德国、丹麦、澳大利亚、捷克等都已经检出Omicron突变株。2021年11月28日,荷兰卫生部确诊了11月26日从南非飞来的航班上的61例新冠阳性患者,其中13例为Omicron突变株,占比21%。受新冠病毒奥密克戎变异毒株的影响,以色列、日本相继颁发禁令,即日起暂停所有国家和地区外国人新的入境。
2021年11月28日,上海市新冠肺炎临床救治专家组组长张文宏医生,对新冠病毒变异毒株奥密克戎发表了看法。他表示奥密克戎目前对中国不会产生大影响,中国目前的快速响应与动态清零策略是可以应对各种类型的新冠变种的。奥密克戎变异的突变点数量远超已经发现的所有新冠病毒变种。目前多数认为该变种可能是在免疫功能缺陷者,如艾滋病患者体内经过长时间的携带最终进化而成。形成新变体后,又经过偶然的机会经过传播,并迅速在传播上超越了已有的病毒传播能力,成为南非近期所记录的病毒株中的优势株(占比90%以上)。
新冠病毒自出现以来主要经历了5次变异。VOC是目前病毒监测系统中最高级别,此前被纳入VOC的包括最早在英国发现的Alpha毒株、最早在南非发现的Beta毒株、最早在巴西发现的Gamma毒株和最早在印度发现的Delta毒株,其中Beta株和Gamma株均为局部流行,Alpha株相对传播较广,Delta株为当前主要流行毒株。
新冠病毒变异毒株Delta(德尔塔)最早于2020年10月出现在印度。2021年5月,世卫组织将最早在印度发现的新冠病毒变异毒株B.1.617.2命名为“德尔塔”变体。德尔塔变体被确定为印度第二波疫情的驱动因素之一。2021年9月,钟南山团队首次精确描绘德尔塔传播链,揭示了德尔塔变异株具有潜伏期短、传播速度快、病毒载量高、核酸转阴时间长、更易发展为危重症等特点。截至2021年9月22日,已有185个国家和地区出现德尔塔变异株感染者。
(4)新冠病毒感染后遗症
根据WHO统计的死亡和确诊病例统计,新冠病毒肺炎的致死率不到2%。因为很多国家的死亡人数统计不准确,实际死亡率是要高于2%的。WHO统计的SARS死亡率为10.8%。虽然新冠病毒的死亡率低于SARS病毒,但是众多专家认为不能因为新冠病毒的致死率低就掉以轻心。武汉协和医院的研究团队在《科学前沿》期刊上发布的论文显示,出院近一年的新冠康复者几乎都存在着各种严重的后遗症。
此项随访研究,共招募了120例新冠康复患者,他们在2020/1/29到2020/4/1期间从武汉协和医院和方舱医院出院,包含104例非重症和16例重症患者。研究显示,三分之一的非重症病例存在睡眠困难、呼吸急促、乏力与关节疼痛。有一半的病例出现肺功能受损,最常见的三种异常是肺部结节、线状阴影和肺纤维化。严重的肺部结节会引发长期的咳嗽和少量咳血;线状阴影则是肺炎或者肺癌才会出现的CT影像;而肺纤维化则是不可逆的病变,随着时间推移患者呼吸会越来越困难。
而国外研究指出,新冠的后遗症多达50多种。不仅仅是肺部出现损伤,还包括头疼、嗅觉丢失、味觉障碍、眩晕、耳鸣、腹泻等。还有少数康复者的后遗症涉及心血管疾病,极易引发猝死。长此以往,很多新冠康复者出现了心理问题。
因此,针对新冠病毒的疫苗研发和治疗药物的开发,对保护全球人民的健康安全意义重大。
新冠病毒预防性疫苗上市及研发进展
近日,据国务院联防联控机制科研攻关组疫苗研发专班工作组组长郑忠伟介绍:“我国目前有25 个新冠病毒疫苗进入临床试验阶段,其中4个疫苗获得了我国药监局批准附条件上市,3 个疫苗于近期在我国获批紧急使用,14 个疫苗在境外获批开展Ⅲ期临床试验,进展总体顺利。”
国外的BioNTech/辉瑞、Moderna以最快的速度开发上市了抗新冠病毒的mRNA疫苗,强生、阿斯利康及国内的康希诺相继上市腺病毒载体的新冠病毒疫苗,国药集团中国生物和科兴中维上市了传统的灭活疫苗。这些药企上市的新冠疫苗的全球首次获批(或紧急使用授权)的时间线见图4,它们的技术路线及详细信息见表1。
nce="true">
▲图4 全球新冠疫苗上市时间轴
来源:公开信息整理(此表时间为全球首次批准/紧急使用授权的时间)
表1 全球上市的新冠疫苗品种比较
nce="true">
▲来源:各公司官网及其他公开信息整理。EUA,紧急使用授权。
备注:此表国外上市疫苗只呈现欧美大规模使用的两款mRNA疫苗,如强生、阿斯利康的腺病毒载体疫苗因可能引起血栓等严重副作用的争议并没有被广泛使用,不在此表呈现。
全球科研工作者针对新冠病毒疫苗的开发,主要围绕五条技术路线。分别为:核酸疫苗(mRNA疫苗和DNA疫苗)、灭活疫苗、腺病毒载体疫苗,重组蛋白疫苗和减毒流感病毒载体疫苗。
表2 新冠疫苗五种技术路线对比
nce="true">
▲来源:Viral targets for vaccines against COVID-19[J]. Nature Reviews Immunology, 2021, 21(2): 73-82.
备注:截至目前,只有减毒流感病毒载体新冠疫苗尚未有品种获批上市。
(1)mRNA疫苗上市品种概述
从1960年首次成功提取mRNA,到2020年新冠mRNA疫苗上市,已经走过整整六十年的时间。mRNA的工业化转化史已经有20年的时间:2000年德国公司CureVac创立;2008年德国公司BioNTech创立;2010年美国公司Moderna创立。
Moderna和BioNTech两家公司,创造了疫苗历史上的新纪录。mRNA新冠疫苗42天进入临床,两款产品一年内上市。推动着生物医药行业加速进入第三代疫苗技术(核酸疫苗)的时代。
“
BioNTech/辉瑞上市mRNA疫苗BNT162b2
德国公司BioNTech创立于2008年,总部位于德国美因茨。目前市值250亿美元,是目前欧洲最大的生物技术领域独角兽之一。BioNTech拥有世界领先的、生产基因和细胞药物与RNA治疗和检测产品的cGMP生产基地,与美国Moderna和德国CureVac并称全球三大mRNA疗法引领者。
BNT162b2于2020年12月2日获英国药监局紧急使用授权(EUA)。EUA是针对公共卫生危机下特殊的药品审核通道,具体标准FDA会根据危机的情况来制定,比如对于新冠疫苗而言,一个很重要的标准是III期临床试验里至少一半的人接种完成后跟踪2个月。2021年8月23日,BNT162b2(商品名为Comirnaty)的BLA获得美国FDA的上市批准,这是全球首个正式获批的拥有完整III期数据的新冠疫苗。BNT162b2全球上市时间轴见图5。
▲图5 BioNTech/辉瑞mRNA疫苗BNT162b2全球上市时间轴
来源:各国药监局/公开信息整理
辉瑞是BioNTech除大中华地区以外的全球市场合作伙伴。辉瑞披露接种第三针新冠mRNA疫苗BNT162b2后的临床研究数据。结果显示,与接种完第二剂疫苗后相比,第三剂疫苗针对B.1.351变异株的中和抗体提高15-21倍,针对野生型毒株的中和抗体提高了5至10倍,针对Delta变种根据年龄段的不同中和抗体滴度也有5至11倍以上的增长。
2020年3月13日,复星医药成为德国BioNTech(拜恩泰科)在中国的战略合作伙伴,商业化基于BioNTech专有的mRNA技术平台研发的针对新冠病毒的疫苗产品。2021年8月23日晚间,在上海复星医药(集团)股份有限公司(复星医药)公布的2021半年报中,披露了新冠疫苗的相关销售数据。其与德国拜恩泰科合作的mRNA新冠疫苗复必泰,上半年在中国港澳地区纳入政府接种计划,报告期内实现收入5亿余元人民币。该疫苗截至2021年8月20日于中国香港及中国澳门分别累计接种431.4万剂、8.7万剂,共计接种440.1万剂。截至2021年11月19日,复必泰在港澳台地区已累计接种超1240万剂。同时,目前作为第三针加强针已在港澳地区施打。
“
Moderna上市mRNA疫苗mRNA-1273
2020年12月19日,FDA宣布批准Moderna新冠疫苗mRNA-1273的紧急使用授权(EUA)。该疫苗被允许用于18岁及以上的人群使用,这也是继辉瑞-BioNTech新冠疫苗BNT162b2获批紧急使用授权后批准的第二款新冠疫苗。
除了美国,mRNA-1273在50多个国家/地区的卫生机构获得紧急(或其他有条件、临时)的授权使用。世界卫生组织将其列入紧急使用清单(EUL),同时在欧盟和日本监管部门扩大其适用人群用于12岁及以上的青少年。2021年6月1日,Moderna 宣布开始向美国 FDA 滚动提交 Moderna COVID-19疫苗的生物制剂许可申请(BLA),并申请优先审查。
Moderna2021年第二季度财报中公布的数据显示,在COVEIII期临床试验中,mRNA-1273疫苗显示出93%的功效,在第二剂给药后的六个月内功效仍然持久。美国临床研究机构Mayo Clinic最新研究显示,mRNA-1273疫苗在对抗Delta病毒株感染方面的有效性显著超过辉瑞的BioNTech疫苗的有效性。
国外上市的两款mRNA疫苗市场表现见图6。
nce="true">
▲图6 全球上市mRNA疫苗2021年上半年的销售额/亿美元
来源:各公司财报数据
(2)灭活疫苗上市品种概述
“
国药集团中国生物灭活疫苗
中国生物技术股份有限公司(以下简称“中国生物”)始建于1919 年,前身为北洋政府中央防疫处。新中国成立后直属卫生部领导,现为世界500强中国医药集团有限公司(国药集团)的重要成员企业,中国生物实际控制人为中国医药集团有限公司(持股占比95.36%)。
中国生物北京生物制品研究所、武汉生物制品研究所两款新冠疫苗已分别于2020年12月30日、2021年2月25日在国内批准附条件上市。截至目前,中国生物新冠疫苗已在全球10个国家注册上市,112个国家、地区及国际组织批准紧急使用或市场准入,130多个国家提出明确需求,接种人群覆盖196个国别。中国生物新冠疫苗的产能建设始终与研发进度同步,从获批临床到附条件上市,从获批欧盟GMP认证到获批世卫组织紧急使用认证,其新冠疫苗年产能也不断扩大,目前已超过70亿剂。
2021年5月26日,国际医学期刊《美国医学会杂志》刊登了国药集团中国生物发表的《两种新型冠状病毒灭活疫苗对成人COVID-19感染的保护效力评价》,公布了两款新冠灭活疫苗Ⅲ期的临床数据。研究结果显示,中国生物两款新冠灭活疫苗两针接种后14天,能产生高滴度抗体,形成有效保护,且全人群中和抗体阳转率达99%以上。其中中国生物所属北京生物制品研究所、武汉生物制品研究所两款新冠灭活疫苗的保护效力分别为78.1%和72.8%。这两款疫苗所用毒株(WIV04和HB02株)分别分离自武汉市金银潭医院的两名患者。2021年7月20日,斯里兰卡发布了一份针对中国生物疫苗有效性的研究。研究显示,接种了两针中国生物灭活疫苗后,对德尔塔变异株仍有68%保护率。
“
北京科兴中维灭活疫苗
中国生物制药有限公司(Sino pharmaceuticals)是新冠疫苗研发企业北京科兴中维生物技术有限公司(简称“SINOVAC”)的股东,持有其15.03%的权益。
科兴中维的主要产品之一就是新冠灭活疫苗,2021年2月科兴中维新冠灭活疫苗在国内批准附条件上市。根据科兴董事长尹卫东在新冠疫苗合作国际论坛上的发言,科兴2021年已经与中国以外的20个国家签约近9亿剂疫苗合作协议。这些疫苗不仅在中国生产,也分别在印尼的Bio Farma、巴西的布坦坦研究所,以及土耳其、马来西亚、埃及的合作伙伴生产。
截至2021年11月27日,科兴克尔来福全球累计供应已经超过23亿剂,累计接种量超19亿剂。SINOVAC(科兴)表示,已经为非洲大陆近20个国家供应了新冠疫苗克尔来福,不仅包括埃及、阿尔及利亚这样相对富裕的国家,也包括中非这样不断发展的国家。据业内根据中国生物制药2021半年报相关披露推测,科兴中维上半年盈利可能超过500亿元人民币。
“
康泰生物灭活疫苗(可维克)
2021年5月8日,康泰生物生产的新冠病毒灭活疫苗(可维克)已获批在全国大部分地区紧急使用,并在广东、江苏等多个省率先全面投入接种使用。据2021年4月在《中华医学杂志》发表的相关研究论文显示,该疫苗I期、II期临床试验中0-28天免疫程序疫苗组的活病毒中和抗体几何平均滴度(GMT)为131.7,为康复者血清中和抗体GMT49.7的2.65倍。根据康泰生物新冠疫苗I/II期临床试验数据,该疫苗未发生3级以上严重不良反应,整体不良反应发生率与安慰剂组相比无显著差异。
“
医科院生物所灭活疫苗(科维福)
中国医学科学院医学生物学研究所灭活疫苗,于2021年6月9日获得国内紧急使用批准。I/II期的临床结果显示该疫苗具有良好的安全性和免疫原性,在接种机体后能够快速诱导系统的免疫应答,全程免疫后14天中和抗体与抗S蛋白抗体阳转率分别达到96%与99.33%。所开展的交叉中和试验研究表明,该疫苗免疫机体诱导的抗体具有针对不同来源新冠流行株的交叉中和能力。
据悉,医科院生物所研制的新冠灭活疫苗免疫程序与同类疫苗一致,全程接种2剂,每剂间隔2-4周,目前接种年龄为18岁及以上人群。目前,该疫苗的产业化实施工作正在稳步推进,医科院生物所在马金铺疫苗产业基地新建的新冠灭活疫苗生产车间已正式投入使用。而该疫苗的扩能项目也在紧锣密鼓的建设中,预计年底建成投产,届时疫苗的年产量将扩增至5-10亿剂。
(3)重组蛋白疫苗上市品种概述
“
中科院-智飞重组新冠病毒疫苗(智克威得)
安徽智飞龙科马生物制药有限公司(智飞龙科马)生产的重组新冠病毒疫苗(CHO细胞)(ZF2001),获批紧急使用。其原理是将新冠病毒S蛋白受体结合区(RBD)基因重组到中国仓鼠卵巢(CHO)细胞基因内,在体外表达形成RBD二聚体,并加用氢氧化铝佐剂以提高免疫原性。
智飞生物在2021年11月5日接受调研时表示,已取得重组新冠疫苗Ⅲ期临床试验关键性数据,结果显示具有很好的安全性和防病效果。智飞生物将联合中科院微生物研究所,按照国家相关政策要求,正在全力推进疫苗的综合审评、注册核查等工作。目前此新冠疫苗(智克威得)已顺利出口乌兹别克斯坦。智克威得达到WHO要求的新冠疫苗有效性标准,初步分析结果也显示其对变异毒株有不错的保护效力。
(4)腺病毒载体新冠疫苗上市品种概述
“
阿斯利康Vaxzevria
阿斯利康与牛津大学利用黑猩猩腺病毒ChAdOx1作载体联合开发了新冠疫苗Vaxzevria。2020年12月30日,此疫苗在英国获得批准;2021年1月29日获得欧盟EMA批准;2021年6月23日,获得日本PMDA批准。
截止到2021年3月20日暂停阿斯利康疫苗接种时,挪威共计132686人接受了第一剂疫苗的接种,在首次接种10天内,5名32-54岁的医护人员出现了血栓,并出现了严重的血小板减少症,其中4名患者有严重的脑出血。
德国研究人员对11名在德国和奥地利接种阿斯利康新冠疫苗后出现血栓或血小板减少的患者数据进行了分析。在这11名患者中,9名为女性,年龄在22-49岁之间,在接种疫苗后的5-16天开始出现一个或多个血栓形成事件,还有1位患者出现致命的颅内出血。在对这些患者的血液样本进行检测时,同时发现高水平的针对PF4-肝素复合体或PF4的抗体反应。
2021年4月7日,欧洲药品监管机构发现阿斯利康新冠疫苗Vaxzevria与罕见的血凝块问题之间可能存在联系。异常血凝块和低血小板被作为“非常罕见”的副作用,添加到疫苗的产品信息中。英国医药监管机构也表示,阿斯利康的新冠疫苗和罕见血凝块之间可能有联系。
“
强生疫苗Ad26.COV 2.S
2021年2月28日,美国FDA宣布颁发给强生(Johnson & Johnson)开发的新冠疫苗Ad26.COV2.S 紧急使用授权(EUA),用于在18岁以上人群中预防由新冠病毒引起的COVID-19。此款疫苗是基于该公司Ad26腺病毒载体技术开发。
支持EUA的有效性数据包括对正在南非、南美某些国家、墨西哥和美国进行的随机、安慰剂对照研究。在这些参与者中,19630人接种了疫苗,19691人接种了安慰剂。总体而言,该疫苗在接种后至少14天后,预防中度至重度/危重COVID-19方面有效率约为67%,在接种后至少28天后,预防中度至重度/危重COVID-19方面有效率约为66%。
作为EUA的一部分,FDA指出强生公司必须向疫苗不良事件报告系统(VAERS)报告以下事件:严重不良事件,多系统炎症综合征病例和导致住院或死亡的COVID-19病例。
美国疾病控制与预防中心CDC在一份声明中表示,在接种了1280万剂强生疫苗后,已经发现了大约100份关于格林-巴利综合征的初步报告。2021年4月,强生疫苗因为另一种罕见的副作用——严重血栓而被暂停使用了一段时间。FDA和CDC在恢复疫苗使用时在疫苗标签中加入了警告。
“
康希诺生物疫苗(克威莎)
康希诺生物2009年成立于天津,旗下拥有针对13个疾病领域的16种创新疫苗产品的研发管线。目前其商业化产品包括埃博拉疫苗、新冠疫苗、脑膜炎疫苗三款。康希诺生物的腺病毒载体新冠疫苗已于2021年2月获得附条件上市,成为国内首个获批的腺病毒载体新冠疫苗,也是中国目前获批上市唯一采用单针免疫程序的新冠疫苗。
从已披露的克威莎III期临床试验数据看,在单针接种疫苗14天后,疫苗对所有症状总体保护效力为68.83%;单针接种疫苗28天后,这个数字仍为65.28%。疫苗对重症的保护效力则分别为:单针接种疫苗14天后为95.47%,单针接种疫苗28天后为90.07%。
康希诺生物在财报中披露了腺病毒载体新冠疫苗的最新进展,其吸入式新冠疫苗正在进行临床试验。康希诺生物正在与世界卫生组织紧密合作以纳入紧急使用清单,且正准备在境外多个国家申请该新冠疫苗的紧急用户许可证。
康希诺腺病毒载体新冠疫苗使用的是成熟的Ad5腺病毒载体,强生使用的Ad26腺病毒载体。Ad5和Ad26这两种均为人腺病毒,其中后者比较新,在人群中的感染比例低。阿斯利康疫苗利用的ChAdOx1-s是黑猩猩腺病毒载体,人群感染比例更低。强生和阿斯利康的两种腺病毒载体更易在人群中产生免疫反应,产生高抗体滴度,缺点在于比较新,研究不如Ad5透彻,副作用也不明。
“
俄罗斯“卫星—V”疫苗
截至2021年4月,“卫星V”疫苗已经生产约2000万剂,约1600万剂进入流通。一项基于2020年12月5日至2021年3月31日期间接种的380万俄罗斯人的数据分析官方显示:从首次接种之日起第35天开始,感染率仅为0.027%,而未接种疫苗的成年人感染率为1.1%。卫星—V疫苗显示出97.6%的效力。
nce="true">
▲图7 全球上市腺病毒载体疫苗2021年上半年的销售额/亿美元
来源:各公司财报数据
备注:康希诺疫苗销售额为20.6亿元人民币,按照1美元=6.3664人民币换算成美元
(5)减毒活疫苗
新冠病毒减毒活疫苗开发,并非是将新冠病毒减毒,而是利用减毒的流感病毒作为载体,携带新冠S蛋白或S蛋白片段(如RBD),共同刺激人体产生针对流感和新冠两种病毒的抗体。国内新冠赛道开发此条技术路线的代表药企,涉及华兰生物、北京万泰生物和青岛海华生物医药等公司。截至本文成稿之日,国内尚未批准此类技术路线的新冠疫苗产品上市。
(6)在研进展
a.国内药企mRNA疫苗开发最新进展
“
复星医药
复星医药于2020年3月获得德国BioNTech中国大陆及港澳台独家上市BNT162b2授权。2021年1月获批香港紧急使用,2月获澳门进口批准。同年5月,投资1亿美元与BioNTech设立合资公司。复星医药的研发技术全部来自BioNTech,复星医药仅进行代理、区域内商业化的工作。据复星医药2021Q2财报显示,其新冠mRNA疫苗仍处于II期临床。
“
苏州艾博生物/军科院/沃森
艾博生物联合沃森生物与军科院共同开发新冠mRNA疫苗,成功获得中国历史上首个mRNA疫苗的临床批文。2020年6月获批启动临床I期(18岁以上)。2021年1月,进入临床II期(18-59岁),同年5月II期完成。同年7月,国内注册III期临床(18岁以上,纳入老龄组)。同年8月,国际III期临床获批(墨西哥、印尼、尼泊尔,18岁以上)。
2021年7月,艾博生物建成了中国首个符合GMP标准的mRNA疫苗生产基地。基地位于桑田岛区域BioBAY二期18号楼,预计年产能将达到4000万人份单剂。2021年11月,艾博生物获得江苏省首张mRNA疫苗生产许可证,将用于新型冠状病毒mRNA疫苗的生产,成为国内为数不多的具备mRNA疫苗产业化能力的生物科技企业。
“
斯微生物
2020年2月,西藏药业宣布成为斯微生物战略合作投资人;2021年1月斯微生物的mRNA新冠疫苗获批临床,3月25日正式启动临床I期;同年8月28日,西藏药业宣布终止战略合作,转为股权投资。
“
丽凡达生物
2020年2月,丽凡达生物已经进入动物试验和药效验证阶段;2021年3月,获得国家临床试验批件;同年5月底,艾美疫苗收购丽凡达50.1546%股份。
其他本土mRNA疫苗研发公司,涉及蓝鹊生物、厚存纳米、本导生物、华大基因等均未获得国家下发的临床试验批件,开发进度远落后于艾博生物、复星、斯微和丽凡达。
b.鼻喷雾化吸入型疫苗
“
康希诺/军科院
军事医学科学院陈薇团队与康希诺公司联合研制了一款雾化吸入型疫苗。此前研制的5型腺病毒载体的新冠疫苗的肌肉注射型,已经通过国外的III期临床验证,在中国已经附条件上市。雾化吸入型的疫苗,只是改进了剂型,制剂配方并没有改变。
据陈薇院士介绍,相较于注射式新冠疫苗形成的体液免疫、细胞免疫,吸入式新冠疫苗还可以形成粘膜免疫,这三重免疫是最理想的状态;雾化吸入式疫苗只需针剂疫苗的五分之一的剂量;使用雾化吸入式免疫是无痛的,拥有更高的可及性。
据康希诺披露,由其研发的雾化吸入式新冠疫苗已进入临床II期试验。国际期刊《柳叶刀·传染病》上公开发表了此雾化吸入疫苗的I期临床研究成果,在对130名参与者在第一次接种疫苗后的7天内进行随访后发现,有62名报告了至少一例不良事件,其中最常见的系统性不良事件是发烧、头痛和疲劳,但并无严重不良反应发生。
“
厦门大学/香港大学/北京万泰
由厦门大学、香港大学和北京万泰公司共同研制的鼻喷减毒流感病毒载体新冠疫苗,技术路线是采用“移花接木”的方式,把毒力强的新冠病毒的不产生危害的部分,“嫁接”到减毒的流感病毒上。具体是在双重减毒的普通季节性流感病毒载体内,插入新冠病毒刺突蛋白基因片段研发而成的活病毒载体疫苗。
目前已经进行了I期、II期临床和拓展临床试验。据厦门大学夏宁邵教授介绍,鼻喷流感载体新冠疫苗单剂接种后24小时即可起效,能满足快速应急需求,在突发大量病例出现、密接及次密接无法快速甄别管控时,可快速增强免疫屏障,提升我国点状突发疫情快速控制能力,可为大型会议或运动会提供有力保障;可保护其中的新近感染者免于重症或死亡;两剂免疫后保护效果可维持较长时间,且对老年人也有良好免疫应答;可诱导广谱免疫力,对主要变异株依然有效;喷鼻苗与灭活苗联用,优势互补可协同增效。2021年11月12日,万泰生物发布公告宣布,其鼻喷新冠疫苗在南非获得III期临床批件。
c.全球维度下疫苗研发进展
WHO于2021年11月发布了各国疫苗EUL/PQ的最新状态,详见表3。
表3 全球新冠疫苗WHO EUL/PQ审评状态
nce="true">
▲来源:WHO Guidance document 11 November 2021
备注:世卫组织的审批过程包括三步:1.EOI accepted(世卫组织受理)2.Pre-submission meeting held(专家会议评审)3.Dossier accepted for review(临床试验病例审核)。
新冠治疗性药物开发进展
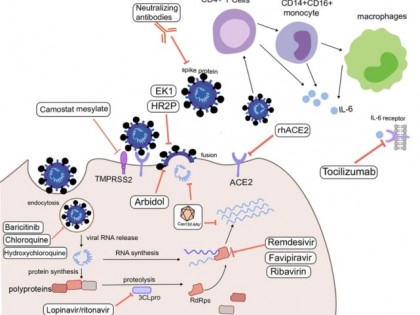
在2021年11月30日举行的国务院联防联控机制新闻发布会上,中国医学科学院病原生物学研究所研究员钱朝晖介绍,现有的新冠病毒的抗病毒治疗药物主要包括中和抗体药物和小分子药物。中和抗体药物主要是通过阻断刺突蛋白跟其受体ACE2的结合或阻断刺突蛋白的构象变化来抑制病毒的入侵。现有小分子药物的主要靶标是病毒复制酶和蛋白酶。小分子药物、中和抗体等新冠疗法开发,如火如荼得进行着。默沙东、辉瑞的小分子抗新冠口服药物近期纷纷传出喜讯,它们用于降低新冠轻症患者的住院比率的临床试验取得成功。针对新冠病毒开发的抗病毒治疗药物的不同机制策略,见图8。
nce="true">
▲图8 新冠病毒治疗药物的不同机制策略
来源:Updated approaches against SARS-CoV-2. Antimicrob Agents Chemother 64:e00483-20. https://doi.org/10.1128/AAC.00483-20.
(1)小分子药物
a.RdRp抑制剂
RdRp(RNA dependent RNA polymerase)抑制剂,是一种核苷类抗病毒药物。这类药物作用于病毒复制过程中关键的RNA依赖的RNA聚合酶。这种酶负责病毒RNA的合成,对病毒复制起着重要作用。此外,此类药物是RNA合成所需原料核苷三磷酸的类似物,所以通常具有广谱抗病毒活性。此类机制药物的副作用则需要引起重视。目前此靶点用于新冠开发的热门品种,都不是新冠爆发后新设计合成的分子实体,而是以前针对埃博拉病毒、流感病毒等开发的品种。这些药物的前期开发给抗新冠病毒小分子药物提供了前期储备。
“
Remdesivir(瑞德西韦)
Remdesivir(瑞德西韦)是吉利德开发的一款RdRp抑制剂。瑞德西韦可直接整合进SARS-CoV-2的RNA链中,产生错误的RNA从而阻断RNA复制;同时抑制SARS-CoV-2修复酶对RNA的修复作用,最终导致RNA链终止延迟。它最早于2020年5月7日在日本获得PMDA的批准上市,用于新冠病毒肺炎和冠状病毒感染的治疗;同年7月获得欧盟EMA的批准上市;同年10月获得美国FDA的上市批准。瑞德西韦上市剂型为注射给药,且结构复杂、合成困难、价格昂贵,临床显示其会产生肾脏、肝脏等毒副作用。
“
Molnupiravir
2021年11月4日,默沙东/Ridgeback宣布英国药品和保健产品监管局(MHRA)已经批准Molnupiravir上市,用于治疗轻度至中度新冠成人患者。Molnupiravir是全球首个获批用于治疗成人轻度至中度新冠的口服小分子药物。2021年10月11日,默沙东向美国FDA提交了该药物的上市申请,用于治疗新冠病毒肺炎。近日,美国FDA的专家组会议上投票通过了Molnupiravir在美国境内的使用和推广。预计不久,FDA将正式通过紧急授权。Molnupiravir会破坏SARS-CoV-2复制RNA基因组,通过改变蛋白质中氨基酸的顺序使病毒引入错误的碱基,因此基因组接连出错后新的病毒也无法存活或复制。
“
AT-527
AT-527(RO-7496998/RG-6422)是一种口服的RdRp抑制剂,由Atea制药原研,罗氏获得授权与Atea制药合作开发。双方约定,AT-527如果获批上市,将由Atea负责美国的分销,罗氏负责美国以外的分销。2021年底,中外制药获得了该品种在日本的独家开发权。但是遗憾的是,AT-527用于新冠感染的II期临床没有达到临床终点。试验结果显示,在轻度中度低风险患者中,没有达到主要临床终点(主要临床终点为病毒RNA水平检测)。对于有潜在健康问题(基础疾病)的高危患者,550 mg和1100 mg剂量组在第七天时候,病毒载量有下降趋势(相对基线降低0.5 log10单位)。罗氏给出的官方原因是,入组病人范围太宽,表示后续会继续甄别入组受试者,继续后续临床试验。
“
阿兹夫定(FNC)
2021年7月21日,真实生物研发的阿兹夫定(FNC)片获得中国NMPA的附条件上市批准,与核苷逆转录酶抑制剂及非核苷逆转录酶抑制剂联用,治疗高病毒载量的成年HIV-1感染患者。FNC是全球首个艾滋病毒逆转录酶与辅助蛋白Vif双靶点抑制剂药物,获得国家“重大新药创制”专项支持。2020年10月,Nature发表了FNC抗新冠治疗的初步进展:10位轻型和普通型COVID-19患者在服用FNC后,4天内第一次核酸转阴率达到90%。
2021年12月,中国医科院蒋建东等研究显示,FNC单磷酸盐类似物抑制SARS-CoV-2和HCoV-OC43冠状病毒;大鼠试验中FNC三磷酸(活性形式)集中在胸腺和外周血单核细胞中。一项随机单臂试验中,31名患者口服 FNC后在3.29 ± 2.22天内全部实现病毒核糖核酸检测转阴;在9.00 ± 4.93天内全部出院。表明:FNC可能通过在胸腺中富集来提高患者的抗新冠能力。目前,FNC针对新冠肺炎治疗的III期临床试验正在中国、巴西和俄罗斯加速推进中。
“
VV116
国内药企中,君实生物开发了一款口服同类机制药物VV116。VV116前期由中国科学院上海药物研究所、中国科学院武汉病毒研究所、中国科学院新疆理化技术研究所、旺山旺水生物医药有限公司、中国科学院中亚药物研发中心共同研发。君实生物已与旺山旺水生物医药有限公司达成合作,共同承担VV116项目后续在合作范围内的临床开发和产业化工作。2021年12月31日,君实生物透露,乌兹别克斯坦卫生部已批准口服核苷类抗新冠病毒药物VV116的紧急使用授权(EUA),用于治疗新冠患者。对君实生物来说,VV116的获批是继中和抗体JS016之后本土药企向世界输出的另一款治疗药物。
表4 全球新冠小分子RdRp药物临床开发进展
nce="true">
▲来源:药渡数据库及公开信息整理,临床前早期开发品种因信息披露少,故未在此表中。若有临床品种遗漏欢迎读者补充交流。
备注:RdRP,RNA dependent RNA polymerase
b.3CLp抑制剂
3CL蛋白酶在冠状病毒中属高度保守,并且催化活性中心氨基酸序列与人类蛋白酶同源性低,降低了安全性风险。2021年11月5日,辉瑞宣布其新冠口服药物Paxlovid减少新冠肺炎非住院患者的住院或死亡率高达89%。治疗组住院或死亡率为0.8%(389例中3例住院,无死亡),安慰剂组住院或死亡率为7%(385例中27例住院,其中7例随后死亡)。
复方药Paxlovid中的PF-07321332(nirmatrelvir)组分是一款3CL蛋白酶抑制剂,3CL蛋白酶是新冠病毒复制时所需的一种关键酶,Paxlovid通过抑制3CL蛋白酶表达而阻止病毒自我复制,该药物主要通过改进当年的SARS药物而开发。Paxlovid中的利托那韦组分是一种抗逆转录病毒药物,本身抗病毒活性不高,但可以有效抑制肝药酶CYP3A4活性,让nirmatrelvir能在身体里保持更长时间的活性,更好地抗击病毒。
2021年12月23日,Paxlovid获得美国FDA的紧急授权使用,适用于12岁及以上、体重不低于40公斤新冠阳性、较高风险发展为重症(住院或死亡)的人群。此款药物不能用于重症治疗,也不能替代疫苗。此次紧急使用授权基于一项随机、双盲、安慰剂对照的临床试验,招募的患者均未接受新冠疫苗注射。结果显示,与安慰剂对照组相比,Paxlovid组中出现住院或全因死亡的患者比例降低约88%。这是美国FDA紧急授权使用的首款口服抗新冠药物。
日本盐野义在2021年7月26日,启动了S-217622的临床I期试验,结果显示安全性良好,未发生严重不良毒副反应。其于2021年9月28日宣布,开展大型II/III期临床试验,预计明年第一季度实现S-217622的批准上市。III期临床的受试对象为轻度或无症状COVID-19患者,计划纳入2100人。
国内药企中,主要有前沿生物/上海药物所,和先声药业针对新冠布局了3CLp抑制剂。全球针对新冠病毒开发的临床在研3CLp抑制剂的品种信息,见表5。
表5 全球新冠小分子3CLp抑制剂临床开发进展
nce="true">
▲来源:药渡数据库及公开渠道整理,若有临床品种遗漏,欢迎读者补充交流。
备注:3CLp,Coronavirus-3C-like-proteinase;ROA,route of administration;IV,静脉注射
c.AR拮抗剂
开拓药业开发的一款雄激素受体(AR)拮抗剂普克鲁胺,在巴西完成的临床试验显示其疗效显著,并已于2021年7月获得巴拉圭紧急使用授权。普克鲁胺目前正在开展住院新冠患者的全球多中心临床III期试验。普克鲁胺通过抑制雄激素受体功能,从转录水平下调ACE2和TMPRSS2(跨膜蛋白酶丝氨酸2)的表达,而ACE2和TMPRSS2是新冠病毒进入宿主细胞重要的受体,进而阻断新冠病毒进入宿主细胞。2021年3月11日,开拓药业公告普克鲁胺治疗COVID-19重症患者的临床试验结果。结果显示,普克鲁胺将重症新冠患者的死亡风险降低92%,住院天数缩短9天。2021年4月25日,开拓药业宣布普克鲁胺在美国成功启动COVID-19 III期临床试验及患者给药。除了新冠之外,普克鲁胺还在中美进行治疗前列腺癌和乳腺癌的临床试验。
上海复星向苏州开拓药业支付不超过5.6亿元人民币,包括首付款、开发里程碑的1.1亿元以及商业化里程碑不超过4.5亿元人民币。双方共同推进普克鲁胺的EUA(紧急使用授权)申请、推广及销售,包括印度和28个非洲国家。此外,开拓药业将基于普克鲁胺在合作区域内的未来净销售额,分级收取不低于利润总额的50%作为销售提成。
2021年12月27日晚,开拓药业发布公告称,普克鲁胺III期临床试验的中期分析未达到统计学显著性。试验招募了348名非住院、并于5天内出现了一项或多项轻微症状的患者。患者被随机分成两组,分别接受普克鲁胺和安慰剂治疗,试验主要终点为28天内患者住院(超过24小时)和死亡的百分比。此次中期分析中的患者全部来自于美国,而美国住院比率非常低,这也是导致中期分析结果没有统计学显著性的原因之一。复旦大学徐建青教授表示,普克鲁胺对重症患者会更有帮助,原因在于该药的抑炎作用较确切、但抑制病毒作用难以确切。开拓药业表示,目前公司并没有放弃研究普克鲁胺的计划,将继续和FDA沟通,对临床试验做出修改,进一步研究普克鲁胺治疗新冠的效果,计划继续招募只有基础性疾病和/或无新冠疫苗接种史的高风险新冠患者。
雄激素在人体内起着重要的作用,除了与生殖相关外,还具有保持体内激素平衡、刺激蛋白质合成代谢、促进氮沉积和增加肌纤维的数量和厚度等作用。雄激素受体(AR)是雄激素作用的中介,雄激素通过与AR结合而发挥其生理功能,因此AR拮抗剂药物则能够治疗多种雄激素相关的疾病。已上市的AR拮抗剂多是作为屈螺酮/炔雌醇等避孕药使用;以及达罗他胺、阿帕他胺、恩杂鲁胺等前列腺癌治疗药物。开拓药业的普克鲁胺和海创药业的德恩鲁胺最开始均是针对前列腺癌开发的小分子药物。恒瑞开发的AR拮抗剂SHR3680在2021年10月28日宣布,其上市申请获得CDE受理,并已纳入优先审评。适应症为高瘤负荷的转移性激素敏感性前列腺癌(mHSPC)。目前此品种的开发适应症尚未涉及新冠。
截至目前,国内药企只检索到开拓药业和海创药业在针对新冠病毒开发AR拮抗剂品种。具体信息见表6。
表6 全球新冠AR拮抗剂临床开发进展
nce="true">
▲来源:药渡数据库,若有遗漏针对新冠开发的AR拮抗剂品种项目,欢迎读者补充交流。
备注:AR,androgen receptor;ROA,route of administration;IV,静脉注射
d.ACE2受体抑制剂
研究发现,所有冠状病毒都是通过附着在受体ACE2的表面,从而入侵人体细胞。新冠病毒表面有密密麻麻的突起,其主要通过ACE2受体入侵人体。新冠病毒通过凸起的棒状粒子(S蛋白)附着在ACE2的表面,见图9。
nce="true">
▲图9 新冠病毒SARS-CoV-2附着在ACE2的表面示意图
来源:中国新药杂志,2021,30(02):154-161.
ACE2不仅存在于肺部,而是遍布于人体全身各种脏器如动脉、心脏、肾脏和肠道等。这也解释了新冠病毒不仅攻击肺部,还对全身各种脏器产生损害。中国科学家找到较强新冠病毒特异性中和活性的特定人类单克隆中和抗体,此中和抗体CB6能识别与新冠病毒受体结合区域中ACE2结合位点重叠的表位,进而通过空间障碍和直接的界面-残基,竞争干扰病毒/受体的相互作用。
截至目前,尚未发现国内外药企尤其是MNC将新冠病毒的开发焦点放在ACE2抑制剂上。全球针对新冠治疗药的目光主要聚焦在:中和抗体和RNA病毒复制抑制剂小分子药物。
(2)中和抗体
以再生元、礼来等为代表的鸡尾酒中和抗体疗法,相继获得美国FDA的紧急授权使用。腾盛博药的中和抗体疗法于2021年12月在中国紧急获批上市。中国多家企业布局了抗新冠中和抗体疗法产品,包括神州细胞、丹序生物、百济神州、复宏汉霖、绿叶制药、济民可信等。
“
REGEN-COV2(Casirivimab/Imdevimab)
再生元和罗氏联合开发的REGEN-COV2是由两种单抗Casirivimab和Imdevimab组成的鸡尾酒疗法。此款组合疗法的两种中和抗体是基于人源化转基因小鼠和单个B细胞分选技术,并经过结合能力、中和效果、三维结构等多方面筛选得到。两种中和抗体分别靶向新冠病毒刺突蛋白的不同表位,在有高风险出现疾病进展的非住院COVID-19患者中进行的III期临床试验结果显示,与安慰剂相比,接受静脉注射Ronapreve的患者住院或死亡风险降低了70%。这一组合同时将患者的症状持续时间缩短4天。此外,Ronapreve在预防新冠病毒感染方面也获得了良好的效果。在III期临床试验中,接受一剂皮下注射的志愿者,患上出现症状的COVID-19的风险降低81%。
2020年11月,美国FDA对其颁发了紧急使用授权。近日,欧盟EMA宣布,批准此组合疗法(商品名Ronapreve)获批上市,治疗不需要补充氧气且疾病恶化风险增加的成人和青少年患者(12岁以上,体重至少40公斤),它同时获批用于在青少年和成人中预防COVID-19。
“
Bamlanivimab/Etesevimab
君实生物和中科院微生物所联合开发的Etesevimab(JS016)是全球第二款进入临床试验阶段的中和抗体药物,研发进度处于全球领先水平。2020年5月,礼来与君实生物就JS016达成合作协议,君实生物持有大中华地区的所有权利,礼来负责大中华地区以外的临床开发、生产和商业化。在一项II/III期的BLAZE-1临床试验中,由礼来的Bamlanivimab(LY-CoV555)和君实生物的Etesevimab(JS016)组成的联合疗法显著降低了病毒载量,减轻了症状,且效果优于Bamlanivimab单药。2021年2月,FDA颁发了此疗法的紧急使用授权。
Bamlanivimab由加拿大AbCellera公司和美国国家过敏和传染病研究所联合开发,其源于新冠康复者B细胞的500多株候选单抗中经亲和力筛选获得,靶向S蛋白的RBD区域。而Etesevimab同样来自新冠康复者B细胞,靶向S蛋白的另一个不同表位。两者联用或可产生协同作用。近日,FDA进一步扩大此组合疗法的紧急使用授权范围,新增用于特定高风险儿科人群(从出生至12岁以下)的轻中度新冠病毒肺炎治疗及暴露后预防。至此,此组合疗法是全球首个获得紧急使用授权用于全年龄段的高风险人群预防和治疗新冠病毒的感染。
君实生物重组单抗JS026注射液近日获CDE的临床许可,拟用于COVID-19的预防和治疗。JS026以SARS-CoV-2刺突蛋白S1亚基为靶点,高亲和力结合受体结合区域(RBD)以阻断其与宿主细胞表面受体血管紧张素转化酶2(ACE2)的结合,从而阻断SARS-CoV-2侵染宿主细胞。君实生物计划开发JS026与JS016(埃特司韦单抗)联用,预防和治疗COVID-19的各种病毒突变。
“
Sotrovimab
Sotrovimab是由Vir制药公司和GSK公司联合开发的全人源新冠中和抗体,其来源于2003年SARS康复者体内分离的抗体S309,并对新冠病毒保持有中和活性。该抗体靶向SARS和新冠病毒S蛋白上的高度保守表位,因此在很大程度上避免了由突变引发的免疫逃逸。此外,通过Fc段的工程化改造,使该抗体在肺部具有较高的生物利用度,延长了半衰期。2021年5月,FDA对Sotrovimab颁发了紧急使用授权。2021年6月,一项III期临床达到主要终点。
“
Regdanvimab
韩国Celltrion公司开发的Regkirona(Regdanvimab),于2021年11月12日获得欧盟EMA的上市批准,用于治疗不需要补充氧气且疾病恶化风险增加的成人患者。此款中和抗体药物已在韩国获得全面批准,并且在印度尼西亚和巴西获得紧急使用授权。据悉,Celltrion公司正在与美国FDA 讨论提交紧急使用授权 (EUA) 申请。欧盟批准Regkirona是基于III期临床试验的阳性结果。与安慰剂对比,Regkirona治疗使得需要住院、氧疗或死亡的患者更少。在病情恶化风险增加的患者中,接受Regkirona治疗的患者中有3.1%(n=14/446)住院,氧气治疗或在治疗后28天内死亡,而安慰剂组中这一数值为11.1%(n=48/434)。
“
BRII-196/BRII-198
(安巴韦单抗/罗米司韦单抗)
BRII-196/BRII-198是由清华大学、深圳市第三人民医院和腾盛博药公司合作,利用单个B细胞分选技术从新冠患者中筛选得到的单抗组合,其通过靶向RBD,阻断S蛋白和ACE2的结合。据腾盛博药报道,初步临床观察提示该组合疗法对“阿尔法”、“德尔塔”等病毒变异株具有良好的安全性和抗病毒效果。
2021年12月8日,中国药监局NMPA批准此中和抗体组合疗法紧急上市,治疗轻型和普通型且伴有进展为重型(包括住院或死亡)高风险因素的成人和青少年(12-17岁,体重≥40kg)新型冠状病毒感染患者。其中,青少年(12—17岁,体重≥40kg)适应症人群为附条件批准。此次附条件批准是基于一项名为ACTIV-2的全球多中心III期临床试验积极数据。这项研究包括美国、巴西、南非、墨西哥、阿根廷和菲律宾等在内的全球多个临床试验中心开展,结果显示:在疾病进展的高风险的新冠门诊患者中,这一组合疗法使住院及死亡的复合终点降低80%,且具有统计学显著意义。
目前腾盛博药正在检测此疗法对奥密克戎变异株的中和活性。据报道,BRII-196/BRII-198已参与到中国700余例患者的救治当中。腾盛博药已于2021年10月向美国FDA提交了此联合疗法的紧急使用授权(EUA)申请,用于临床进展为重度疾病高风险的COVID-19门诊患者的治疗。
“
AZD7442
阿斯利康的中和抗体鸡尾酒疗法AZD7442,在一项名为PROVENT的临床试验中,入组了5197名慢性病患者(包含不适合打疫苗的患者),使新冠肺炎的发病率降低77%。此疗法若能获批上市,将会惠及慢性病及不适宜接种疫苗的群体。
“
DXP-604、DXP-593
DXP-593和DXP-604是由百济神州与丹序生物合作开发的抗新冠中和抗体。这两款中和抗体由北京大学基因组学高级创新中心借助高通量单细胞测序,从新冠康复者血液中筛选所得。据央视新闻报道,由北京大学谢晓亮团队与丹序生物联合开发的中和抗体DXP604,在患者无其他药物可用的情况下,作为“同情用药”在北京地坛医院使用,用药后部分病人已经康复出院。目前,这款药物正在开展国内II期临床试验。
“
其他(免疫球蛋白等)
国药研发的新冠特异性免疫球蛋白是以经批准的中国生物新型冠状病毒灭活疫苗免疫后的健康人血浆为原料,采用低温乙醇蛋白纯化分离法,经病毒灭活及去除方法制备而成的含有高效价新冠中和抗体的静脉注射特异性人免疫球蛋白。因为能中和新冠病毒,故此对于新冠重症及危重症患者具有很好的治疗作用。此项药物机理同新冠肺炎康复者恢复期血浆治疗一致。不同的是,特异性免疫球蛋白纯度更高、工艺复杂、研发难度更大,较康复者恢复期血浆治疗应用更加广泛,起效更快,可供重症患者和高危人群应急使用,是助力全球抗击新冠疫情的又一重要武器。
全球上市/紧急使用授权及其临床在研的抗新冠病毒中和抗体疗法的详细信息见表7。
表7 全球新冠中和抗体等生物药疗法临床开发进展
nce="true">
▲来源:药渡数据库及各种信息整理,若有中和抗体抗新冠疗法项目遗漏,欢迎读者补充交流。
备注:GVHD,Graft-versus-host disease。昂科免疫开发的CD24Fc药物是针对重症新冠引发的CRS并发症开发的。
(3)细胞疗法在新冠的临床应用进展
2020年3月,中国医学科学院/北京协和医学院的赵春华团队研究发现,间充质干细胞移植疗法能迅速、显著改善重症及危重症患者的预后,有效规避细胞因子风暴,为新冠肺炎患者的临床治疗提供新思路。中国科技部生物中心主任张新民在国务院联防联控新闻发布会上表示,“干细胞治疗新冠肺炎患者安全、有效,能够使重症、危重症患者呼吸困难很快得到缓解或者停止加重。一般8-10天可以达到治愈水平。”
a.干细胞疗法或成新冠治疗的主力军
“
作用机理
MSCs(间充质干细胞)是一种具有自我更新、多向分化的多能干细胞,主要存在于骨髓、脐带、外周血等组织。具有强大的组织修复、抗炎和免疫调节功能。MSCs MSCs分泌的黏附分子,内肽酶和细胞生长因子等能够促进其向不同的组织迁移,这个过程称为“归巢作用”。在不同的诱导条件下,MSCs可分化为包括肺泡上皮细胞,肺上皮细胞和血管内皮细胞等在内的多种组织细胞;还可分泌各种生长因子和趋化因子,如转化生长因子、肝细胞生长因子等,从而诱导组织驻留祖细胞的增殖和血管生成,营养神经,组织修复,促进肺部血管再生,重塑肺血管和增强肺灌注。此外,MSCs通过调控microRNA-410、microRNA-451和microRNA-145的表达调节肺功能。
干细胞治疗新冠肺炎的机理,主要有两方面:一方面是干细胞具有强大的抗炎和免疫调节功能,能通过抑制肺部浸润的免疫细胞减轻急慢性肺损伤并降低炎性因子分泌水平,降低细胞因子风暴发生的风险;另一方面是干细胞可促进急性呼吸窘迫综合征(ARDS)肺损伤中的肺泡-上皮屏障的修复,增强肺组织损伤修复能力,进一步降低肺部纤维化水平。
“
临床应用进展
新冠感染患者中20%会出现急性呼吸窘迫综合征(ARDS)、脓毒症休克、代谢性酸中毒及多器官功能障碍等重症或危重症临床表现。ARDS患者肺部毛细血管和肺泡上皮细胞受到病毒侵袭损害后导致肺泡-毛细血管通透性增加,引起肺水肿,需要肺部组织再生来恢复肺功能。
由于MSCs不表达新冠病毒的受体ACE2,因此MSCs能够抵抗新冠病毒的感染,保障了MSCs临床治疗新冠的安全性。据文献报道,MSCs治疗新冠的临床试验中,其注入数量在0.5*106-1*107细胞/kg之间,并且在2-3天内上述剂量需要注射3-4次,用量非常大。
目前用于新冠临床研究的MSCs主要包括:脐带间充质干细胞、骨髓间充质干细胞,牙齿间充质干细胞,脂肪间充质干细胞,以及来自MSCs的外泌体等。据McIntyre研究发现,冷冻MSCs治疗效果优于新鲜MSCs,异体MSCs要比自体MSCs产生更好的治疗效果。MSCs的全身递送可减轻新冠感染引起的多器官功能障碍症状,包括心血管、肾脏或肝脏损害。研究发现,MSCs移植后2-4天,患者的高烧消退,肺泡恢复换气功能,天冬氨酸转氨酶、肌酸激酶活性和肌红蛋白降至正常参考值;移植后第9天,肺部毛玻璃样混浊和肺炎浸润显著降低。初步证实MSCs静脉移植可以治疗新冠危重症患者。
2021年6月,Dilogo等人研究报道,脐带间充质干细胞(UC-MSCs)辅助治疗新冠危重症患者的疗效。结果显示,UC-MSCs组的生存率是对照组的2.5倍(P=0.047),UC-MSCs组生存的患者数为10例,对照组则为4例。
2021年10月26日,赵春华团队联合首都医科大学附属佑安医院及美国Versiti血液研究所等科研机构,最新研究被发表,在一项II期临床试验中证实间充质干细胞治疗有助于新冠肺炎患者预后。揭示了MSCs通过动员免疫细胞杀伤病毒和抑制免疫细胞过度激活这两种主要方式来协调免疫调节功能,以恢复免疫微环境稳态并促进新冠患者的免疫系统恢复的机理。
经检索ClinicalTrials.gov公开网站,共统计40余项间充质干细胞疗法产品正在针对新冠病毒感染开展II/III期临床研究。详细信息见表8。
表8 全球临床II/III期干细胞疗法用于新冠感染患者的试验统计
nce="true">
▲来源:ClinicalTrials.gov,截至2021/12/14
备注:此表仅供参考,欢迎读者补充交流
b.CTL疗法在新冠治疗研究进展
细胞毒性T淋巴细胞(CTL)专门分泌各种细胞因子参与免疫作用,对某些病毒、肿瘤细胞等抗原物质具有杀伤作用,与自然杀伤细胞构成机体抗病毒、抗肿瘤免疫的重要防线。CTL作为机体抗肿瘤机制的重要环节,是肿瘤免疫过继疗法主要效应细胞之一。早期研究表明,T细胞对于抗击新冠肺炎进展发挥着重要的作用。超过80%的新冠肺炎住院患者出现淋巴细胞减少的症状,CD8 +和CD4+T细胞数量减少。由此可见,T细胞数量减少与患者病情呈负相关,T细胞疗法对于治疗新冠肺炎患者具有很大的潜力。
病毒特异性T细胞疗法(VST)头部企业AlloVir在2020年已经宣布,FDA已经批准其ALVR109的新药临床试验申请,用于治疗新冠肺炎重症患者。ALVR109是一款由AlloVir和贝勒医学院正在合作开发的、靶向SARS-CoV-2的特异性T细胞疗法,应用于新冠以及其他相似的冠状病毒,如SARS-CoV,MERS-CoV等。
近日,免疫治疗新锐公司Tevogen Bio宣布,其开发的CTL细胞疗法用于新冠治疗的专利获得美国专利商标局的授权。授予的专利涵盖了同种异体新冠特异性细胞毒性CD8+T淋巴细胞(CTL)疗法TVGN-489,用于高风险新冠患者研究。此产品目前正在进行概念验证临床试验。TVGN-489是高度纯化的新型冠状病毒特异性细胞毒性CD8+ T淋巴细胞,其在临床前研究中显示出对新型冠状病毒病有很强的抗病毒活性。TVGN-489刚启动治疗新冠肺炎的临床试验。根据研究团队的综合审查发现,TVGN-489预计不会受到Omicron变体的影响,将持续产生疗效。
c.CAR-γδT细胞疗法
广州百暨启动了针对新冠病毒的CAR-γδT细胞治疗的药物开发。通过对健康人的γδT细胞进行精准的基因编辑,靶向清除新冠病毒S糖蛋白及感染细胞,同时释放可溶性分子竞争性结合病毒S蛋白,以实现异体回输治疗新冠感染人群,阻止新冠疾病轻症向危重症转化。该研究已取得初步成果,正积极与印度及欧美国家寻求临床合作。
细胞疗法在危重症患者的急救治疗,以及避免肺部纤维化方面,有着其他治疗无可比拟的优势。
结语
WHO于2021年11月26日将奥密克戎列为VOC变异株,至此成为全球关注焦点。奥密克戎变异株的突变主要集中在S蛋白上,在S蛋白上的突变位点数达32个。奥密克戎变异株同时具有前4个VOC变异株Alpha、Beta、Gamma和Delta刺突蛋白的重要氨基酸突变位点。鉴于奥密克戎变异株在南非的快速流行趋势,包括美国、英国、欧盟、俄罗斯、以色列、日本、我国台湾和香港等在内的多个国家和地区纷纷限制来自南非或其他地区的旅客入境。我国的“外防输入,内防反弹”防控策略对奥密克戎变异株仍然有效。
与其他VOC变异株相比,目前尚不确定奥密克戎变异株传播力、致病性和免疫逃逸能力是否更强,相关研究在未来的几周内将得到初步结果。但目前已知的是,所有变异株都可能导致重症或死亡,因此预防病毒传播始终是关键,新冠疫苗对减少重症和死亡仍然有效。中国工程院院士钟南山表示,奥密克戎变异株的危害性还需要一段时间的判断,是否需要针对它进行疫苗研发,现在下结论为时太早。
辉瑞与BioNTech公司于2021年12月9日宣布,接种三剂mRNA疫苗BNT162b2后,所诱导出的血清抗体可以中和最新出现的新冠奥密克戎变种。只接种两针疫苗的个体,其血清对奥密克戎变种的中和滴度出现明显降低(相较对野生型的中和滴度),幅度达25倍;在接种第三针疫苗后,针对奥密克戎变种刺突蛋白的中和抗体滴度有明显上升。辉瑞近日表示已经针对变异株开发了首个DNA模板,并会在100天内研制针对性疫苗。
此外,辉瑞于2021年12月15日公布了口服抗新冠病毒在研疗法Paxlovid的最新临床数据。II/III期试验结果显示,Paxlovid能够使高风险发展为重症COVID-19患者的住院/死亡风险降低近90%;在发展为重症风险较低的人群中,Paxlovid能将患者住院/死亡风险降低70%。在体外生化实验显示,Paxlovid具有对包括奥密克戎在内的新冠病毒变种仍然保持强力抗病毒活性的潜力。
Moderna已宣布启动针对奥密克戎变异株的疫苗开发计划mRNA-1273.529,将在60-90天内推进到临床阶段。复星医药宣布,将与BioNTech合作开发针对奥密克戎变种的新疫苗。北京科兴于2021年12月11日宣布,已成功分离出奥密克戎变异株并获得测序结果,将评估研制奥密克戎变异株疫苗的必要性,并已做好开发新疫苗的所需准备。国药集团中国生物也已布局针对奥密克戎变异株的研发工作。
据国务院联防联控机制科研攻关组疫苗研发专班工作组组长郑忠伟介绍:从近期国内散发疫情来看,国产疫苗对德尔塔变异株依然有效。当前,各疫苗研发单位已经针对各主要变异株疫苗开展了一系列工作:一是开展了Gamma变异株和Delta变异株的灭活疫苗研究,目前临床前研究已完成,部分单位已向药监局药品审评中心提交临床试验申报资料;同时,部分单位正在开展二价疫苗的临床前研究;二是开展了针对不同突变株的广谱或多价重组蛋白疫苗研究,部分单位也已向药监局药审中心滚动提交临床试验申报资料;三是开展了针对Beta变异株、Delta变异株的腺病毒载体疫苗和核酸疫苗研发工作,部分单位已经完成动物有效性和安全性实验,正在准备申报临床试验。此外,有关机构也已初步制定完成变异株疫苗研发和评价的指导原则,一旦出现严重突变株,针对该突变株的疫苗可很快投入生产。
人类对新冠的战争,已经从被动转为主动,并通过预防、治疗等多层面的手段将影响降到最低。
人类对新冠的战争,已经从被动转为主动,并通过预防、治疗等多层面的手段将影响降到最低。
【参考文献】
(下滑查看)
1. Assessment of Sequelae of COVID-19 Nearly 1 Year After Diagnosis. Front. Med., 23 November 2021 | https://doi.org/10.3389/fmed.2021.717194
2. 张亚男,马俊扬,胡晓光,陈灿灿.冠状病毒疫苗研发的若干技术路线[J].中国新药杂志,2020,29(18):2103-2108.
3. Dai L, Gao G F. Viral targets for vaccines against COVID-19[J]. Nature Reviews Immunology, 2021, 21(2): 73-82.
4. Al Kaabi N, Zhang Y, Xia S, et al. Effect of 2 Inactivated SARS-CoV-2 Vaccines on Symptomatic COVID-19 Infection in Adults: A Randomized Clinical Trial[J]. Jama, 2021.
5. Schultz N H, Sørvoll I H, Michelsen A E, et al. Thrombosis and thrombocytopenia after ChAdOx1 nCoV-19 vaccination[J]. New England journal of medicine, 2021, 384(22): 2124-2130.
6. Greinacher A, Thiele T, Warkentin T E, et al. Thrombotic thrombocytopenia after ChAdOx1 nCov-19 vaccination[J]. New England Journal of Medicine, 2021, 384(22): 2092-2101.
7. https://sputnikvaccine.com/newsroom/pressreleases/second-interim-analysis-of-clinical-trial-data-showed-a-91-4-efficacy-for-the-sputnik-v-vaccine-on-d/
8. Citation Li H, Zhou Y, Zhang M, Wang H, Zhao Q, Liu J. 2020. Updated approaches against SARS-CoV-2. Antimicrob Agents Chemother 64:e00483-20. https://doi.org/10.1128/AAC.00483-20.
9. Zhang J L, Li Y H, Wang L L, et al. Azvudine is a thymus-homing anti-SARS-CoV-2 drug effective in treating COVID-19 patients[J]. Signal Transduction and Targeted Therapy, 2021, 6(1): 1-15.
10. Good S S , Westover J , Jung K H , et al. AT-527, a Double Prodrug of a Guanosine Nucleotide Analog, Is a Potent Inhibitor of SARS-CoV-2 In Vitro and a Promising Oral Antiviral for Treatment of COVID-19[J]. Antimicrobial agents and chemotherapy, 65(4):e02479-20.
11. 蔡金原,朱传龙.血管紧张素转化酶2在新型冠状病毒肺炎中的作用研究进展[J].医学研究生学报,2021,34(01):107-112.DOI:10.16571/j.cnki.1008-8199.2021.01.020.
12. 顾觉奋.新型冠状病毒肺炎临床治疗药物最新研究进展[J].中国新药杂志,2021,30(02):154-161.
13. 金振娅. 我国二十五个新冠病毒疫苗进入临床试验阶段[N]. 光明日报,2021-11-22(008).
14. 康晓. 新冠疫情危机与全球治理新态势[J]. 国际论坛,2021,23(2):19-33. DOI:10.13549/j.cnki.cn11-3959/d.2021.02.002.
15. 彭静,宋静,栾家杰. 新型冠状病毒肺炎治疗新策略:间充质干细胞疗法[J]. 中国临床药理学与治疗学,2021,26(9):1073-1079. DOI:10.12092/j.issn.1009-2501.2021.09.014.
16. Leng Z, Zhu R, Hou W, et al. Transplantation of ACE2-mesenchymal stem cells improves the outcome of patients with COVID-19 pneumonia[J]. Aging and disease, 2020, 11(2): 216.
17. Zhu R, Yan T, Feng Y, et al. Mesenchymal stem cell treatment improves outcome of COVID-19 patients via multiple immunomodulatory mechanisms[J]. Cell research, 2021: 1-19.
18. Dilogo I H, Aditianingsih D, Sugiarto A, et al. Umbilical cord mesenchymal stromal cells as critical COVID‐19 adjuvant therapy: A randomized controlled trial[J]. Stem cells translational medicine, 2021.