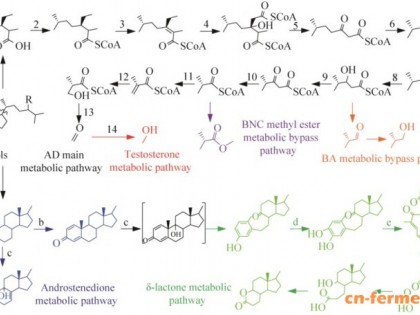
以分枝杆菌为底盘细胞生物合成甾药中间体的研究进展


日期:2023-12-16
来源:生物工程学报 浏览:
2590 评论:0 核心提示:目前,甾药行业主要通过分枝杆菌(Mycobacteria)转化制备系列重要甾药中间体,再经过必要的化学修饰或酶法修饰获得高端甾体药物。较之前的“薯蓣皂素-双烯醇酮”体系具有原料廉价且来源丰富、生产成本低且反应路线短、收率高且环境友好等优点。基于基因组学和代谢组学进一步揭示分枝杆菌甾醇降解途径中关键酶系及其催化机理,使分枝杆菌作为底盘细胞成为可能。本文对不同物种类固醇转化酶的发现、分枝杆菌自源基因和异源基因过表达的改造以及分枝杆菌作为底盘细胞的优化和修饰等方面的研究进展进行了综述。
■ 导读
甾体化合物是一类广泛存在于自然界中重要的特殊多元环萜类化合物,经过C1,2双键、酮基、羟基、烷基或卤素原子等系统修饰后形成的甾体药物,具有显著的抗炎、抗过敏、抗病毒、抗感染、抗肿瘤以及抗休克等药理活性作用,是仅次于抗生素的第二大类化学药。传统上,甾体药物通过“薯蓣皂素-双烯醇酮”的化学半合成路线生产,污染较大。近年来,已经可以用廉价的植物甾醇为原料,通过微生物降解代谢生产所需要的关键甾药中间体,如4-雄烯二酮,“植物甾醇-雄烯二酮-甾体药物”的生物合成新路线正在逐渐形成。植物甾醇在微生物体内的代谢途径可简化甾体侧链降解途径Ⅰ和甾体母核降解途径Ⅱ。分枝杆菌和红球菌是两类能够对植物甾醇进行特异性降解获得目标甾体药物中间体的主要微生物,这类微生物自身具有完善的甾醇降解基因簇以及丰富的β-氧化酶系,细胞壁特殊的亲脂性结构也有利于对甾醇分子的摄取与转化。
宋士奎等对分枝杆菌底盘细胞和代谢途径改造进行了总结,可为甾体药物的绿色生物制造提供参考。
以分枝杆菌为底盘细胞生物合成甾药中间体的研究进展
宋士奎,何建新,黄永棋,苏正定
宋士奎, 何建新, 黄永棋, 苏正定. 以分枝杆菌为底盘细胞生物合成甾药中间体的研究进展[J]. 生物工程学报, 2023, 39(3): 1056-1069.
摘要:甾体药物(steroid drugs)是一类具有重要生理和药理作用的药物。目前,甾药行业主要通过分枝杆菌(Mycobacteria)转化制备系列重要甾药中间体,再经过必要的化学修饰或酶法修饰获得高端甾体药物。较之前的“薯蓣皂素-双烯醇酮”体系具有原料廉价且来源丰富、生产成本低且反应路线短、收率高且环境友好等优点。基于基因组学和代谢组学进一步揭示分枝杆菌甾醇降解途径中关键酶系及其催化机理,使分枝杆菌作为底盘细胞成为可能。本文对不同物种类固醇转化酶的发现、分枝杆菌自源基因和异源基因过表达的改造以及分枝杆菌作为底盘细胞的优化和修饰等方面的研究进展进行了综述。
甾体化合物又名类固醇(steroids),是一类广泛存在于自然界中重要的特殊多元环萜类化合物[1]。环戊烷多氢菲式的母核结构是此类化合物的核心部分。经过C1,2双键、酮基、羟基、烷基或卤素原子等系列的修饰后而具有显著的药理活性的甾体化合物,称之为甾体药物(steroid drugs)[2-4]。甾体药物具有显著的抗炎、抗过敏、抗病毒、抗感染抗肿瘤以及抗休克等药理作用,是仅次于抗生素的第二大类化学药[2]。全球已上市的甾体药物已超过300种,且每年仍然保持持续增长的态势[5]。甾体激素类药物在改善人类健康状况、抗衰老、提高生活品质等方面发挥着越来越重要的作用,作为合成甾体药物的前体(简称为甾药中间体),其市场需求量同样日益剧增。近年来,由于“薯蓣皂素-双烯醇酮”的化学半合成路线存在严重弊端,限制了其规模化应用[6]。人们从微生物转化工艺中看到希望,以来源廉价且广泛的植物甾醇为原料通过微生物降解代谢积累所需要的关键甾药中间体,比如:4-雄烯二酮(4-androstene-3,17-dione, AD)、1,4-雄烯二酮(1,4-androstadiene-3,17-dione, ADD)和9α-羟基雄甾-4-烯-3,17-二酮(9α-hydroxy-4-androstenediol, 9α-OH-AD)等[7-8]。与之前的“薯蓣皂素-双烯醇酮”体系相比,微生物转化工艺具有原料来源丰富且价格低廉、生产成本低且反应路线短、收率高且更环保等优势。随着微生物转化工艺不断成熟,甾药合成生产路线逐渐转型升级为“植物甾醇-雄烯二酮-甾体药物”的工艺路线,并逐渐成为甾药行业中主流的工业生产方式[5]。目前,通过诱变育种、基因工程等方法获得很多可代谢甾醇类的微生物,而在甾药行业中常以分枝杆菌(Mycobacteria)和红球菌(Erythrococcus)等微生物对植物甾醇进行特异性降解获得目标甾药中间体。植物甾醇在微生物体内的代谢途径普遍简化为两大代谢途径,即:甾体侧链降解途径Ⅰ和甾体母核降解途径Ⅱ(图1)[9-10]。近年来,随着在分子水平上的深入研究,参与甾醇侧链降解途径中的部分酶系已逐渐被鉴定出来,例如:酰基辅酶A合成酶(FaD19)[11]、酰基辅酶A脱氢酶(ChsEs或Hsd4A)[12-13]、酰基辅酶A硫解酶(FadA5)[14]、酰基辅酶A水合酶(ChsHs)[15]等。早在2018年,本课题组就已完成对AD工业生产菌株分枝杆菌(Mycobacterium neoaurum) HGMS2的全基因组测序工作(GenBank Accession No: CP031414.1),通过基因组分析以及分子生物学手段鉴定出以下5类甾醇降解关键酶,分别为:甾醇侧链末端的单加氧酶(Mon164和Mon1973)、3-甾酮-∆1-脱氢酶(KstD211)、9α-羟基化酶(KshA395、KshA226和KshB122)、胆固醇氧化酶(ChoM1、ChoM2和HSD)、Δ5-3-甾酮异构酶(KSIs)等,本课题组对这些酶进行了酶学表征进一步确定其在甾醇降解途径中的重要作用[16]。次年,本课题组获得了分枝杆菌HGMS2的Δ5-3-甾酮异构酶(mKSI291)晶体结构(PDB: 5Z3R),并在分子水平上解析了Δ5-3-甾酮异构酶的催化机制[17]。随着基因测序技术的高速发展,基因组的测序成本逐步降低,越来越多的分枝杆菌基因组完成了测序[18-23](表1),为揭示植物甾醇代谢途径的调控机制提供了“蓝图”,同时,也为分枝杆菌的代谢工程研究及基因组编辑提供了依据。随着甾醇在微生物细胞内多酶连续催化反应作用机制逐渐被揭示以及基因编辑技术的不断成熟,才有可能通过基因敲除和异源基因过表达等手段以分枝杆菌为底盘设计改造以获得更多预期的甾药中间体高产菌株。2021年,本课题组通过对分枝杆菌降解甾醇的代谢产物分析,精准确定产生杂质产物相对应的基因位置,利用同源重组双交换的方法对工业分枝杆菌HGMS2的kstd和kshs基因进行敲除,成功消除了ADD和9α-OH-AD等杂质产物,在不影响产率的情况下大大提高了产物AD的纯度,减少了后续提取纯化工作量[24]。近年来,CRISPR-Cas9系统已被成功开发为一种强大的基因组编辑工具,并且已有人成功将其应用到分枝杆菌的基因组编辑。2018年,陈代杰团队开发了一种CRISPR-Cpf1辅助的非同源末端连接(non-homologous end joining, NHEJ)系统,并首次运用该方法对耻垢分枝杆菌进行了有效的基因编辑[25];2020年,孙义成团队构建了双质粒共转化体系,在提高NHEJ修复效率的同时结合CRISPR-Cas系统,成功在分枝杆菌中实现基因组无痕敲除,大大提高了编辑效率并简化了编辑流程[26]。此外,人们还发现许多可高效催化甾体化合物的其他种类微生物,例如赭曲霉[27]、犁头霉或新月弯孢霉[28-29]、赤霉菌[30]和灰色链霉菌[31]等,这些微生物可以催化修饰甾体化合物的本质是其体内立体选择性和区域选择性的高活性生物酶发挥功能作用。如何在分枝杆菌底盘细胞中高效利用异源基因以廉价的植物甾醇为原料来生产新型多样化甾药中间体也成为近几年研究的热点[32]。本文对近几年以分枝杆菌为底盘细胞改造设计构建多品种高产甾药中间体菌株的研究进展进行了综述。图1 分枝杆菌植物甾醇降解途径 Ⅰ:甾醇侧链降解途径. Ⅱ:甾醇母核降解途径甾体化合物经过系列的加工修饰后可成倍提高其药理活性,比如:醋酸可的松在其C-1,2位引入双键生成醋酸脱氢可的松(强的松)后,其抗炎作用增加了4倍左右,同时减少了由钠滞留而带来的副作用[34];氢化可的松在其C-11位上引入β构型的羟基而具有显著的抗炎活性[35]等。甾体化合物加工修饰部位常常主要集中在甾体化合物的母核结构上,母核上不同位置的修饰以及取代基的构型赋予了其不同的药物功效[5](图2)。由于化学法修饰存在选择性差、反应路线繁杂、收率低、大多数反应对环境造成污染等问题,人们开始将目光聚集在高效、专一的生物转化法(或酶法)对甾体化合物进行绿色加工合成高附加值的甾体药物[2]。目前,甾体制药工业中最重要的生物催化反应主要有3类,分别是甾体立体选择性羟基化、区域选择性脱氢、酮基立体特异性还原或C-4,5双键选择性还原。目前研究比较热门的当属于分枝杆菌中的关键酶3-甾酮-∆1-脱氢酶(KstD),其对3-甾酮类底物的C-1,2位脱氢反应具有高效、特异性催化等特点,在甾体脱氢反应中具有非常高的应用价值。人们在分枝杆菌及其他物种中已挖掘出多种甾体脱氢酶类(表2)。本课题组从分枝杆菌HGMS2鉴定出一个KstD211,并发现该酶在催化AD反应中并不需要额外添加辅因子(PMS、甲萘醌等电子受体)即可完成酶转化反应,后来通过晶体结构模型分析,发现在KstD211的底物结合区域多出一段环区,并猜测其可能与辅酶FAD和氧之间的电子传递有关[16]。2019年,张保国研究团队异源高效表达来自新金分枝杆菌DSM1381的3-甾酮-∆1-脱氢酶(KstD2)用于高效催化AD的C-1,2位脱氢生成ADD,转化率高达99%[36];2022年,朱敦明课题组把来自丙酸杆菌属的PrKstD在大肠杆菌中表达后,采用静息细胞转化的方式可对高浓度氢化可的松进行转化反应,在6 h内的转化率达到92.5%[37]。虽然在不少其他物种中发现很多甾体脱氢酶,但经过活性检测后发现,以分枝杆菌为主的放线菌属中KstD的C-1,2位脱氢效率远高于其他物种的脱氢酶[38]。甾体制药生物催化反应中以甾体羟基化酶具有较高的应用价值潜力,目前在分枝杆菌中只发现了一类甾体羟基化酶[9α-羟基化酶(KSHs)],该酶由单加氧酶KshA和铁氧还蛋白还原酶KshB双组分组成,它与3-甾酮-∆1-脱氢酶(KstD)协同作用下使B环开环断裂形成开环物。本课题组对来自分枝杆菌HGMS2的2个KshA酶和1个KshB酶活性检测分析发现9α-羟基化酶对底物ADD的偏好性比AD高很多,同时也证明了甾体母核开环途径,即:9α-羟基化酶可以把底物ADD转化为B环开环产物,即3-羟基-9,10-断裂雄甾-1,3,5(10)-三烯-9,17-二酮[3-hydroxy-9,10-secoandrost-1,3,5(10)-triene-9-dione, 3-HSA][16](图3)。2015年,袁家代等在分枝杆菌(Mycobacterium sp.)NRRL B-3805中成功表达其他菌属高活性的kshA和kshB,并发现产9α-OH-AD的重组菌以植物甾醇为底物时,转化率高达90%[45]。2012年,Petrusma等发现对来自于红球菌(Rhodococcus rhodochrous)DSM43269的KshA1和KshA5的活性口袋入口处环状区段互换后,突变体对AD的催化活性提高了约2倍[46]。 甾体羟基化酶大部分属于细胞色素P450单氧化酶,而且需要辅酶NAD(P)H提供电子维持反应进行(表3)。2010年,Petrič等首次从米根霉(Rhizopus oryzae)中鉴定出11α-羟基化酶(CYP509C12),并成功在酵母中实现异源表达[47]。2019年,Felpeto-Santero等首次在新月弯孢霉菌中鉴定出11β-羟基化酶(CYP103168)以及还原酶组分CPR64795[48]。次年,张学礼研究团队在犁头霉菌也鉴定出一个11β-羟基化酶(CYP5311B2)及其相关的氧化还原伴侣组分,经过改造后,氢化可的松的产率高达667 mg/(L·d)[49]。甾体侧链的羟基化同样对其自身的药理活性具有重要作用,比如:维生素D3经C1和C25位羟基化转化为1R,25-二羟基维生素D3[1R,25(OH)2D3]后,该活性成分不仅提高了人体对钙的吸收活性,还常被用作抗肿瘤剂、脂肪乳剂、皮脂分泌促进剂等[50-51]。2008年,Hayashi等对CYP105A1定点突变改造后,获得的双突变体R73V/R84A对于C-25羟基化活性和C-1羟基化活性分别提高了约400倍和100倍[52]。由此说明,通过蛋白质工程和酶工程合理设计改造甾药转化酶系可进一步提高其催化活性以及区域、立体选择性,完成化学合成无法完成的反应,有望实现甾体绿色生物转化技术的工业化应用。
甾体羟基化酶大部分属于细胞色素P450单氧化酶,而且需要辅酶NAD(P)H提供电子维持反应进行(表3)。2010年,Petrič等首次从米根霉(Rhizopus oryzae)中鉴定出11α-羟基化酶(CYP509C12),并成功在酵母中实现异源表达[47]。2019年,Felpeto-Santero等首次在新月弯孢霉菌中鉴定出11β-羟基化酶(CYP103168)以及还原酶组分CPR64795[48]。次年,张学礼研究团队在犁头霉菌也鉴定出一个11β-羟基化酶(CYP5311B2)及其相关的氧化还原伴侣组分,经过改造后,氢化可的松的产率高达667 mg/(L·d)[49]。甾体侧链的羟基化同样对其自身的药理活性具有重要作用,比如:维生素D3经C1和C25位羟基化转化为1R,25-二羟基维生素D3[1R,25(OH)2D3]后,该活性成分不仅提高了人体对钙的吸收活性,还常被用作抗肿瘤剂、脂肪乳剂、皮脂分泌促进剂等[50-51]。2008年,Hayashi等对CYP105A1定点突变改造后,获得的双突变体R73V/R84A对于C-25羟基化活性和C-1羟基化活性分别提高了约400倍和100倍[52]。由此说明,通过蛋白质工程和酶工程合理设计改造甾药转化酶系可进一步提高其催化活性以及区域、立体选择性,完成化学合成无法完成的反应,有望实现甾体绿色生物转化技术的工业化应用。 甾体母核上C-3或C-17位的酮基还原反应同样具有重要的工业价值,比如目前甾体制药工业中去氢表雄酮(DHEA)主要通过3-酮基还原酶催化5-雄烯二酮制备而来[61]。2021年,朱敦明课题组对来自罗尔斯通菌属(Ralstonia sp.)的乙醇脱氢酶(RasADH)进行定点饱和突变,其中突变体F205I对多种具有C-17酮基结构的甾体底物均表现出较高催化活性,在10–30 g/L的底物浓度下,转化率高于90%,同时具有高区域和立体选择性[62]。另外,具有3-oxo-Δ4结构的类固醇可以被5α-还原酶转化为其相应的3-oxo-5α甾药活性成分,这类甾药对于多种生理和病理过程至关重要,例如:AD和睾酮分别被5α-还原酶催化为5α-雄甾烷二酮(5α-androstane-3,17-dione, 5α-AD)和二氢睾酮(dihydrotestosterone, DHT)后,可以调控前列腺癌的发展[63-64];孕酮被催化为5α-二氢孕酮后,与乳腺癌的发展密切相关[65];此外,5α-二氢孕酮的C-3位的羰基被3α-HSD酶还原为3α-OH后成为一种新型神经活性药物成分,即别孕烯醇酮,可作为GABAA受体别构调节剂,对产后抑郁症治疗具有显著效果[66]。目前,甾体制药工业中常以分枝杆菌为主的工业生产菌株对植物甾醇等原料发酵制备重要的甾药中间体(即AD、ADD和9-OH-AD),微生物转化工艺具有原料廉价且资源丰富、收率高、生产成本低、更利于环保等优势。随着分枝杆菌甾醇代谢途径中参与的酶系作用机制被逐渐揭示后,人们开始基于基因组学和代谢组学对分枝杆菌进行系列菌种改造研究。2010年,Wei等敲除掉分枝杆菌NwIB-01中的kstd基因后,发现代谢产物中AD和ADD的比例发生了明显变化,其中AD成为了优势主产物[67]。2016年,魏东芝课题组发现敲除分枝杆菌中的hsd4A基因后,代谢产物由AD转变为22-羟基-23,24-双降胆甾-4-烯-3-酮(22-hydroxy-23,24-bisnorchol-4-ene-3-one, BA or 4-HBC)为主优势产物进行积累[12]。近期,我们在Mycobacterium neoaurum HGMS2工业生产菌种中发现,kstd211、kshs、hsd4A1和hsd4A2等基因同时被敲除掉后,代谢产物中开始富集高纯度的BA产物,并揭示了AD代谢途径和BA代谢途径之间的关联性(数据未发表)。2020年,Peng等发现分枝杆菌中BA代谢途径中的一个关键酶为OpccR,并解析了其在代谢途径中的酶催化作用机制,发现将其敲除后代谢产物中BA的积累量会进一步减少[68]。2021年,Yuan等发现BA代谢途径起始于(22R)-hydroxy-3-oxo-cholest-4-en-24-oyl-CoA中间产物,并认为22R构型产物和分枝杆菌代谢甾醇侧链的EchA19酶有关[69]。2021年,宋浩课题组在敲除掉分枝杆菌(Mycobacterium neoaurum)MS136中的kstd基因后的同时,对hsd、hsd4A、kshA和kshB基因进行强化后,发现9-OH-AD的产量提高了1.45倍[70];2017年,Galán等发现当同时缺失耻垢分枝杆菌MC2155菌株的kshB和kstd基因后,突变菌株对甾醇的转化效率有了明显提高[7]。这些研究表明,基于基因组学和代谢组学对分枝杆菌进行合理设计改造可以获得预期高产目标甾药中间体的改造菌株,例如主产AD菌株经过基因敲除等方法改造后转成主产BA的基因改造菌株就是一个非常成功的案例。但分枝杆菌BA途径的代谢机制仍然不是很清楚,有待进一步研究探索。此外,分枝杆菌代谢途径的复杂性使得人们需对改造菌株重新进行工艺条件的优化,从而期望进一步提高改造菌株的生产性能[71]。分枝杆菌除了自身基因改造外,人们还想方设法将其他种属来源的高活性酶的基因在分枝杆菌细胞中表达,从而实现对甾体底物定向加工修饰,以期获得更多新型甾体药物。2020年,Felpeto-Santero等将来自米根霉(Rhizopus oryzae)的11α-羟基化酶基因优化处理后通过穿梭质粒pMV261导入耻垢分枝杆菌细胞中进行过表达,并以高产率实现了甾醇发酵生产11α-羟基化产物[72]。同年,Felpeto-Santero等用相同的策略有效表达了来自新月弯孢霉(Cochliobolus lunatus)的14α-羟基化酶的CYP系统,在单一发酵步骤中直接以甾醇为原料成功转化为14α-羟基化甾药中间体[73]。2019年,王敏课题组将来自齿垢密螺旋体(Treponema denticola)的5α-还原酶基因优化后在分枝杆菌细胞中成功表达,实现了从廉价植物甾醇发酵一锅法生物合成5α-AD[74]。2022年,魏东芝团队将来自巨大芽孢杆菌的P450-BM3的突变体基因优化后,导入分枝杆菌细胞中进行过表达,同时配合NADPH再生体系使甾醇发酵产物7β-羟基雄甾-4-烯-3,17-二酮(7β-hydroxyandrost-4-ene-3,17-dione, 7β-OH-AD)的产量较原产量提高了近4倍[75]。2017年,Sood等分别将来自睾酮假单胞菌(Comamonas testosteroni)和Cochliobolus lunatus的17β-羟基化酶基因通过耻垢分枝杆菌细胞进行过表达,利用静息细胞转化的方式能够以高产率转化甾醇或AD合成睾酮[76]。2021年,本课题组将来自红球菌高活性的9α-羟基化酶基因整合至分枝杆菌HGMS2基因组中,发现代谢产物中9-OH-AD的积累量得到显著提高[24]。这些研究结果表明,对分枝杆菌底盘细胞合理设计改造后可以赋予其自身未有新功能,从而能够以廉价的植物甾醇或其他甾体化合物为原料转化合成多样化新型高附加值的甾药中间体。甾药制备工业中,分枝杆菌在降解甾醇积累重要的甾药中间体方面效果显著,这主要归因于其自身具有完善的甾醇降解基因簇以及丰富的β-氧化酶系,此外,分枝杆菌细胞壁特殊的亲脂性结构更利于细胞对甾醇分子的摄取与转化,同时,提高了细胞在发酵过程中的耐受性[77]。早期,人们发现万古霉素或甘氨酸等物质可通过干扰肽聚糖生物合成中的转肽作用来增强分枝杆菌细胞对甾醇的转化效率[78-79]。为获得高效摄取甾醇的分枝杆菌,人们开始对参与细胞膜或细胞壁的相关基因进行敲除改造。2022年,Xiong等将分枝杆菌中embC和fbpC3基因联合缺失或失活后,发现细胞的通透性显著增强,9α-OH-AD的产量明显提高[80-81]。此外,还发现MmpL3、KasB等失活或缺失后均会对分枝杆菌细胞壁自组装产生影响,会增强细胞膜的通透性,加速甾醇分子进出细胞,提高甾醇的利用率,缩短转化时间[82-83]。同时,强化pbpB基因后发现分枝杆菌细胞壁的特性发生明显变化,同样提高了甾醇的利用效率[84]。分枝杆菌细胞被膜结构十分复杂,尽管一些细胞膜缺陷型分枝杆菌对甾醇表现出较强摄取与转化,但对细胞生理功能而言常会产生一定负面影响,比如细胞的耐受性降低、生长受损等问题,故在规模化应用时常会有整体生产力不升反降的现象出现[84-85]。分枝杆菌甾醇代谢机制十分复杂,细胞众多的代谢途径之间存有一定的关联性,细胞被膜的性质和甾醇转化关系密切。只有全面清晰了解细胞的生理代谢变化,才能发挥出更好的应用性能。有研究者基于转录组学分析发现分枝杆菌中转录调节因子sigD失活或缺失后,9α-OH-AD的产率比原来提高了22.5%[86]。后来发现灭活后的转录因子可能对细胞被膜合成相关基因的转录产生了影响,但同时考虑到其他代谢基因的转录同样会产生影响,具体的代谢机制仍然不是很清楚[87]。2017年,王敏课题组发现分枝杆菌内的NAD+/NADH的比率对维持细菌内的氧化还原平衡起到重要作用,提高比率会显著提高甾醇的转化率[88]。目前,分枝杆菌甾醇代谢机制仍不是很清楚,但随着基因测序技术的成熟以及甾醇降解基因簇的揭示,甾醇降解途径中的关键酶系及其功能结构被逐一鉴定出来,多步酶反应机制也随之被阐明,这预示着甾醇降解复杂机制的神秘面纱正被一步步地揭示出来。因此,基于基因组学、蛋白组学以及代谢组学进一步揭示关键酶系及其催化机理不仅具有重要的理论意义,而且具有重要的产业化价值。在已构建成功的高产BA改造菌株基础上进一步探明其代谢途径中关键酶系以及相应的分流机制,实现高纯度产物的积累的同时简化产物分离纯化的步骤。充分发掘甾醇降解途径中关键酶应用价值,开发出酶法等新型生物转化工艺用于制备高端甾体药物,酶催化的高效专一性不仅完美地克服化学合成法的区域与立体选择性不足,而且可以完成化学法无法完成的反应,同时借助基因突变技术改造并筛选高催化活力的酶(比如KstD脱氢酶、KSHs羟基化酶)以实现多样化甾体药物的酶法制备。此外,随着分枝杆菌甾醇代谢机理不断解析和完善,进一步提高了分枝杆菌工业底盘细胞的应用价值。通过转录组学、蛋白组学、酶工程和合成生物学分析优化其他种属来源高效的类固醇转化酶类,以分枝杆菌为底盘,设计构建新的代谢途径,开发出新型甾药中间体生产工程菌,用于生产多品种甾药活性成分(active pharmaceutical ingredients, APIs),以期实现高端甾体药物的绿色制造。
甾体母核上C-3或C-17位的酮基还原反应同样具有重要的工业价值,比如目前甾体制药工业中去氢表雄酮(DHEA)主要通过3-酮基还原酶催化5-雄烯二酮制备而来[61]。2021年,朱敦明课题组对来自罗尔斯通菌属(Ralstonia sp.)的乙醇脱氢酶(RasADH)进行定点饱和突变,其中突变体F205I对多种具有C-17酮基结构的甾体底物均表现出较高催化活性,在10–30 g/L的底物浓度下,转化率高于90%,同时具有高区域和立体选择性[62]。另外,具有3-oxo-Δ4结构的类固醇可以被5α-还原酶转化为其相应的3-oxo-5α甾药活性成分,这类甾药对于多种生理和病理过程至关重要,例如:AD和睾酮分别被5α-还原酶催化为5α-雄甾烷二酮(5α-androstane-3,17-dione, 5α-AD)和二氢睾酮(dihydrotestosterone, DHT)后,可以调控前列腺癌的发展[63-64];孕酮被催化为5α-二氢孕酮后,与乳腺癌的发展密切相关[65];此外,5α-二氢孕酮的C-3位的羰基被3α-HSD酶还原为3α-OH后成为一种新型神经活性药物成分,即别孕烯醇酮,可作为GABAA受体别构调节剂,对产后抑郁症治疗具有显著效果[66]。目前,甾体制药工业中常以分枝杆菌为主的工业生产菌株对植物甾醇等原料发酵制备重要的甾药中间体(即AD、ADD和9-OH-AD),微生物转化工艺具有原料廉价且资源丰富、收率高、生产成本低、更利于环保等优势。随着分枝杆菌甾醇代谢途径中参与的酶系作用机制被逐渐揭示后,人们开始基于基因组学和代谢组学对分枝杆菌进行系列菌种改造研究。2010年,Wei等敲除掉分枝杆菌NwIB-01中的kstd基因后,发现代谢产物中AD和ADD的比例发生了明显变化,其中AD成为了优势主产物[67]。2016年,魏东芝课题组发现敲除分枝杆菌中的hsd4A基因后,代谢产物由AD转变为22-羟基-23,24-双降胆甾-4-烯-3-酮(22-hydroxy-23,24-bisnorchol-4-ene-3-one, BA or 4-HBC)为主优势产物进行积累[12]。近期,我们在Mycobacterium neoaurum HGMS2工业生产菌种中发现,kstd211、kshs、hsd4A1和hsd4A2等基因同时被敲除掉后,代谢产物中开始富集高纯度的BA产物,并揭示了AD代谢途径和BA代谢途径之间的关联性(数据未发表)。2020年,Peng等发现分枝杆菌中BA代谢途径中的一个关键酶为OpccR,并解析了其在代谢途径中的酶催化作用机制,发现将其敲除后代谢产物中BA的积累量会进一步减少[68]。2021年,Yuan等发现BA代谢途径起始于(22R)-hydroxy-3-oxo-cholest-4-en-24-oyl-CoA中间产物,并认为22R构型产物和分枝杆菌代谢甾醇侧链的EchA19酶有关[69]。2021年,宋浩课题组在敲除掉分枝杆菌(Mycobacterium neoaurum)MS136中的kstd基因后的同时,对hsd、hsd4A、kshA和kshB基因进行强化后,发现9-OH-AD的产量提高了1.45倍[70];2017年,Galán等发现当同时缺失耻垢分枝杆菌MC2155菌株的kshB和kstd基因后,突变菌株对甾醇的转化效率有了明显提高[7]。这些研究表明,基于基因组学和代谢组学对分枝杆菌进行合理设计改造可以获得预期高产目标甾药中间体的改造菌株,例如主产AD菌株经过基因敲除等方法改造后转成主产BA的基因改造菌株就是一个非常成功的案例。但分枝杆菌BA途径的代谢机制仍然不是很清楚,有待进一步研究探索。此外,分枝杆菌代谢途径的复杂性使得人们需对改造菌株重新进行工艺条件的优化,从而期望进一步提高改造菌株的生产性能[71]。分枝杆菌除了自身基因改造外,人们还想方设法将其他种属来源的高活性酶的基因在分枝杆菌细胞中表达,从而实现对甾体底物定向加工修饰,以期获得更多新型甾体药物。2020年,Felpeto-Santero等将来自米根霉(Rhizopus oryzae)的11α-羟基化酶基因优化处理后通过穿梭质粒pMV261导入耻垢分枝杆菌细胞中进行过表达,并以高产率实现了甾醇发酵生产11α-羟基化产物[72]。同年,Felpeto-Santero等用相同的策略有效表达了来自新月弯孢霉(Cochliobolus lunatus)的14α-羟基化酶的CYP系统,在单一发酵步骤中直接以甾醇为原料成功转化为14α-羟基化甾药中间体[73]。2019年,王敏课题组将来自齿垢密螺旋体(Treponema denticola)的5α-还原酶基因优化后在分枝杆菌细胞中成功表达,实现了从廉价植物甾醇发酵一锅法生物合成5α-AD[74]。2022年,魏东芝团队将来自巨大芽孢杆菌的P450-BM3的突变体基因优化后,导入分枝杆菌细胞中进行过表达,同时配合NADPH再生体系使甾醇发酵产物7β-羟基雄甾-4-烯-3,17-二酮(7β-hydroxyandrost-4-ene-3,17-dione, 7β-OH-AD)的产量较原产量提高了近4倍[75]。2017年,Sood等分别将来自睾酮假单胞菌(Comamonas testosteroni)和Cochliobolus lunatus的17β-羟基化酶基因通过耻垢分枝杆菌细胞进行过表达,利用静息细胞转化的方式能够以高产率转化甾醇或AD合成睾酮[76]。2021年,本课题组将来自红球菌高活性的9α-羟基化酶基因整合至分枝杆菌HGMS2基因组中,发现代谢产物中9-OH-AD的积累量得到显著提高[24]。这些研究结果表明,对分枝杆菌底盘细胞合理设计改造后可以赋予其自身未有新功能,从而能够以廉价的植物甾醇或其他甾体化合物为原料转化合成多样化新型高附加值的甾药中间体。甾药制备工业中,分枝杆菌在降解甾醇积累重要的甾药中间体方面效果显著,这主要归因于其自身具有完善的甾醇降解基因簇以及丰富的β-氧化酶系,此外,分枝杆菌细胞壁特殊的亲脂性结构更利于细胞对甾醇分子的摄取与转化,同时,提高了细胞在发酵过程中的耐受性[77]。早期,人们发现万古霉素或甘氨酸等物质可通过干扰肽聚糖生物合成中的转肽作用来增强分枝杆菌细胞对甾醇的转化效率[78-79]。为获得高效摄取甾醇的分枝杆菌,人们开始对参与细胞膜或细胞壁的相关基因进行敲除改造。2022年,Xiong等将分枝杆菌中embC和fbpC3基因联合缺失或失活后,发现细胞的通透性显著增强,9α-OH-AD的产量明显提高[80-81]。此外,还发现MmpL3、KasB等失活或缺失后均会对分枝杆菌细胞壁自组装产生影响,会增强细胞膜的通透性,加速甾醇分子进出细胞,提高甾醇的利用率,缩短转化时间[82-83]。同时,强化pbpB基因后发现分枝杆菌细胞壁的特性发生明显变化,同样提高了甾醇的利用效率[84]。分枝杆菌细胞被膜结构十分复杂,尽管一些细胞膜缺陷型分枝杆菌对甾醇表现出较强摄取与转化,但对细胞生理功能而言常会产生一定负面影响,比如细胞的耐受性降低、生长受损等问题,故在规模化应用时常会有整体生产力不升反降的现象出现[84-85]。分枝杆菌甾醇代谢机制十分复杂,细胞众多的代谢途径之间存有一定的关联性,细胞被膜的性质和甾醇转化关系密切。只有全面清晰了解细胞的生理代谢变化,才能发挥出更好的应用性能。有研究者基于转录组学分析发现分枝杆菌中转录调节因子sigD失活或缺失后,9α-OH-AD的产率比原来提高了22.5%[86]。后来发现灭活后的转录因子可能对细胞被膜合成相关基因的转录产生了影响,但同时考虑到其他代谢基因的转录同样会产生影响,具体的代谢机制仍然不是很清楚[87]。2017年,王敏课题组发现分枝杆菌内的NAD+/NADH的比率对维持细菌内的氧化还原平衡起到重要作用,提高比率会显著提高甾醇的转化率[88]。目前,分枝杆菌甾醇代谢机制仍不是很清楚,但随着基因测序技术的成熟以及甾醇降解基因簇的揭示,甾醇降解途径中的关键酶系及其功能结构被逐一鉴定出来,多步酶反应机制也随之被阐明,这预示着甾醇降解复杂机制的神秘面纱正被一步步地揭示出来。因此,基于基因组学、蛋白组学以及代谢组学进一步揭示关键酶系及其催化机理不仅具有重要的理论意义,而且具有重要的产业化价值。在已构建成功的高产BA改造菌株基础上进一步探明其代谢途径中关键酶系以及相应的分流机制,实现高纯度产物的积累的同时简化产物分离纯化的步骤。充分发掘甾醇降解途径中关键酶应用价值,开发出酶法等新型生物转化工艺用于制备高端甾体药物,酶催化的高效专一性不仅完美地克服化学合成法的区域与立体选择性不足,而且可以完成化学法无法完成的反应,同时借助基因突变技术改造并筛选高催化活力的酶(比如KstD脱氢酶、KSHs羟基化酶)以实现多样化甾体药物的酶法制备。此外,随着分枝杆菌甾醇代谢机理不断解析和完善,进一步提高了分枝杆菌工业底盘细胞的应用价值。通过转录组学、蛋白组学、酶工程和合成生物学分析优化其他种属来源高效的类固醇转化酶类,以分枝杆菌为底盘,设计构建新的代谢途径,开发出新型甾药中间体生产工程菌,用于生产多品种甾药活性成分(active pharmaceutical ingredients, APIs),以期实现高端甾体药物的绿色制造。