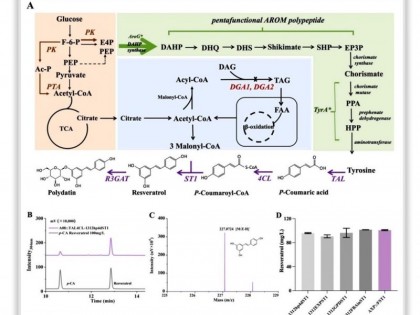
科研团队对FR901379合成基因簇进行生物信息学预测,通过基因敲除进行了系统验证并提出FR901379环脂肽骨架的生物合成途径,包括非天然氨基酸底物合成模块、环脂肽骨架组装模块和后修饰模块(图2)。然而,研究在核心基因簇mcf中始终未发现氧磺酰基模块合成基因。研究利用HMMER构建隐马尔可夫模型预测同源基因,并结合差异转录组数据,筛选可能负责氧磺酰基基团合成的候选基因。体内敲除和体外酶活结果表明,氧磺酰化修饰由细胞色素P450酶McfP和磺酰基转移酶McfS在环脂肽后修饰阶段完成(图2)。这两个修饰基因独立于环脂肽母核核心基因簇,形成了一个独立的磺酰化基因簇。这两个独立基因簇通过簇内转录调控因子McfJ实现了合成过程的跨基因簇协同作用。前期研究在土曲霉中发现了这种跨基因簇协同调控现象,这或是进化过程中丝状真菌获得复杂化合物合成能力的有效方式之一(Angew. Chem. Int. Ed. Engl., 2020, 132:4379-4383)。
该工作阐明FR901379生物合成机制后,针对棘腔孢霉发酵过程中存在产量低、副产物难分离等问题,开展了系统的工业菌株理性改造研究。该工作通过强组成型启动子对转录调控因子McfJ进行过表达,使FR901379合成途径全面上调,摇瓶产量提高了3倍,达到1.32g/L(图3A)。为了减少因氧化不充分导致的中间产物积累,该研究对关键的后修饰限速酶McfF和McfH进行过表达,合成途径优化后副产物含量减少80%以上,产量也显著提高,最终在5L发酵罐中产量达到4.0g/L,高于现有工业水平(图3B)。
磺酰基基团能够增加化合物的水溶性,进而增加药物的生物利用度,为了创制更多的磺酰化棘白菌素类化合物,研究将磺酰化模块在抗真菌药物卡泊芬净前体(纽莫康定B0)生产菌株中进行了异源重构,获得了氧磺酰化纽莫康定B0,且其水溶性提高了4000多倍。该研究为创制更多磺酰化棘白菌素类化合物提供了酶学元件和可行性验证(图4)。
该研究完整解析了FR901379的生物合成机制,在此基础上对FR901379合成途径的适配性进行优化,创制了水溶性的新型磺酰化棘白菌素类化合物,为米卡芬净生产工艺提质增效奠定了基础,并为药物水溶性提高提供了新思路。相关研究成果发表在《代谢工程》《微生物细胞工厂》上。研究工作得到国家重点研发计划青年科学家项目、国家自然科学基金、山东省人才计划等的支持。
论文链接:1、2

图1.FR901379合成调控机制解析及其应用

图2.FR901379生物合成途径

图3.棘腔孢霉代谢工程改造突变菌株发酵分析

图4.异源重构磺酰化纽莫康定B0