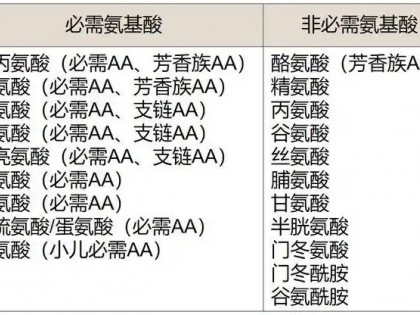
为加强化学原料药监管,国家局起草了《化学原料药生产和使用整顿工作方案》(征求意见稿),现征求意见。意见稿中对原料药制剂企业生产经营均有明确要求,同时还有具体实施的时间安排。
化学原料药生产和使用整顿工作方案(征求意见稿)
2007年,国务院开展了全国产品质量和食品安全专项整治专项行动,药监部门对药品研制、生产、流通、使用等各个环节进行了全面整治,药品生产经营秩序明显改观。为进一步加强原料药监管,解决化学原料药生产、销售和使用过程存在的问题,国家局已将加强原料药监管列入2008年工作重点,并决定先期开展化学原料药生产和使用整顿工作。
一、整顿工作原则和目标
(一)工作原则
化学原料药生产和使用问题的产生,固然有企业追逐经济利益、守法和规范生产意识淡薄的原因,但也应当看到,其中很多问题有其历史演变和积累过程,是随着药品监管法规体系的不断健全、监管工作的不断加强,逐渐得到清楚认识的。因此,当前整顿工作的基本原则是:坚决整治违法违规行为,实事求是、积极稳妥地解决历史问题,建立严格规范的生产秩序和监管长效机制,确保药品安全和质量。
从上述原则出发,整顿工作应当是在现有法规框架下,首先对制剂企业使用非法化学原料药问题、原料药企业明显的违法违规生产行为、部分出口原料药生产中存在的突出问题进行坚决的整顿规范,对原料药的销售和使用实施电子监管。其次,对原料药生产中认识模糊问题,要加强宣传教育、重申法规基本要求,尽快统一认识,在完善法规制度、提高相关GMP要求后,限期整改规范化学原料药生产过程中争议较大问题。
(二)工作目标
1.对制剂生产企业,通过开展整顿,辅以电子监管手段,严格规范原料药的供应商审计、采购入库、检验和变更行为,建立长效机制,彻底堵塞化工原料和来路不明原料药流入的漏洞,制止各种违规变更和变通使用行为,包括历史遗留的原料药违规自制行为,确保药品生产质量及安全。
2.对原料药生产企业,通过开展整顿,规范原料药生产管理,规范生产工艺和处方变更行为,严厉打击将化工厂成品冒充自行生产产品行为;通过实施电子监管手段规范销售行为。
在健全法规的基础上,对擅自改变原注册申报的部分工艺生产地而仅作精烘包、擅自改变工艺和处方行为等进行整改,实现原料药生产全过程GMP管理和监督。
3.国家局发布出口药品监管品种目录,对纳入目录中出口化学原料药的生产,采取措施实施有效监管(具体措施另行制定发布)。
二、对化学原料药生产和使用的具体要求
(一)对制剂生产企业的要求
1.生产化学原料药和按化药批准文号管理的生物提取原料药,必须取得药品批准文号、相应生产范围许可并获得该药品GMP认证,严禁擅自制备化学原料药用于制剂生产。
2.生产制剂所使用的化学原料药必须具有药品批准文号或《进口药品注册证》及相关文件,供应商审计应当包括原料药生产和经营企业并必须符合要求,对购入的每批原料药必须按规定进行全项质量检验并合格。
3.将单一纯品化学原料药改变为与其它原料药或辅料混合粉形式或变更产地之前,都必须按照药品注册管理规定进行申报并获得许可。
4.对化学原料药的生产、销售和使用实施电子监管后,必须按规定入网并上报所用原料药基本情况和采购每批原料药入库数据。
(二)对原料药生产企业的要求
1.原料药批生产记录必须真实完整,严禁将外购成品冒充自行生产产品出售。
2.必须严格按照注册申报工艺和处方生产,严格对原辅料供应商进行审计,并按规定检验合格。
3.变更生产工艺、处方和产品形式、直接接触药品的包装材料,都必须按照药品注册管理规定进行研究、验证、申报并获得批准或备案。
4.采购化学中间体进行生产或变更部分生产环节的生产场地,必须按规定申报并获得许可。
5.对化学原料药的生产、销售和使用实施电子监管后,必须按规定入网并上报每批原料药销售数据。
6.生产出口原料药,应当按照《国务院关于加强食品等产品安全监督管理的特别规定》的要求,确保产品质量。生产出口“出口药品监管品种目录”内原料药,应当符合国家局的有关规定。
(三)对原料药经营企业的要求
1.必须严格执行药品GSP,确保原料药来源清楚、文件齐全。
2.对化学原料药的生产、销售和使用实施电子监管后,必须按规定入网并上报每批原料药采购入库和销售数据。进口原料药经营企业必须按规定加贴统一标识的药品电子监管码。
(四)实施电子监管的相关要求
生产、销售和使用化学原料药,应按照国家局对药品电子监管网的统一部署,按时完成入网、赋码和上报数据工作,原料药生产企业和进口企业对每个产品最小销售包装上加贴统一标识的药品电子监管码,并上报每批产品生产销售数据,要求制剂生产企业上报每批原料药采购入库数据,原料药经营企业上报每批原料药销售数据。
三、实施步骤
第一阶段(2008年9月-2009年3月):根据国家局下发的整顿工作通知要求,进行宣传动员,要求药品生产企业限期进行自查自纠,按规定开展电子监管入网和数据上报工作,生产出口药品企业按规定进行申报。
第二阶段(2009年4月~2009年9月):按照整顿工作要求对原料药和制剂生产企业开展现场检查。对不能达到要求的企业依法查处。对电子监管网中原料药采购数据与原料药生产、进口企业销售数据出现矛盾的制剂生产企业进行重点检查。
第三阶段:2009年中开始,对擅自改变原注册申报的部分工艺生产地而仅作精烘包、擅自改变工艺和处方行为等,根据国家局原料药生产整顿规范措施,监督企业于2010年底前整改到位。
四、整顿工作要求
(一)各省局应充分认识到开展化学原料药整顿规范工作对切实保障化学药品安全和质量、规范药品生产经营秩序的重要意义,充分估计工作的困难性和复杂性,掌握好国家局制定的总体原则和对企业要求,耐心细致地做好企业宣讲和动员工作,精心组织,安监、注册、市场、信息等部门密切配合,协同努力,确保化学原料药整顿工作顺利开展,收到实效。
(二)整顿中应当注意加强药品生产许可证管理,加强对企业品种生产档案建设和管理,打好开展日常监管工作的基础。发现药品生产企业违法生产和使用化学原料药的,必须依法查处。
(三)实施原料药电子监管,是使整顿规范工作落到实处、形成长效监督机制的有效措施,必须大力推动,依法监督企业实施。电子监管实施以后,要加强数据管理,积极探索充分利用这一手段加强日常监督的工作方式。
(四)纳入整顿的化学原料药范围包括:按化药批准文号管理的合成或半合成原料药,按化药批准文号管理的生物提取原料药,中西药复方制剂中使用的按化药批准文号管理的原料药。