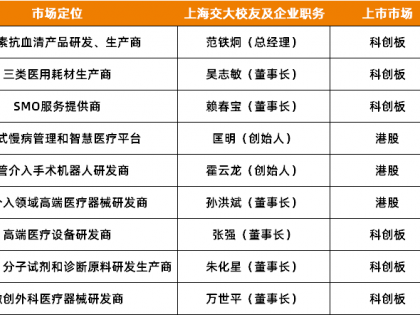
目前单克隆抗体国内共有7个批文,其中成都华神生物技术有限责任公司2条生产批文,上海中信国健药业股份有限公司、大连亚维药业有限公司、武汉生物制品研究所有限责任公司、百泰生物药业有限公司和成都康弘生物科技有限公司各1条批文,仅康柏西普眼用注射液已过GMP(2010年版)证书。
生物制品中的胰岛素的批文共37条,通化东宝药业批文数最多,共12条;其次是甘李药业和江苏万邦,各有8条批文。江苏万邦暂未过2010年版GMP。

体外诊断制品主要是北京北方生物技术研究所的批文较多,共60条;其次是原子高科股份有限公司,共44条;再次是暂未过2010年版GMP的天津协和医药科技有限公司。
疫苗类的批文数排名前三的企业分别是兰州生物制品研究所有限责任公司、武汉生物制品研究所有限责任公司和北京天坛生物制品股份有限公司。
如表2所示,未过新版GMP(2010年)的生物制品生产厂家中,天津市协和医药科技有限公司所拥有的生物制品批文数最多,有40条,批文主要是体外诊断制品。体外诊断制品、血液制品和细胞因子是未过新版GMP(2010年)的生物制品生产厂家所拥有的生物制品批文中数量最多的三类。

截止于2015年2月2日,咸达数据3.0监测的数据显示,超过三分之一的生物制品生产批文(总批文数1889条)未过新版GMP(2010年)。其中,超过四分之一的疫苗类批文(总批文数327条)未过新版GMP(2010年),超过一半的血液制品(总批文数409条)批文未过新版GMP(2010年)。
对于未过新版GMP(2010年)的血液制品批文和疫苗批文而言,若自身无新药证书资质,目前技术转让难度较大,而且疫苗和血液制品等无菌药品的GMP认证成本较高,未来疫苗和血液制品的技术转让项目预估买方主要是目前已过新版GMP(2010年)的46家生物制品厂家,其中疫苗生产厂家31家,血液制品厂家17家。
通过GMP的严格控制管理,有助于保证血液制品的质量。血液制品目前的厂家虽然多,但人血白蛋白还是供不应求,最主要的原因非生产产能,也非GMP的限制,而是在于供应的血站较少。对于生产企业来源有限的企业来说,重组人血白蛋白或许是未来的主要方向。
本文相关法规:
卫生部令第79号《药品生产质量管理规范(2010年修订)》第三百一十条规定:生物制品包括:细菌类疫苗(含类毒素)、病毒类疫苗、抗毒素及抗血清、血液制品、细胞因子、生长因子、酶、按药品管理的体内及体外诊断制品,以及其它生物活性制剂,如毒素、抗原、变态反应原、单克隆抗体、抗原抗体复合物、免疫调节剂及微生态制剂等。
血液制品特指人血浆蛋白类制品。
《关于印发药品生产质量管理规范认证管理办法的通知》国食药监安[2011]365号:放射性药品、生物制品应在括弧内注明品种名称和相应剂型。
国家食品药品监督管理局2011年02月25日发布关于贯彻实施《药品生产质量管理规范(2010年修订)》的通知:自2011年3月1日起,凡新建药品生产企业、药品生产企业新建(改、扩建)车间均应符合《药品生产质量管理规范(2010年修订)》的要求。现有药品生产企业血液制品、疫苗、注射剂等无菌药品的生产,应在2013年12月31日前达到《药品生产质量管理规范(2010年修订)》要求。其他类别药品的生产均应在2015年12月31日前达到《药品生产质量管理规范(2010年修订)》要求。未达到《药品生产质量管理规范(2010年修订)》要求的企业(车间),在上述规定期限后不得继续生产药品。
《食品药品监管总局办公厅关于注射剂等无菌药品技术转让有关事项的通知》:
一.自2015年1月1日起,已获总局批复授权的省级药品监管机构停止按《通知》的程序和要求受理注射剂等无菌药品的技术转让注册申请。对已经受理的注册申请,要严格按照《通知》要求开展技术审评工作,认真审查工艺验证、质量对比等研究资料,对不符合要求的,坚决不予审批,确保技术转让过程标准不降低,确保技术转让品种质量的一致性。
二.自2015年1月1日起,注射剂等无菌药品的技术转让注册申请,应当按照《药品技术转让注册管理规定》(国食药监注〔2009〕518号)的程序和要求申报补充申请,由国家食品药品监督管理总局进行审评审批。
《关于印发药品技术转让注册管理规定的通知》(国食药监注[2009]518号):未取得《新药证书》的品种,转让方与受让方应当均为符合法定条件的药品生产企业,其中一方持有另一方50%以上股权或股份,或者双方均为同一药品生产企业控股50%以上的子公司的。