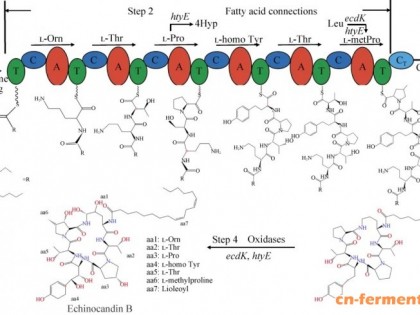
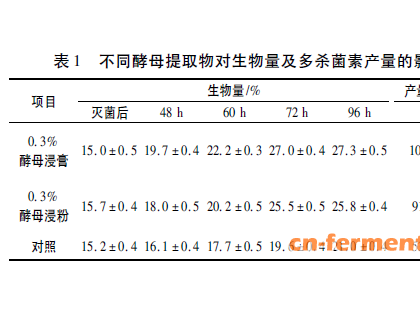
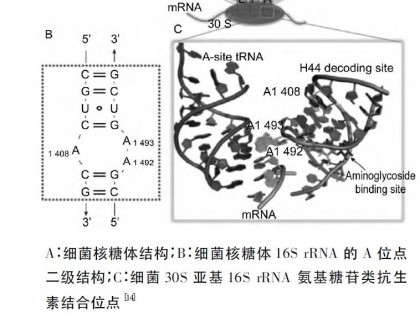
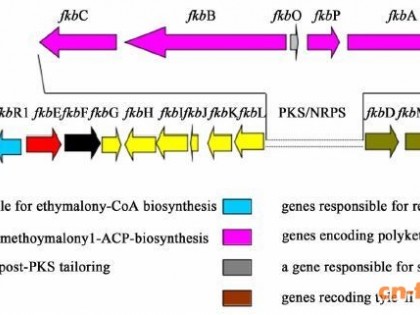
本文对莫西菌素的理化性质、作用机理、药代动力学、药效学以及药物制剂和耐药性等方面进行了综述,其中重点介绍了该药的临床效果。与其他大环内酯类抗寄生虫药的不同之处在于其成分单一,它在动物表皮和真皮中的药物浓度是皮下组织中的6倍,在动物胃肠道组织内的药物浓度明显高于肠腔中的浓度,因此有着更高的驱虫活性和长效、安全等特性,尤其对线虫(成虫和幼虫)和节肢动物,在极低的剂量下就有很好的抗虫活性。
广谱驱虫药——莫西菌素研究进展王帅1, 房春林1,2,杨光友1* (1.四川农业大学动物医学院,四川雅安 625014;2.四川乾坤集团新兽药研究所,四川成都 611130) 摘要:本文对莫西菌素的理化性质、作用机理、药代动力学、药效学以及药物制剂和耐药性等方面进行了综述,其中重点介绍了该药的临床效果。与其他大环内酯类抗寄生虫药的不同之处在于其成分单一,它在动物表皮和真皮中的药物浓度是皮下组织中的6倍,在动物胃肠道组织内的药物浓度明显高于肠腔中的浓度,因此有着更高的驱虫活性和长效、安全等特性,尤其对线虫(成虫和幼虫)和节肢动物,在极低的剂量下就有很好的抗虫活性。关键词: MXD;驱虫;药效 莫西菌素(Moxidectin,MXD)属于阿维菌素类药物。阿维菌素类药物的发现,使抗寄生虫药的药效大大提高,使用剂量从mg/kg级降到ug/kg级,开辟了抗寄生虫药的新纪元[1]。阿维菌素类药有两个家族:Avermectins和Milbemycins,MXD是Milbemycins中的一员,属于第3代此类药物[2]。20世纪80年代中期,MXD开始作为兽用驱虫药使用。在国外,同伊维菌素(Ivermectin,IVM)一样,MXD是一种目前广泛用于兽医临床的广谱、高效、新型大环内酯类驱虫抗生素[3]。 MXD是由一种链霉菌(S.cyanneogrisens notwyanogenus)发酵产生、半合成的大环内酯类抗生素,是奈马菌素(Nemadectin)的衍生物。与其他大环内酯类抗寄生虫药如伊维菌素和阿维菌素(Avermectin,AVM)的不同之处在于它是单一成分,有着更高的驱虫活性和长效、安全等特性,尤其对线虫(成虫和幼虫)和节肢动物,在极低的剂量下就有很好的抗虫活性[4]。 1 理化性质及作用机理 MXD与其他同类药相比,有更高的脂溶性,且其水溶性也高于IVM(MXD为4.3 mg/L,IVM 为0.006 -0.009 mg/L)。因此MXD能与多种赋型剂组合制成各类制剂,有着不同的给药方式和药代动力学特性,安全性也比IVM好[5]。 MXD的作用机理与IVM基本相似,可增大虫体神经突触后膜对Cl-的通透性,从而阻断神经信号的传递,最终使神经麻痹而导致虫体死亡。MXD是通过两种不同的途径来增强神经膜对Cl-通透性的,其一是通过增强虫体外周神经抑制递质r-氨基丁酸(GABA)的释放;另一途径是引起由谷氨酸控制的Cl-通道开放[4]。 2 药代动力学由于MXD的高亲脂特性,且分子量较大(639.8),虫体表面胶原基质成分像筛子一样限制其通过。因此,对于吸血寄生虫,如捻转血矛线虫(Haemanchus contortus)和吸血虱,经口吸收是其主要途径;而对胃肠道线虫,透皮和经口吸收同等重要[6]。药物被动物吸收后,广泛分布于黏膜液、胆汁、肺、皮肤和血浆等各组织和体液中,尤其在脂肪组织中分布浓度极高。试验证明,MXD在牛体内的主要代谢产物为C29-30及C14位上羟甲基化产物,这些物质约占MXD母药的13.8%,血浆中的代谢产物与母药的比率比IVM和多拉菌素(Doramectin,DOR)都高。MXD主要经胆汁、粪便排泄为主,其次是乳汁,只有少量(3% )自尿液排泄,在脂肪、靶组织和牛奶中的药物浓度明显高于IVM。有报道指出,牛奶中MXD的浓度-时间曲线下面积(areaund ercurve,AUC)的值和最高浓度(Cmax)均为IVM的7一l0倍,这也部分说明了MXD比IVM更长效的 ________________ 作者简介:王帅(1984—)硕士,从事动物寄生虫病学研究房春林(1979—)在读博士,从事新兽药产品研发 原因[7,8]。 3 剂型研究与IVM相比,MXD在制剂开发方面范围更广。目前临床上常用剂型有浇泼剂(Pour-on,0.5%)、注射剂、糊剂、胶丸、微球和缓释巨丸(sustained-release bolus,SRB)等。在与IVM相应的各剂型对比研究中,MXD表现出安全、长效、高效的特点[9-11]。现在使用最多的MXD剂型是注射剂和浇泼剂。在国外用于牛羊的注射剂和浇泼剂已注册并广泛上市。 4 驱虫活性一般来说,MXD可以用于抗多种体内外寄生虫。其中内寄生虫主要是线虫,外寄生虫有螨、蜱和蚤类等。目前,临床上主要用于对牛、绵羊、猪、马和伴侣动物寄生虫的防治。 4.1对外寄生虫的驱杀效果试验研究表明,MXD在表皮、真皮中的药物浓度是皮下组织中的6倍,因此对动物体外寄生虫的驱杀活性很强[15]。Lanusse等报道MXD浇泼剂(0.5%)一次用药,对牛食毛虱(B.vovis)和吸血虱(L.vituli)有效期达42d;0.1%注射剂按0.2mg/kg皮下注射后,有效期达35d[12]。推荐剂量(0.2mg/kg)MXD注射剂能高效驱除牛的皮蝇蛆,疗效达到100%。Parker等进行了MXD注射剂对羊疥螨和痒螨的驱杀效果的试验,注射剂(l%)按0.2mg/kg皮下给药后,对羊疥螨和痒螨感染的绵羊达到100%疗效[13]。给牛、羊和骆驼使用推荐剂量的MXD注射剂,可有效、安全地防治体外寄生虫[14]。此外,MXD还可以治疗狗和兔的体外寄生虫,在国外现已批准用于狗疥螨病的治疗,但在用于狗的寄生虫病时,口服途径较皮下注射更安全,副作用更小。 4.2 对蠕虫的驱杀效果 4.2.1牛 Yazwinski 等报道牛使用MXD0.5%浇泼剂和0.1%的注射剂(0.2mg/kg)后,对辐射食道口线虫(O.radiatum)和毛首线虫(Trichurris discolor)等线虫幼虫的驱杀率达98%,对古柏线虫(Cooperia.spp )和乳突类圆线虫(S.papillsus)幼虫驱杀率也达9l%[16]。MXD的药效试验亦表明,该药对牛的胃肠道线虫和肺线虫的幼虫和成虫的驱虫率在99%以上,持效时间一般在5~6周[17]。Vercruyss 等报道MXD浇泼剂对成虫的驱虫持效期为6周,注射剂为5周,浇泼剂的杀虫效力高于注射剂[18]。 4.2.2 绵羊 Papadopoulos 等对绵羊使用1%注射剂和口服0.2mg/kg治疗小型肺线虫,用药14天后粪便幼虫分别减少98.7%和89.8%,用药60天后均达到100%[19]。O’Brien等报道,用推荐剂量的MXD治疗感染耐IVM的捻转血矛线虫的绵羊,其第三期(L3)幼虫的虫体数量明显低于IVM对照组[20];S.Ranjan[21]比较了MXD和IVM的ED50、ED90、ED95,得出以下结论:耐IVM的捻转血矛线虫和辐射食道口线虫对MXD均较敏感;一次口服0.2mg/kg的MXD对羔羊的普通毛圆线虫(T.circumcincta)有效期至少3周,并能抑制其虫卵的发育。感染恶丝虫的绵羊口服0.2%MXD后,其疗效达100%。 4.2.3 马 MXD对马的许多消化道线虫有优良的驱杀效果。给马口服200ug/kg的MXD后,对消化道线虫的驱杀效果达到98%以上 [24]。Yazwinski也报道给小马驹服用200ug/kg的MXD胶囊后,对杯口线虫(Cyathostomes)成虫、幼虫有很高的驱杀作用,甚至可明显减少其排出虫卵数量[26]。 同时,也有报道指出MXD对马副线虫的幼虫有较优良的驱杀效果,且优于IVM[25]。 4.2.4 猪 Stewart等报道MXD0.5%浇泼剂对猪的多种线虫驱虫率达98.9%以上,只有对猪毛尾线虫的驱除效果变化较大[22]。 MXD对猪体内消化道线虫、肺线虫都有良好的驱杀效果。将0.5%的MXD浇泼剂以0.75 mg/kg量用于猪,14d后对猪蛔虫、猪毛首线虫(Trichuris.su is)、后圆线虫(MetasTrongylus .spp)、有齿食道口线虫(Oesphaostonumdectalum )等虫体驱杀效果达98%[23]。 4.2.5 犬 MXD对犬消化道线虫也有良好的驱杀效果。由于一些品种犬对IVM较敏感,安全剂量范围小,使得安全范围较大的MXD颇受欢迎。单剂量MXD巨释丸给犬服用(0.17 mg/kg体重)后,对犬恶丝虫的第三期幼虫有良好的驱杀效果,保护期达l80d。对曾感染犬恶丝虫的犬,使用MXD注射微球定期预防给药,能提供长达一年的保护期。每月给犬口服MXD(3mg/kg体重)5次,能较好地控制犬匐行恶丝虫(D.repens)的感染。此外,MXD对驯鹿、沙鼠、驴和狮子等消化道线虫也有很强的驱杀效果(Lespine A 2006 )[27]。 6 耐药性耐药性是临床治疗上一种广泛存在的现象,它的发展速度是由选择压力和蠕虫给下一代传递耐药基因的能力决定的。影响耐药性的因素很多,如管理策略、气候、耐药基因的传递等[10]。对阿维菌素类药物,毛圆线虫的耐药性最为普遍,美贝霉素族药物耐药性的产生可能与虫体对药物摄取量的减少、代谢增强、GABA门控Cl-通道受体发生改变等因素有关。线虫对MXD和IVM耐药性的产生还与谷氨酸门控Cl-通道的改变有关。此外,介导多药耐药性(MDR)产生的PGP(P-糖蛋白)不仅存在于动物肠道、胆道等粘膜细胞上,而且存在于线虫体内,PGP的高度表达可能是线虫对MXD产生耐药性的又一重要原因。频繁用药和亚剂量用药可能是耐药性产生的直接原因[4]。随着大环内酯类驱虫抗生素在兽医临床上的广泛应用,虫体耐药性也相继出现,且存在交叉耐药性。研究人员用梯度稀释MXD后发现[28],驱除耐IVM的蠕虫所需的MXD的量,比对IVM敏感的蠕虫所需的量大。有人试验用MXD筛选了14代捻转血矛线虫后发现,其对MXD和IVM的敏感性均降低,MXD和IVM的剂量分别为0.1 mg/kg和0.4 mg/kg时,对该虫仅有95%的效果,而对未筛选的虫株需要量分别为0.025mg/kg和0.1 mg/kg[29]。可见对IVM产生抗药性的捻转血矛线虫也对MXD产生抗性,但用MXD的疗效仍比IVM高,可能是因为虫体对MXD产生耐药性比对IVM来得慢或其他有待探明的原因。如果说MXD是广谱的驱体内外寄生虫药,前提必须是使用剂量水平。但若对于特定的某种寄生虫,MXD或许是一种更为有效的杀虫药。Conder等证明[30],抗IVM的虫体不可避免地对MXD也同样具有耐药性。MXD对沙鼠(0.00125mg/kg)耐IVM株H.contortus的驱虫效果仅有47.5% ,但相同剂量的MXD对敏感虫株的驱杀率仍高达98% ,再次证明IVM与MXD存在交叉耐药性[31]。 7 安全性药物的安全是药物使用中必须保证的两个方面之一。作为新一代阿维菌素类药物,MXD比IVM的安全性更高,在正常剂量范围内,MXD一般不会发生中毒反应。对IVM敏感的犬、小马驹用了与IVM相同剂量的MXD后无明显异常反应。Papadopoulos等也报道,给柯利牧羊犬分别服用厂家规定剂量的l0倍、20倍、30倍的IVM 和MXD后,IVM表现出了明显的毒性反应,而MXD 反应不明显[32]。但也有MXD注射剂的安全性不稳定的报道,有人比较了MXD的注射剂皮下注射和口服对狗的驱虫试验[27],在感染蠕形螨的22只狗中,注射组有14% 因有副作用而停药,3只发生死亡,有72%完成治疗并治愈;在感染疥螨的狗中,注射给药有17%产生了副作用,而口服给药的狗均未显示毒性,口服给药的安全性高于注射用药。 8 结语 MXD的脂溶性和水溶性均高与IVM,且成分单一,这是MXD的临床效果优于IVM的原因之一,MXD出现和应用也都比IVM晚,耐药性虫株出现尚少。MXD对吸虫和绦虫无效,是因为它们体内缺少GABA传导介质;另外,在该类虫体内还缺少谷氨酸门控制的Cl-通道,这也是该类药物对绦虫和吸虫无效的又一重要原因。哺乳动物外周神经传导介质为乙酰胆碱,以GABA作传导介质的神经仅存在于中枢神经系统,但哺乳动物有血脑屏障,因而药物进入中枢神经系统很少。到目前为止,还未发现在哺乳动物体内含谷氨酸门控Cl-通道,故该类药物对哺乳动物有很高的安全性。有实验表明,MXD注射剂对犬的安全性不稳定,可能是因为注射用药后血药浓度明显高于其他给药方式,另外,犬对该类药物的安全范围小也是很重要原因。由于MXD的高脂溶性,使药物在脂肪中的含量很高,停留时间也长,同时乳汁是MXD很重要的排泄途径,所以在肉类、奶类制品的生产中,要注意该药物的药物残留,合理制定该药物的休药期。随着MXD、IVM等广谱、高效、安全的驱虫药被广泛用于兽医临床,虫体对MXD的抗药性也逐渐显现出来,表现为MXD等大环内酯类抗生素对某些寄生虫低效甚至无效:但由于虫体对MXD的耐药性的产生比IVM慢,所以只要合理用药,降低MXD耐药性产生的可能性更大。作为新一代驱虫药物,MXD能够高效地杀灭线虫和体表寄生虫,同时,对动物有很好的安全性。它在用药剂量、剂型开发、耐药性和体内药物分布等方面优于IVM,因而是一种值得推广的抗寄生虫药。参考文献: [1] Burg RW, MiIler BM, Baker EE. et a1. Avermctims, a new family of potent anthelmintic agents:producing organism and fermertation[J]. Antimicrobial Agents and Cthemotherapy, 1979,15:36l-367. [2] Mckellar QA, Benchaoui HA. Avermectins and milbemycins[J]. J Vet Pharmacol Therap, 1996,19:331-351. [3] Lifchitz A, virkel G. Loperanfide induced enhancement of moxidectin availa- bility in cattle [J]. Journal of Veterinary Phamlacology and Therapeutics, 2002,25:111-120. [4] Mckellar QA, Benchaoni HA. Avennectins and milbemycins[J]. Journal of Veterinary harm acology and Therapeutics,1996,19:311-351. [5] Allan J, Paul DVM. Safety of moxidectin in avermectins-Sensitive collies[J]. Vet Rec,2000, 61:483 [6] HU Hong-Bo, ZHU Bei-Lei, LI Jun-Suo.Progress in Research of Avemlectins[J]. Acta Vete rinaria et Zootechnica Sinica,2002, 3l:520-529. [7] Lifschitg A, Virkel G, Imperiale F. et a1. Moxidectin in cattie:correlation between plasma and target tissues disposition[J]. J Vet Pharmacol Therap,1999,22:266-273. [8] Jalees A, Stecen J, Stout A. et a1. Moxidextin:Absorpti0n Tissue Distribution Excretion and Blotransformation of 11C-labeled Moxidectin in Sheep[J]. J Agric Food Chem,1994,42: l767-l773. [9] Zulalian J, Stecen JS, Adrian R. et a1. Absorption tissue distribution. metabolism and excreti on of moxidectin in cattle[J]. J Agric Food Chem,1994,42:381-387. [10] Shoop WL. Ivermectin resistance [J]. Parasitology today,1993,9:154-159. [11] Paul AJ, Tranquilli WJ, Todd KS. et a1. Evaluation of the safety of moxidectin in collies [C]. Proc of the Heartworm Symposium,1992, PP:189-191. [12] Lanusse C, Lifschitz A, Virkel G. et a1. Comparative plasma disposition kinetics of ivermecti n, moxidectin and doramectin in cattle[J]. J Vet Pharmacol Therap, 1997, 20:91-99. [13] Parker LD, O’Brien DJ, Bates PG. The use of moxidectin for the prevention and treatment of psoroptic mange(scab)in sheep[J].Veterinary Parasitology,1999,83:301-308. [14] Oukessou M, Berrag B, Alvinerie MA. comparative kinetic study of ivermectin and moxidect in in lactating camels (Camehts dromedaries)[J]. Vet. Parasoto1, 1999, 83: 151-l59. [15] Oosthuizen WTJ, Erasmus JB. Efficacy of moxidectin against a strain of Haemonchuscontor tus resistant to ivermectin,abenzimidazole and salicylanilide [J]. J S Afr Vet Assoc,1993, 64:9-l2. [16] Yazwinski TA, Tucker C, Copeland S. et a1. Dose confirmation of moxidectin pour-on again st natural nematode infections in lactating dairy cows [J]. Veterinary Parasitology,1999, 86: 223-228. [17] DiPietro JA, Hutchens DE, Lock TF. et a1. Effect of moxidectin oral gel on post treatment stronle egg count suppression in cattle.Preceedings of the American Association of Veteri nary Parasitologists 41 Annual meeting,1996, 32. [18] Vercruysse J, Claerebont E, Dorny P. et a1. Persistence of the efficacy of pour-on and injectble moxidecin against Ostertagiaostertagi and Dictvtocaulus viviparous in experiment ally infected cattle[J].Vet Rec,1997, I40:64-66. [19] Papadopoulos E, Sotiraki S, Himonas C. et al. Treatment of small lungworm infestation in sheep by using moxidectin[J].Veterinary Parasitology, 2004, 26: 329-336 [20] O’Brien DJ, Parker LD,Menton C. et a1.Treatment and control of psoroptic mange(sheepsca b) with moxidectin[J].Vet Rec,l996,139:437-439. [21] Ranjan S, Delay R. Therapeutic and persistent efficacy of moxidectin 1% nonaqueous injectable formulation against natural and experimentally induced lung and gastrointestinal nematodes in cattle[J]. Veterinary Parasitology, 2004, 120: 305-317. [22] Stewart TB,Wiles SE,Miller JE,et a1.Efficacy of moxidectin 0.5% pour-on against swine nenmtodes[J].Veterinary Parasitology,1999,87:39-44. [23] WesIev LS, Mrozok H, Michael HF. Struclure and activity of avermectins and milbemycins in animal health[J].Veterinary Parasitology,1995,59:l39-156. [24] Craig R, Reinemeyer DVM, Bill C. et al. Comparative efficiency of moxidectin gel or ivermectin paste for cyathostome control in young horses[J]. Journal of Equine Veterinary Science, 2002, 22: 33-36. [25] Costa AH,Barbosa OF,Moraes FR.et a1.Comparative efficacy evaluation of moxidectin gel and ivermectin paste against internal parasites of equines in Brazil[J].Veterinary Parasitolo gy,1998,80:29-36. [26] Yazwinski TA, Williams JC, Smith LL. et al. Dose determination of the persistent activity of moxidectin long-acting injectable formulations against various nematode species in cattle[J]. Veterinary Parasitology,2006, 137: 273-285. [27] Lespine A, Chanoit G, Melou AB. et al. Contribution of lymphatic transport to the systemic exposure of orally administered moxidectin in conscious lymph ductcannulated dogs[J]. European Journal of Pharmaceutical Sciences, 2006, 27: 37-43. [28] Craigm TM,Hatfield TA,Pankavichm JA,et a1.Efficacy of moxidectin against an ivermectin resistant strain of Haemonhucontortus in sheep[J].Veterinary Parasitology,1992,4l:329-333 [29] Molento MB, Wang GT, Prichard RK. Decreased ibermectin and moxidectin sensitivity in Haemonchuscontortus selected with moxidectin over 14 generations [J].Veterinary Parasi tology,1999, 86:77-81. [30] Conder GA,Thompson DP,Johnson SS. Demonstration of coresistanc of Haemonchscontortus to ivermectin and moxidectin[J].Vet Rec,1993,l32:651-652. [31] Sangster NC. Pharmacology of anthelmintic resistance in cyathostomes:will it occur with the avermectin/milbemycins?[J].Veterinary Parasitology,1999,85:189-204. [32] Papadopoulos E, Mavrogianni VS, Ptochos S. et al. Evaluation of the efficacy of moxidectin in a herd of goats after long-standing consistent use[J]. Small Ruminant Research, 2005, 57: 271-275. Progress in moxidectin——a broad-spectrum anti-parasite antibiotic WANG Shuai1,YANG Guang-you1*,WANG Chen-dong2,YANG Zhi2 (1. College of Veterinary Medicine,Sichuan Agricultural University,Ya’an 625014,China) (2. Chengdu Research Base of Giant Panda Breeding, Chengdu, 610081, China) Abstract: moxidectin is a safe, broad-spectrum and high-performance anti-parasite antibiotic for animals. This paper deals with physico-chemical property; mechanism of action; pharmacodynamics; clinical application and safe of moxidectin. Especially for ecto-parasites and nematodes, It has high efficacy in low dose. Key words: moxidectin; anti-parasite; efficacy