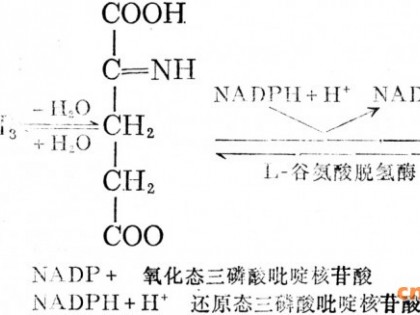
杨宁1 王健 2徐庆阳 1陈宁 1 温廷益13** (1天津科技大学生物工程学院 300222 2吉林大学生物与农业工程学院 130022)(3中国科学院微生物研究所100080)
摘要利用途径分析方法对黄色短杆菌(Brevibacteriumflavum)TC-21生产L异亮氨酸的途径进行了分析,确定了黄色短杆菌TC-21生产L一异亮氨酸的最佳途径的通量分布,根据途径分析的结果,发酵过程中的代谢流量对L一异亮氨酸产量有明显影响,而代谢流量与发酵过程中的溶氧密切相关,因此可以通过控制溶氧来提高L.异亮氨酸产量。在发酵过程的不同阶段,根据茵体生长和产酸的需求,改变合成途径的代谢流量,可以有效提高产酸率。实验证明,通过溶氧分阶段控制
发酵生产L一异亮氨酸,比溶氧恒定控制方式发酵产率提高了15.77% 。实验结果说明,用途径分析的结果指导发酵过程中的溶氧可以大幅度提高L一异亮氨酸的产量。
关键词L一异亮氨酸途径分析溶氧控制 黄色短杆茵
中图分类号Q815
L一异亮氨酸(L—isoleucine,L—Ile)是人体8种必需氨基酸之一,同时又是3种分支链氨基酸之一,在人类生命代谢中占有特别重要的地位?6?8 。作为典型的代谢控制发酵,ILe的发酵控制尤为重要。多年来,人们发现溶氧条件的改变对于L一异亮氨酸的产量影响非常大。
1998年,刘勇等【2]用分阶段控制溶氧的办法使L一异亮氨酸的产量达到13.9g/L,比恒定供氧发酵提高了6.9%。2001年,张伟国等 J通过改变发酵过程中的
kLa(体积氧气传递系数),使L一异亮氨酸产量达到23.5g/L。随着代谢工程的兴起,学者们逐渐认识到溶氧控制实际上是控制微生物的代谢途径,使微生物按
照理想载流途径进行代谢活动,从而最大限度地得到目的产物 J。途径分析(Pathway analysis)是代谢工程中用以指导遗传操作的理论基础,是代谢网络分析的
基本方法。基于计量学模型和可逆性或非可逆性反应的知识,通过计算机程序计算就能得到最优途径的通量分布,然后就可以按照最优途径进行微生物遗传改造和发酵条件优化【 2003年,王健等【¨]对色氨酸发酵进行了途径分析,并通过控制溶氧来指导发酵,使色氨酸产量达到9.03g/L。现阶段国内外对L.异亮氨酸途径分析的研究还比较欠缺,因而本文以途径分析理论为指导,确定了黄色短杆菌由葡萄糖生产L一异亮氨酸的最佳途径。根据途径分析的结果利用改变溶氧的方法来改变细胞内部的代谢流分布,使其在特定环境下生成更多的L一异亮
氨酸。
1 材料和方法
1.1 供试菌株
黄色短杆菌Brevibacterium/hvum TC-21(Met一+Eth +d—AB +AEC ),天津科技大学代谢控制发酵研究室保藏菌种。
1.2 培养基(g/L)
斜面培养基:葡萄糖1,酵母膏5,蛋白胨10,氯化钠2.5,琼脂20,pH 7.0-7.2。
种子培养基:葡萄糖30,KH2PO4 1.5,MgSO4 0.4,FeS040.01,MnSO,,0.01,(NH4)2S04 3,尿素2,豆饼水解液20ml/L,生物素0.5mg/L,VBl 2.5mg/L,pH7.0~7.2。
发酵培养基:葡萄糖70,(NH4)2S04 15,FeSO4
0.015,MgSO40.5,~tfltlSO4 0.015,KH2PO4 1.5,K2HPO43,生物素140t~g/L,VB1 0.1mg/L,Met 0.02,豆饼水解液20ml/L,玉米浆25ml/L,pH 7.0—7.2。
1.3 培养方法.
种子培养:接一环生长良好的斜面种子至装有25 rII1种子培养基的500nd摇瓶中,置于旋转式摇床上(200r/min),31oC振荡培养38h。
发酵:按15% 接种量将种子液接入5L自动控制发酵罐中,装液量3L,通风量1—3L/min,根据溶氧控制搅拌转速,培养温度31℃ ,通过自动流加浓氨水溶液控制pH7.0,发酵88h。
1.4 分析方法
1.4.1 发酵液中残糖测定采用SBA-40系列生物传感分析仪测定。
1.4.2 OD值的测定将发酵液稀释一定倍数后,在波长620nm处用分光光度计测定。
1.4.3 发酵液中氨基酸含量测定采用Elite-AAA型
氨基酸分析仪测定。
2 结果和讨论
2.1 L-异亮氨酸生物合成途径分析
根据L.异亮氨酸代谢网络以及各步反应的化学计量平衡式,可由计算机计算出该代谢可分为9个模型。
产率最高的基本模型代表了最优途径。
通过途径分析可知,葡萄糖进入L.异亮氨酸生成途径有两种方式,一是PEP--*P, AC.C0A—OAA,另一种是CO2的回补反应,即PEP直接生成OAA。若通过
TCA循环生成OAA,则会生成CO2造成碳源损失。在模型1和模型2中,由Imol葡萄糖生成1molL.异亮氨酸,产率高达100% ,见图1。其原因就是PEP或PYR直接生成OAA,且葡萄糖由EMP途径进入代谢网络而不通过HMP途径进入代谢网络,从而避免了碳源的浪费。经途径分析后,一个特殊的代谢路径的所有酶被过量表达时,编码不必要的酶的基因被敲除,就会构建出一个高产的路径。为了避免通过TCA循环和乙醛酸支路生成OAA而造成碳源的浪费,可以通过过量表达PEP羧化酶的基因直接使PEP生成OAA或过量表达丙酮酸激酶的基因和丙酮酸羧化酶的基因通过Pyr生成OAA。为了避免因生成CO2而造成浪费,应该对6.磷酸葡萄糖脱氢酶进行截堵。按照途径分析结果,HMP途径、TCA循环和乙醛酸支路应该减弱,从而使碳架流转向异亮氨酸的合成,因为TCA循环中的酮戊二酸脱氢酶和柠檬酸合成酶催化的反应是不可逆的,能量和许多中间代谢物需要TCA循环来提供,所以该循环中的酶不能被完全去除。现阶段国内外各种研究表明【 , , ,溶氧对代谢过程有显著影响,故本文采用控制溶氧的方法来改变L一异亮氨酸代谢,进而提高L-异亮氨酸产率。虽然溶氧影响L-异亮氨酸合成代谢的机理尚未完全清楚,但国内外已有多人对溶氧与代谢过程的关系进行了研究。Zhang等[12]给出了谷氨酸发酵过程中溶氧与代谢流量的量化关系,研究表明,在其它条件相同情况下,高溶氧条件下TCA循环代谢流量大于低溶氧,但谷氨酸代谢流却明显降低,在发酵中后期控制较低溶氧,谷氨酸合成代谢流较大。Xiao等u3J研究了不同溶氧对谷氨酸发酵中两个关键酶(谷氨酸脱氢酶GDH和乳酸脱氢酶LDH)和代谢流的影响,研究表明,在过低溶氧条件下,TCA循环代谢流量减小,不足以平衡葡萄糖酵解速率,从而刺激了LDH的酶活,使代谢流转向乳酸生成,造成乳酸积累;而过高溶氧,GDH酶活明显降低,且TCA循环流量加大,生成大量CO2,造成碳源损失,两种情况均不利于谷氨酸生成。刘勇等 J的研究表明,在L.异亮氨酸发酵中,转速不同对各种氨基酸产量有明显影响,低转速时产生杂酸较多。宋文军等u4J给出了L.异亮氨酸发酵中后期不同转速下的代谢流分布,研究表明,转速过低,TCA循环代谢流量减小,但副产氨基酸流量增加,差不多每一种副产氨基酸的代谢流均要比高转速时要大,尤其是副产缬氨酸明显过多。随着转速增加,TCA循环代谢流量增加,各副产氨基酸流量减小,这说明供氧充足有利于抑制杂酸。但是供氧过高又会造成TCA途径流量过大,导致L-异亮氨酸的代谢流减小,这说明控制合适的溶氧对L-异亮氨酸发酵至关重要。若能在发酵过程中恰当控制溶氧,就可以改变代谢流量,从而增大L_异亮氨酸产率,减少杂酸生成。基于最优途径分析和溶氧对代谢过程的影响,本文提出了利用控制溶氧来提高L.异亮氨酸产量的方法。
2.2 L-异亮氨酸溶氧控制
2.2.1 不同转速对溶氧的影响在发酵培养基组成和其它发酵条件相同的情况下,考察了不同转速值对应发酵过程相对溶氧(DO)变化的情况(DO以饱和Na2SO3溶液中溶氧浓度为0,以蒸馏水中最大溶氧浓度0.21×10I3kmol/m 为100%计算),。,在控制不同转速的发酵过程中,相对溶氧(DO)均表现出相似的变化规律,但发的不同阶段对氧的需求不同。在发酵初期(0~32h),菌体耗氧速率明显快于供氧速率,表现为相对溶氧的迅速下降;而32h后,好氧速率和供氧速率基本保持平衡。发酵末期(60h后),相对溶氧回升,发酵结束相对溶氧达40% 以上。
2.2.2 不同转速对L-异亮氨酸生产茵生长和产酸的影响在其它发酵条件相同的情况下,控制不同转速进行5L罐的分批发酵,得到发酵过程不同时刻生长速率与产酸速率随时间的变化曲线。
利用MATLAB软件,对发酵过程数据(细胞干重及异亮氨酸产量)进行差值计算,再利用Excel软件,求解得到发酵过程不同时刻的比生长速率u和比产酸速率qp,发酵过程中 与qp随时间的变化曲线。可以发现,在不同的转速下菌体的生长速度不同。在20h以前,转速为500r/m/n菌体的比生长速率最大;20h一60h,当转速为600r/min时,菌体的比生长速度最大;60h以后,转速为400r/min最好。由不同转速条件下产物形成的比速率随时间的变化关系可以看出,不同转速下,最大产物形成比速率出现时间很接近,在发酵前期(O~20h),转速为400r/min时,产酸比速率最大;发酵中期(20~40h),转速为600r/h时,比产酸速率最大;发酵中后期,转速为500r/min时,菌体的比产酸速率最大。对于产物形成的最适转速值和对于菌体生长的最适转速值是不同的,因此对于转速恒定的操作,不能同时使菌体生长和产物形成处于最适的环境中。从异亮氨酸发酵的实际效果来看,发酵前期转速控制在500r/min,DO 20% 以、上,以保证菌体大量生长;中期转速在600r/min,DO 25%以上,有利于产酸和菌体生长;发酵中后期,维持转速在500r/min,DO 20%左右;发酵末期,维持转速~E400r/min,DO不超过45%,对异亮氨酸的生成比较有利。
3 结论
利用途径分析的方法,可以得到生产L-异亮氨酸的最佳代谢途径,根据理想载流途径,葡萄糖由PEP直接生成OAA,避免了TCA循环对碳源的损失,故最大产率可达100%。研究表明,L-异亮氨酸的代谢流量与溶氧浓度有密切关系,可以通过控制不同时期的溶氧来改变发酵过程中的代谢流分布,从而改变He等氨基酸合成的代谢流量。实验证明,在发酵前期,为了保证菌体大量生长,选用转速500r/min较好;在发酵中期,转速提高至600r/min,对于菌体生长和产酸都比较有利;发酵后期,则降低转速至500r/rain以下,有利于产酸。在途径分析和溶氧控制理论基础上,本文提出了分阶段控制供氧的发酵方式。通过溶氧控制来改变发酵过程中的流分布,可以有效提高L.异亮氨酸的产量。实验证明,利用分阶段供氧的方法发酵产酸提高了15.77%,由此说明,利用途径分析的结果可以有效指导L.异亮氨酸发酵过程控制和优化。
参考文献
[1]Guillouet S,Rodal A,An GH,et a1.Metabolic redirection ofP~'bon flow toward isoleucine by expressing a catabolic threonine dehydratase in a threonine—overproducing
Corynebacterium #utamieum. Appfied Microbiology and Biotochnology,2001,57(5):667—673
[2]刘勇,陈雅丽,张长铠,等.L一异亮氨酸发酵对氧需求的研究.生物技术,1998,8(1):26—28Liu Y,Chen Y L,Zhang CH K,et a1.Biotochnology,1998,8
(1):26—28
[3]张伟国,陈坚,伦世仪.供氧对 异亮氨酸分批发酵的影响.无锡轻工大学学报,2001,20(5):96—97,100
W G,Chen J,Lun SH Y.Journal of Wuxl University ofLight Industry,2001,20(5):96-97,100
[4]Christensen B,Nielsen J.Metabolic Network Analysis:A powerful tool in metabolic engineering.Advances in Biochemical,2000,66:209—231
[5]王健,王志诚,田梁逦霞,等. 异亮氨酸产生菌的代谢途径分析.生物技术通讯,2006,17(4):593—596
Wang J,Wang ZH C,Tian L L X,et a1. Letters inBiotochnology,2006,17(4):593—596
[6]Schilling C H,Letscher D,Palsson B O.Theory for the systemic definition of metabolic pathways and their use in interpreting metabolic function from a pathway-oriented perspective.Journalof Theoretical Biology,2OOO,203(2):229~248
[7]Schilling C H,Palsson B O.Assessment of the metabolic capabilities of Haemoph//us如 n Rd through a genome—scale pathway analysis.Journal of Theoretical Biology,2000,203(3):249—283
[8]Schuster R,Schuster S.Refined algorithm and computer@rogram for calculating all non—negative fluxes admi ssible in steady states of biochemi cal reaction systems with or without some flux rates fixed.Computer Applications in the Bioseienees,1993,9(1):79— 85
[9]Schuster S,Klamt S,Wockwerth W,et a1.Use of network an alysis of metabolic systems in bioengineering.Bioprocess and Biesystems Engineering,2000,23(6):363—372
[10]Devile Y,Gilbert D,van Helden J,et a1.An overview of data models for the an alysis of biochemical pathways.Lecture Notes in Computer Science,2003,26(2):174
[11]王健,张蓓,张克旭,等.色氨酸产生菌TQ2223的途径分析. 无锡轻工业大学学报。2003,22(5):l5一l8 Wang J,Zhang B,Zhang K X,et a1.Journal ofWuxi University of Light Industry,2003,22(5):15一l8
[12]Zhang CH Y,Shi ZH P,Gao P,et a1.On—line prediction of products concentrations in #utam~te fermentation using metabolic network model an d linear p~snunmins.Bioc hemical Engineering Journal,2005,25(2)::99—108
[13]Xiao J,ShiZH P,GaoP,eta1.On—line optimization ofglutamate production based on balanced metabolic control by ao.Bioprocess and Biesystems Engineering,2006,29:109一ll7
[14]宋文军,张克旭,张坤生,等.不同供氧条件对L一异亮氨酸合成代谢流的影响.中国食品学报,2003,3(1):l一6
SongW J,Zhang K X,Zhang K S,et a1.Journal of Chinese Institute of Food Science and Technology,2003,3(1):l一6