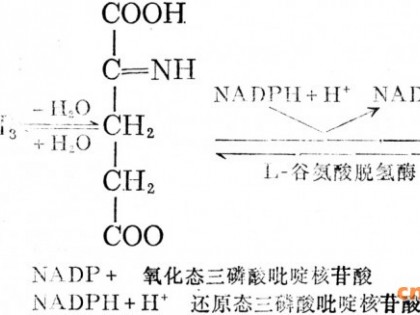
色氨酸的理化性质
色氨酸又名氨基吲哚丙酸,为白色或微黄色的叶片状结晶或粉末,无臭或微臭。有L- 型(左旋)、D - 型(右旋)和D L- 型(消旋)三种旋光异构体,其中L-型稍有苦味、D L- 型和D - 型味稍甜,能被人类和动物吸收利用的只有L-型。在水中微溶,溶解度为1.14g (25℃),可溶于热吡啶、稀酸或稀碱,微溶于乙醇;若长时间光照则着色,迅速加热至210℃时发黄,289℃分解;与水共热时可产生少量吲哚,如与氢氧化钠、硫酸铜共存时加热,可产生大量吲哚;与酸在暗处加热较稳定,与其他氨基酸、糖类、醛类共存时极易分解。
L-色氨酸的应用及市场前景
L- 色氨酸对人和动物的生长发育、新陈代谢起重要的作用,为第二必需氨基酸。因其只能由微生物或植物合成,人和动物易缺乏且只能从食物中摄取,因此潜在需求量很大,目前被广泛应用于医药、食品及饲料等领域,其主要用途:用于氨基酸输液,综合氨基酸制剂;用于孕妇营养补剂和婴幼儿特殊奶粉等。
近年来,随着各行业对L- 色氨酸的广泛应用,使得L- 色氨酸的市场需求量进一步增加。由于产量太低,仅有少数厂家能够少量生产,且生产成本较高。我国每年需大量进口,过高的价格严重制约了它的广泛应用。因此,提高L-色氨酸工业化生产的产量、降低生产成本,是消除国外企业垄断、提高我国产品竞争力的唯一办法。
微生物发酵法生产
L-色氨酸的研究进展
早期主要采用化学合成法及蛋白质水解法生产L- 色氨酸,但因原料获取困难、生产周期长、污染严重、工艺复杂等缺点,在工业上生产应用并不广泛,已逐渐被淘汰。随着对微生物法生产各类氨基酸的研究不断深入,微生物法已占主流,此法又可分为直接发酵法、酶法和微生物转化法三大类。其中,酶法和微生物转化法虽已实现了工业化,但仍存在原料昂贵、转化率低等问题,未得到大规模、低成本的推广。
以葡萄糖、甘蔗糖蜜等廉价物质为原料的直接发酵法具有产酸高、成本低和质量好的优势,且所产色氨酸都是为生物所能利用的L- 型,因而是大规模生产L-色氨酸的首选技术。
微生物发酵法的发展进步以优良菌种的选育为重点,其关键在于改进育种技术。近年来,随着重组DNA 技术在微生物育种中的应用,特别是代谢工程育种方式的兴起,为优良的L- 色氨酸生产菌株的筛选和产酸水平的提高提供了可靠的技术保障,生产效率大幅提高,使微生物直接发酵法生产L-色氨酸已经成为—种低成本的工业化生产方法。
L-色氨酸高产菌株的选育 直接发酵法利用微生物的某些营养缺陷型菌株,通过代谢控制发酵,人为地改变和控制微生物的代谢途径来实现L-色氨酸的生产。此法的核心问题在于选育优良的菌株,其优点是原料来源十分广泛易得、价格便宜,是最早开发的色氨酸生产方法,但在相当长的一段时间内达不到工业化生产的要求。主要原因是早期的研究仅依靠单一的化学或物理诱变手段选育色氨酸生产菌株,但是色氨酸的生物合成途径调控机制极为复杂,仅通过诱变方式无法根除所有的代谢调控作用,因而无法获得优良的菌株用于生产L-色氨酸。
随着多种基因操作技术的发展,在分析微生物代谢途径的基础上,对基因水平上的代谢流进行合理调控,成为微生物法生产色氨酸研究的热门方向。
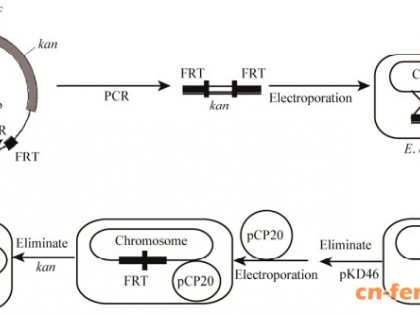
利用基因工程方法进行选育是通过分子水平上最小限度的、最明确的基因突变来优化菌株。研究重点为构建高产色氨酸基因工程菌,即运用代谢工程和基因工程手段,通过抗反馈抑制突变体构建和阻遏蛋白敲除等方法获得高产色氨酸基因工程菌。实践中多以大肠杆菌、黄色短杆菌和谷氨酸棒杆菌等作为选育色氨酸生产菌的出发菌株,通过基因操作定向改造生物合成途径来获得高产菌株。比较常用的是大肠杆菌和谷氨酸棒杆菌,大肠杆菌具有遗传背景清晰、易于改造、容易培养、发酵周期较短等优势,在微生物发酵中被广泛使用。谷氨酸棒杆菌是传统生产氨基酸的菌种,其安全性已经受了长期的生产实践证明。
高产菌株的选育原则为:选择关键酶不再受到反馈抑制的突变子,并破坏分解色氨酸的酶系。目前关于色氨酸的代谢工程研究大多集中在共同途径和色氨酸分支途径的改造上。研究者还发现,将携带有色氨酸操纵子的质粒导入细胞,也可以成倍提高色氨酸产量。
生产L-色氨酸发酵条件优化 基因工程菌的发酵生产水平不仅和菌株的遗传特性有关,也和发酵工艺控制(即重组菌的培养条件及过程控制)密切相关。我国对L-色氨酸生产技术的研究虽然开展得较晚,但近年来各地研究者充分发挥发酵大国的优势,不断努力地筛选高产菌株,积极探索将基因工程的技术成果转化为生产力的各种途径。
通过对培养基组成、接种量、溶氧量、补料方式、比生长速率和无机盐等发酵控制的关键因素进行优化,提高糖酸转化率和发酵液中色氨酸累积浓度,缩短发酵时间,进展迅速。
研究人员以大肠杆菌为出发菌株的研究成果显著,该项研究以大肠杆菌FB -04/pSV -04 为研究对象,通过一系列发酵优化:培养基的无机盐浓度为200% 、通过指数流加策略控制葡萄糖流加速率,将细菌在对数生长期的比生产速率控制在0.2h-1,发酵效果较好。在3L 罐上发酵53h,L-色氨酸的产量达53.4g/L,与国外报道的最高水平接近。在此基础上进行30L 发酵罐初步放大,发酵55h,L- 色氨酸的产量可达53.6 g/L,且发酵结果稳定,具有工业化应用前景。
以大肠杆菌TR JH 0709 为供试菌株,通过单因素和正交试验研究得出L-色氨酸合成的最佳发酵培养基为葡萄糖50 g/L、硫酸铵15 g/L、酵母粉1.5 g/L 和柠檬酸20 g/L,其中葡萄糖含量对试验效果影响最大。在此最优条件下,摇瓶产量可达19 g/L。在100L 发酵罐上,将残糖浓度、补料方式、柠檬酸钠添加质量分数、接种量及溶氧量分别控制在5g/L、溶氧控制脉冲补料、2 g/L、5% 及10% ~15% 时,发酵效果最好。在1吨发酵罐进行中试放大验证,L- 色氨酸产量稳定在40g/l左右,为目前国内中试放大的最好水平。尚未见国外有中试放大的研究成果报道。
研究人员通过对不同压力、培养温度、溶氧浓度、酵母抽提物和葡萄糖浓度的分析,优化了大肠杆菌(E.coliTR JH) 生产L- 色氨酸分批补料发酵工艺,选择在种子培养基中加入50ug/m l四环素,在发酵培养基中添加4g/L 酵母浸出物、控制温度在32℃、溶氧水平在20% ~40% 、葡萄糖浓度为5 g/L,能显著提高生产菌的质粒稳定性和L- 色氨酸产量。
展望
随着人们对色氨酸的认识及研究的不断深入,色氨酸的应用领域将越来越广泛,但其工业生产规模却远未跟上市场需求。研究者们致力于基因工程技术、定向进化技术、代谢工程技术及基因组学、代谢组学等微生物育种方法的发展和应用,将加速研究了解色氨酸的生物合成途径和代谢调节机制,微生物育种方法将更加先进及多样化。同时,随着发酵条件的不断优化,微生物直接发酵水平必将不断提高,生产成本进一步下降。世界色氨酸工业将进入迅猛发展阶段,市场前景十分乐观。