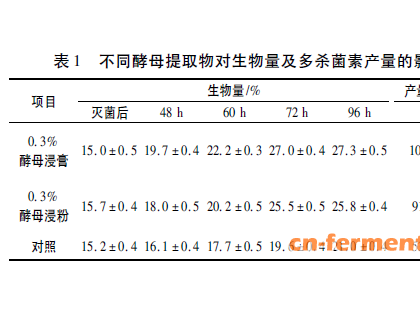
抗生素杂质控制的基本思路与策略实质上是对如下问题的研究与求证:产品中将出现何种杂质;相关杂质与其来源(生产工艺、贮藏、包材等)的相关性如何;生产、包装和储运中如何针对性地控制或去除这些杂质;相关杂质去除或控制措施的效果及其验证情况如何;杂质分析方法、杂质可接受性及其限度确定的依据如何等。
通常来说,杂质谱在很大程度上取决于制造过程,因此,抗生素杂质的控制更加依赖于科学合理的工艺设计和生产操作的过程控制,需要提供相应的生产要素与产品组分、杂质谱关联性的研究信息。一般情况下,对于多组分抗生素,如果已在国内外上市,其组分情况已经明确,那些没有被定义为活性成分的相关化合物应按杂质对待。对于新的发酵来源抗生素,应当基于临床前和临床研究获得的信息,来定义其中的某成分是属于活性成分(组分),还是应作为杂质进行控制。发酵产物的杂质谱分析至少应包括对副产物、组分、中间体和降解产物等的分析和论证。
对于半合成抗生素来讲,发酵后的合成路径越短,发酵起始原料越复杂,就越需要详细描述可能产生的组分情况、组分与生产要素的关联性研究以及针对性的精制和纯化过程的相关信息。并且,发酵起始原料需要制定适宜的内控标准,包括含量测定、组分分布(如果相关)、有关物质(特定杂质、非特定杂质及总杂质)。半合成抗生素杂质谱分析至少应包括发酵起始原料及其有关物质(组分等)、合成副产物(包括起始原料中杂质的合成副产物)、合成中间体和降解产物等。通过杂质谱的分析和检出情况,反馈各生产要素的优化,通过关键工艺参数及其范围的确定、关键中间体质量标准的确立等过程控制措施,来有效把控产品质量。对关键中间体应制定内控质量标准,包括明确的特定杂质、非特定杂质及总杂质的限度,并以试验数据论证说明限度制定的依据。
新型抗生素
抗生素杂质的控制,一般包括每个明确的已知杂质、每个明确的未知特定杂质、任何非特定杂质(不超过鉴定限度)以及总杂质。在试验表明现有技术的确无法鉴定某个杂质时,至少要提供此杂质结构的充分证据来表明它可归属为母体化合物或某侧链等有关物质,将其作为明确的未知杂质使用适当的分析标识手段进行识别和控制。
新抗生素杂质限度的确定需要根据其来源、类别、结构信息等因素,结合毒理学研究乃至临床研究中各批次试验样品的杂质组成情况综合考虑。欧盟药品管理局(EMA)《制订抗生素有关物质限度的指导原则》中的相关原则可供参考。
一般来说,与母体化合物结构并不密切的相关杂质,应符合我国《化学药物杂质研究技术指导原则》中的限度规定;如果杂质结构与主药化合物结构密切相关,若适当放宽其限度,需对放宽限度的合理性进行充分论证。按照EMA的指导原则,与母体化合物结构密切相关的有关物质的控制限度为0.50%,其他有关物质的控制限度为0.15%,两者同时适用;如果申请人声明有关物质(未包含在活性物质中的化合物)与母体化合物密切相关,须采用HPLC/MS或HPLC/DAD或使用分析标识物予以证实;杂质分析时只要可能,应使用外标法来计算重量比(w/w),以便评估和排除任何可能的质量不守恒。如果使用面积归一法,相关成分和有关物质应在检测器中产生相似反应,否则应使用响应因子进行校正;不同类型的抗生素杂质,可参考EMA指导原则进行研究与控制(见下表)。
EMA在制定抗生素杂质限度时,除了考虑到杂质情况复杂、难以充分纯化之外,同时也考虑了大部分情况下抗生素治疗时间有限,疗程较短,故杂质限度较一般全化学合成药物宽松一些。需要关注的是,全新抗生素的新结构杂质的限度确定应基于毒理学乃至临床研究提供的相关信息,不同种类抗生素限度也不尽相同。大多数情况下,改善纯化措施,降低杂质含量至控制限度以下,可能比提供安全性资料更好、更便捷。模拟商业化生产批次及推荐贮藏条件下放置的样品中,所有大于鉴定阈值的杂质均应予以鉴定;某个杂质无法鉴定时,应提交对该杂质进行的不成功试验的概述;如果已尝试鉴定过某些不大于
鉴定限的杂质,报告这些研究结果也是有价值的;通常没必要对不大于鉴定限的杂质进行鉴定,但可能产生不寻常功效或毒性药理作用的潜在杂质除外。
仿制抗生素
杂质谱的对比研究是仿制药研发的重要环节,也是桥接上市产品安全性的重要途径。对于抗生素来讲,杂质含量较高,类别较多,来源较为复杂,与原研产品进行杂质谱的对比研究比对每个杂质进行鉴别定性和安全性求证更为重要和便捷。杂质谱对比中,与原研产品相同的杂质,含量不超过质量标准(药典等)规定或原研产品检测结果时即认为可接受;相同杂质如超出标准规定,或出现原研产品中没有的新杂质,需按照上述思路与策略消除该杂质或降低其含量,必要时进行安全性求证,制定合理限度。
另外,对于仿制抗生素,杂质控制方面已有的权威文献信息也是杂质研究与控制的重要参考与依据。中国药典、国际人用药协调委员会(ICH)成员国药典控制的同品种特定杂质,须进行相同的研究与控制。对于那些因制备工艺不同而不可能存在于在研产品的杂质可不进行控制,但要提供针对性的研究或论证说明。
分析方法:对比研究中需关注该产品是否在ICH成员国药典中收载,收载的检测方法与申报方法有无明显差异,是否进行了方法比较研究。如果申报方法与ICH成员国药典方法之间存在较大差异,应进行包括检测能力和样品测定结果的方法对比研究,在此基础上优选专属性好,灵敏度高,能够充分检出相关杂质的检测方法。需要注意的是,在杂质一致性的研究求证中,分析手段不能等同于日常检测,色谱技术(如HPLC法)应与光谱技术(或二极管阵列检测)相结合,或使用分析标识物(如杂质对照品),以便从色谱行为、UV特征、分子量及分子碎片特征等信息共同把握其物质一致性,对样品与原研产品进行所有杂质种类、含量及分布的比较和分析,并参照杂质研究相关技术指导原则的思路说明本品杂质安全性得到有效控制。
对照药:对照药是仿制药研发的标杆与基础,在求得与上市产品一致时,对照药的选择至关重要。一般来讲,原研产品的上市过程经历了严格的安全性评估和规范的临床试验,其中的杂质及其限度要求也经过了安全性的验证和认可,仿制品中相同的杂质可以桥接其安全性要求,不同于原研产品的新增杂质则需要进一步求证其可接受性。因此,仿制药研发应从“原点”开始,即通过与原研产品进行全面的对比研究,求证其质量一致性。为全面提升抗生素仿制药的质量,有效规避安全性风险,选择品质优良的原研产品作对照十分必要,如下思路可供参考(见下图)。
需要说明的是,建立科学可行的分析方法、确定安全合理的杂质限度并不是抗生素杂质研究的终极目标。杂质的有效控制尚应在杂质谱分析的指导下,从杂质产生的源头,优化制定合理的生产控制措施和包装贮藏条件,从根本上优化控制杂质产生的因素,方可实现杂质的有效控制。例如,四环类抗生素降解的情况比较复杂,在酸性、中性、碱性环境中的降解途径和异构化情况不同,产生的杂质各异,有些杂质是引起临床Fanconi症候群现象的主要物质,必须作为特定杂质严格控制。杂质谱分析表明,替加环素在pH8.0附近较为稳定,在酸性条件下,4位二甲胺基易发生差向异构化。同时,因分子中酚羟基在解离状态下较非解离的分子状态更易氧化,在处方设计上需要通过两方面的措施提高其产品质量和稳定性:用盐酸调节pH值低于其酚羟基的pKa,使酚羟基处于非解离状态,以有效抑制其氧化降解;为进一步抑制替加环素在酸性条件下的差向异构化,筛选加入能够有效抑制其差向异构化的辅料。同时,在制剂过程和产品包装贮藏条件中,通过强化对氧、温度等因素的控制,降低其不稳定因素,质量标准中针对性控制此类特定杂质,采取多种措施,使产品杂质处于可控状态。