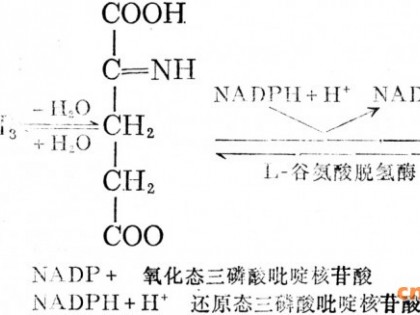
宋 乐1,2,夏爱坤1,徐 鲁1,李继安1,林惠敏1*
(1. 中国医药工业研究总院上海医药工业研究院,创新药物与制药工艺国家重点实验室,上海 201203;
以下为文章节选
L- 色氨酸( 1) 是人体必需氨基酸之一,对人和动物的生长发育、新陈代谢起着重要作用,广泛应用于医药、食品和饲料等领域[1]。1 的制备主要有酶法、生物合成法及微生物直接发酵法。近年来,随着基因工程技术的发展,采用大肠埃希菌(Escherichia coli) 高密度发酵大规模生产1 成为主要的生产方式。2002 年Dodge 等将质粒pBE7 转化至tnaA 和serA 基因失活的抗邻氨基苯甲酸的突变宿主菌中[2],不添加任何前体物,1 产量达到42 g/L。于传军等以大肠埃希菌W3110 为出发菌[3],采用tac 启动子突变体串联基因组上表达trpEfbrDCBA基因,同时失活或敲除大肠埃希菌W3110 中的tnaA、trpR 和tyrR 基因,突变tyrA 和pheA 基因,并向改造后的菌株中转入含有串联表达来源于大肠埃希菌K12,筛选出高产菌株,发酵35 h,1 产量45.5 g/L。
基因工程菌对发酵条件要求更高,发酵液中的溶氧浓度会影响大肠埃希菌的代谢途径,副产物乙酸的积累会抑制菌体的生长和发酵后期1 的产量[4—5]。不同的溶氧浓度影响菌体的生长速率,改变菌体的代谢途径,同时影响基因工程菌的质粒稳定性[6],进而对1 产量有较大影响。发酵罐上,搅拌和通气比决定了发酵液的溶氧水平,本研究主要从搅拌浆的搅拌转速和搅拌桨尺寸调整来考察溶氧对1 发酵的影响。
1 仪器与材料
1.1 仪器与试剂
2 方法与结果
2.1 分析方法
样品预处理:取发酵液5 ml,加水稀释至发酵液中1 浓度低于20 g/L,混匀后于60 ℃水浴加热30 min,使发酵液中析出的1 晶体完全溶解。取水浴后的发酵液1 ml 置10 ml 离心管中,加入甲醇8 ml,混匀后超声(250 W、40 kHz)15 min,精密取出1 ml 离心(13 000×g)5 min,取上清液进行HPLC 检测,将所测得1 浓度乘以相应稀释倍数即为发酵液单位。
发酵单位测定:HPLC 法[7]。色谱柱 C18 柱(4.6 mm×250 mm,5 µm) ;流动相 2.2 mmol/L 磷酸二氢钾水溶液∶甲醇(80 ∶ 20) ;流速 1.0 ml/min ;柱温 40 ℃ ;检测波长 278 nm ;进样量 2 µl。
乙酸的测定:HPLC 法[8]。色谱柱 Zorbax SB-C18柱(4.6 mm×250 mm,5 µm) ;流动相 36.7 mmol/L磷酸二氢钾水溶液( 用85%磷酸调至pH 2.7) ∶乙腈(96 ∶ 4) ;流速 0.8 ml/min ;柱温 45 ℃ ;检测波长 210 nm ;进样量 2.5 µl。
菌丝形态检查:美蓝染色法,光学显微镜观察。
游离氨基氮的检测:甲醛氧化测定法。
还原糖的检测:生物传感仪测定。
质粒丢失率的测定[9] :无菌条件下取不同发酵时间的发酵液l ml,用无菌水逐级稀释,分别取10-6、10-7 和10-8 3 个梯度的稀释液0.15 ml,涂布于非选择性固体培养基平板上,37 ℃倒置培养24 h ;随机挑取在非选择性培养基上生长的菌落200 ~ 300 个,分别点种在对应的选择性培养基和非选择性培养基平板上,37 ℃倒置培养24 h,观察2 种平板中菌体的生长情况,计算平板上生长的菌数比例。由于缺失质粒的菌在含有四环素的培养基上不能生长,因此,将选择性培养基中的菌落数与非选择性培养基中菌落数进行比较,即可计算出质粒的丢失率。
2.2 培养方法
斜面、种子和发酵培养:取甘油管菌悬液接种至装有斜面培养基60 ml 的250 ml 茄形瓶,35 ℃培养24 h 后,取1 支茄形瓶斜面,用0.9%无菌生理盐水20 ml 将菌苔洗下,将所制得的菌悬液转接至培养基装液量为15 L 的25 L 种子罐中,调整转速和风量,控制溶氧30%以上,36 ℃培养10 ~12 h。将培养好的种子液1.7 L 转接至培养基装液
量为10 L 的25 L 发酵罐中,调整搅拌桨参数,于35 ℃发酵培养38 h。
流加补料:采用蠕动泵自动定量流加技术,发酵开始后待发酵液中葡萄糖浓度低于0.05%后开始流加55.0%葡萄糖溶液,每小时流加葡萄糖溶液量与发酵液体积比见表1。蠕动泵流加28%氨水自动控制pH 6.8 ~ 7.1。

2.3 搅拌转速对发酵的影响
3 个25 L 发酵罐,基础培养基装量10 L,在发酵培养基组成及含量、接种量、发酵培养温度相同的情况下,保持发酵罐通气量一致,通过改变标准搅拌浆搅拌转速来控制发酵液的溶氧浓度,考察其对1 发酵的影响。在发酵开始以后每1 h 取样检测发酵液中的还原糖浓度,在发酵液中还原糖残留量低于0.05 g/100 ml 之前,调整搅拌转速使溶氧浓度大于50%。当发酵液残糖低于0.05 g/100 ml 时开始流加葡萄糖,控制发酵液还原糖残留量为0.01 ~0.05 g/100 ml,开始流加葡萄糖后将3 个发酵罐转速分别调至400、500 和600 r/min,考察搅拌转速在发酵过程中对溶氧浓度、菌体生长速率(D660)、乙酸生成量、质粒稳定性和1 产量的影响。

由图1 可知,在1 发酵前期,产生菌处于对数生长阶段,对溶氧需求大。发酵罐搅拌转速越高,溶氧值越大,菌体生长越快,1 的合成速度也越快;相反,搅拌转速越低,菌体对数生长期的溶氧值也越低,而过低的溶氧浓度则导致乙酸大量生成[10],使菌体生长受到抑制,比生长速率下降,菌体质粒大量丢失,到发酵后期菌体过早发生自溶,严重影响1 的合成。本组试验结果显示,通过将标准桨转速调到600 r/min,1 发酵效价提高至53.2 g/L。接下来本研究继续考察了搅拌桨大小对1 发酵的影响。
2.4 不同搅拌桨大小对发酵的影响
通过上述研究可见,在菌体浓度快速增长阶段,维持发酵液溶氧大于50%以上有利于菌体浓度的增加,从而促进1 的合成。本研究采用3 组不同大小的搅拌桨( 图2,具体规格参数见表2),通过分别调整搅拌转速使发酵过程溶氧浓度大于50%,考察不同尺寸的搅拌桨对1 发酵过程中溶氧浓度、菌体生长速率、乙酸生成量、质粒稳定性、1 产量和菌丝形态的影响。




由图3A 可见,搅拌桨越大,溶氧条件越好,在溶氧浓度相当的条件下,所需的搅拌转速越小。图3B 显示,采用定制桨B 的发酵罐在1 发酵前期由于溶氧水平最高,菌体过快生长,但是由于产生菌质粒复制跟不上菌体繁殖,因此有相当一部分是质粒缺失的( 图3D)。同时由图4 可知,采用定制桨A 的发酵罐大肠埃希菌染色深、菌丝粗壮、菌体较长且边沿整齐光滑;而采用定制桨B 的发酵罐大肠埃希菌染色浅、菌丝衰弱、菌体较短且边沿模糊不整齐,考虑定制桨B 较大,对菌体剪切力也较大,可能增加了菌体质粒不稳定性、抑制了菌体的正常生长和1 的合成;采用标准桨的发酵罐大肠埃希菌染色浅,菌体短小,由于搅拌桨尺寸小,保持溶氧含量相当的情况下,所需搅拌转速越大,剪切大,对菌体生长不利。本组试验结果显示,当采用定制桨A,且在开始补加葡萄糖后为维持溶氧浓度大于50%,设定搅拌转速为460 r/min,从而使得发酵罐发酵前期在保持适当比生长速率的同时提供合适的溶氧浓度,产生菌在对数生长期保持较高比生长速率,且乙酸较少积累,细胞质粒稳定性较高,在整个发酵过程一直维持1 较高涨幅,发酵36 h 达到最高产酸水平61 g/L。该发酵水平为目前国内已有报道1 发酵的最高水平。
3 讨论
大肠埃希菌高密度发酵产1 的影响因素有很多,溶氧水平作为关键因素之一,过高或过低的溶氧浓度都会影响菌体的生长速率,改变菌体的代谢途径,同时影响基因工程菌的质粒稳定性,也对1 的产量有较大的影响。缺少质粒的大肠埃希菌在代谢过程产生大量乙酸,同时带质粒的大肠埃希菌在溶氧水平较高的条件下,菌体生长速率过快,三羧酸(TCA) 循环达到饱和时也会引起发酵培养基中乙酸的积累,Han 等认为细菌在低比生长速率条件下通过氧化代谢作用产生的能量足以满足合成和异化作用的需求[11],不会产生乙酸;而在高比生长速率时,大肠埃希菌仅靠氧化代谢不能提供足够的能量,必须通过乙酸生成途径储备ATP 和NADH2,而乙酸的大量生成和积累严重抑制菌体的进一步繁殖和1的合成。因此维持合适水平的溶氧浓度,不仅有利于菌体生长,还有利于1 产量的提高,大大较少了副产物乙酸的生成和细胞质粒的丢失,增加了中后期菌体比生长速率和1 的积累,对工业化发酵生产1 具有一定的指导意义。
基金项目:国家“重大新药创制”科技重大专项(2012ZX09201101-0 0 8) 、国家自然科学基金(8 1 2 7 3 4 1 3) 、上海市自然科学基金(14ZR1440200)
作者简介:宋 乐(1990—),男,硕士研究生,研究方向:微生物药物学。
E-mail:694732105@qq.com
通信联系人:林惠敏(1982—),女,博士,副研究员,从事微生物与生化药学研究。
Tel:021-20572000×2032
E-mail:hmlin1127@163.com
以上为文章节选部分