目前,改良菌种的常用手段为诱变,而离子束注入是目前微生物诱变育种的高效诱变技术,该方法是物理和化学诱变的综合体,利用离子注入微生物细胞内,引起微生物体内DNA或染色体等发生变化,人工定向选育得到新品种[15]。因此本试验选用N+离子注入对红曲霉M2进行诱变,并且对发酵条件进行优化,以期得到高产Monacolin K的红曲诱变菌株。
1 材料与方法
1.1 材料
1.1.1 菌种
紫色红曲霉菌种M2,由本实验室筛选,于4 ℃冰箱中保存。
1.1.2 主要试剂和仪器
Monacolin K标准品 Sigma公司;色谱甲醇 Fisher公司;马铃薯葡萄糖琼脂培养基 青岛高科技工业园海博生物技术有限公司;葡萄糖、蔗糖、甘油、蛋白胨、NaCl、NaNO3、MgSO4·7H2O、KH2PO4等化学试剂均为国产分析纯;大豆蛋白粉、酵母粉等其他试剂均为生化试剂。
多功能复合离子注入设备 成都同创材料表面新技术工程中心;超净工作台 济南杰康净化设备厂;高效液相色谱仪 Agilent公司;HZQ-Q全温振荡器、HPS-250生化培养箱 北京东联哈尔有限公司;SB-3200DT超声波清洗机 宁波新芝科技股份有限公司。
1.1.3 培养基
种子培养基:米粉30 g,葡萄糖20 g,NaNO3 2 g,蛋白胨15 g,MgSO4·7H2O 1 g,KH2PO4 1.5 g,加水至1000 mL,pH自然。
液态发酵培养基:米粉50 g,NaNO3 2 g,蛋白胨15 g,MgSO4·7H2O 1 g,ZnSO4 2 g,KH2PO4 1.5 g,加水至1000 mL,pH自然。
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:取46.0 g,加入1000 mL蒸馏水中,115 ℃高压灭菌 20 min,备用。
1.2 实验方法
1.2.1 单孢子悬液的制备
红曲菌接种于PDA培养基上,28 ℃恒温培养。将培养至对数期的红曲菌用生理盐水冲洗,制得孢子悬液,收集孢子悬液接种到苦荞培养基(苦荞8 g+25 mL水)中,培养72 h左右,加入0.9%的生理盐水制得孢子菌悬液,180 r/min摇床振荡打散,过滤除去菌丝,调整孢子悬浊液浓度至106 个/mL,添加甘油至体积分数为5%,备用。
1.2.2 N+离子注入诱变
1.2.2.1 离子注入前样品的制备
取制得的单孢子菌悬液,按照每个培养皿0.5 mL液体菌种进行涂布,然后经无菌风吹干制成菌斑。
1.2.2.2 离子注入剂量的选择
本试验选择几个不同的离子注入剂量,在郑州大学离子束诱变育种及生物工程省重点实验室进行离子注入。N+束能量为30 keV,束流大小为10 Ma,真空度为10-2 ~10-3 Pa,注入剂量分别为1×1015,5×1015,1×1016,5×1016,1×1017 N+/cm2,同时设置真空对照和空气对照,每个处理设3个重复。诱变孢子用1 mL无菌水洗脱,吸取0.1 mL孢子悬液均匀涂抹于PDA平板中,28 ℃培养箱中培养。
1.2.2.3 离子注入最佳剂量的确定
对经不同离子注入剂量处理的平皿菌斑以及对照平皿制取菌悬液进行显微镜计数,同时计算存活率,从而确定最佳的离子注入剂量。
1.2.3 高产Monacolin K菌株初筛
1.2.3.1 构巢曲霉对峙培养
利用Monacolin K能够抑制构巢曲霉生长的特点,使用一定规格的打孔器移取相同大小的诱变红曲霉接种到PDA平板的一侧,28 ℃培养5 天,在平板另一侧对应位置接种相同大小的构巢曲霉菌落,将平板放于28 ℃培养箱中进行静置培养,培养几天后测量构巢曲霉的菌落直径,筛选Monacolin K高产的菌株。
1.2.3.2 Monacolin K抗性平板筛选
在PDA培养基中加入Monacolin K溶液,使培养基中Monacolin K的浓度分别为100,200,300,400 mg/L,每个浓度下平行设置3个重复,将构巢曲霉对峙培养筛选得到的诱变菌株涂布于抗性平板上,28 ℃培养7 天,观察菌落生长情况,根据菌落生长状况,选取在高浓度Monacolin K平板上存活的诱变菌株进行后续实验。
1.2.4 高产Monacolin K菌株复筛
将初筛得到的红曲霉菌接种到种子培养基,28 ℃条件下摇床培养3 天,根据5%(ρ)量接种于液态发酵培养基中,平行设置3个重复,28 ℃发酵培养,利用高效液相色谱仪HPLC检测液态发酵样品中Monacolin K含量。
高效液相色谱条件:色谱柱Agilent ZORBAX SB-C18 (4.6 mm×150 mm,5 μm);检测波长238 nm,流速1.0 mL/min;流动相比例:甲醇∶0.1%磷酸缓冲液(77∶23,V/V),进样量10 μL,柱子温度保持在25 ℃。
酸式标准品溶液的配制:称Monacolin K(内酯)标准品,以0.2 mol/L氢氧化钠溶液定容,在50 ℃条件下超声转化1 h,放置到温室后再放置1 h,配制成质量浓度为0.10,0.20,0.30,0.40,0.50 mg/mL的酸式标准液。
内酯标准溶液的配制:称取Monacolin K(内酯)标准品溶解于甲醇溶液中,配制成质量浓度为1 μg,10 μg,100 μg,1 mg,10 mg/mL的洛伐他汀闭环标准溶液。
诱变菌株发酵液处理方法:吸取250 μL红曲发酵液于2 mL EP管中,加入750 μL有机溶剂溶液混匀,50 ℃条件下超声1 h,12000 r/min离心5 min,离心后用0.22 μm有机微孔滤膜过滤上清液,高效液相色谱仪测定样品中Monacolin K含量。
1.2.5 遗传稳定性实验
将复筛得到的高产Monacolin K诱变菌株接种于PDA固体培养基上,连续转接5代,相同条件下进行发酵培养,高效液相色谱仪检测每代产Monacolin K产量,分析诱变菌株的遗传稳定性。
1.2.6 发酵培养条件的优化
发酵温度、摇床转速、接种量、发酵时间对红曲霉产Monacolin K的影响。
1.2.7 数据处理
实验数据用Excel 2010软件进行整理和统计分析。
2 结果与分析
2.1 原始菌株M2产Monacolin K的能力
Monacolin K易溶于有机溶剂,因此分别采用不同浓度的乙醇、甲醇、乙酸乙酯进行提取,按照1.2.4方法处理原始菌株M2发酵样品,测定Monacolin K的含量,结果表明:以100%的乙醇和甲醇为提取溶剂时,M2中Monacolin K提取率最高,但是用甲醇提取Monacolin K时,酸型和内酯型Monacolin K不存在相互转化[16],因此在实际提取工作中采用甲醇溶液作为Monacolin K的提取溶剂见图1。

图1 不同提取溶剂对Monacolin K提取率的影响
Fig.1 The effect of different extraction solvent on the extracting rate of Monacolin K
对原始出发菌株M2进行液态发酵,提取M2菌株的发酵液进行HPLC检测,根据标准曲线计算Monacolin K产量为129.87 mg/L。
2.2 多功能复合离子束注入效应
在N+离子注入过程中,随着诱变剂量的增加,在离子注入剂量为1×1015 N+/cm2时,红曲菌株的存活率仅为18.52%,在5×1015 N+/cm2剂量时菌落存活率为25.44%,呈现上升的趋势,但是在1×1016 N+/cm2时菌落存活数又下降,并且此后随着离子注入剂量的增加,菌株的存活率一直呈现下降趋势。

图2 N+注入对紫色红曲M2存活率的影响
Fig.2 Effect of N+ implantation on survival rate of Monascus purpureus M2
由图2可知,M2菌株存活率曲线符合“马鞍型”剂量-效应曲线,在马鞍型区域内具有较高的正突变率,可以获得产量较高的正突变株[17-20],因此可以确定1×1015~1×1016 N+/cm2为该菌株的最佳离子诱变范围。
2.3 Monacolin K诱变菌株初筛
2.3.1 构巢曲霉对峙培养
由于红曲霉产生的Monacolin K对构巢曲霉的生长具有抑制作用。因此,构巢曲霉菌落直径越小的平板上红曲霉合成Monacolin K的能力越强[21]。因此我们将诱变得到的单菌落与构巢曲霉做对峙培养,发现与原菌M2相比,部分诱变菌株的平板上构巢曲霉对应的直径相对要小,因此我们挑选在对峙培养过程中构巢曲霉直径较小的菌株进行后续实验,见表1。
表1 部分对峙培养的构巢曲霉直径
Table 1 Partial Aspergillus nidulans diameters of plate confrontation culture mm

编号菌落平均直径编号菌落平均直径原菌332-14271-14242-7262-2243-5253-1243-9273-7265-18233-18264-932.54-73210-162910-62611-152711-13225-9285-42413-527
2.3.2 Monacolin K抗性平板筛选
菌株生产次级代谢产物的能力是与耐自身代谢产物的能力呈正相关的,因此,我们将筛选到的红曲诱变菌株全部涂布于Monacolin K浓度梯度抗性平板中,28 ℃培养一定时间后,发现随着Monacolin K浓度的提高,红曲菌的菌落数逐渐减少,当平板内浓度升高到200 mg/L时,发现在平板上只有几个菌落正常生长,分别是1-14,2-2,3-1,3-5,5-4,5-18,在300 mg/L的平板中只有11-13菌落生长,而到400 mg/L时,平板中并没有红曲单菌落生长,因此我们认为长势良好的这7株菌株具有较高的反馈调节抑制,具备高产Monacolin K的能力,因此将它们进行液态发酵培养,HPLC检测产Monacolin K的能力,见图3。

图3 初始菌株M2及7株突变株产Monacolin K能力
Fig.3 Monacolin K production of 7 mutants and original strain M2
2.4 遗传稳定性实验
为了检测突变株的遗传稳定性,对筛选出的这7株突变株连续传代5次,采用HPLC法检测第5代突变株中Monacolin K含量。
表2 高产Monacolin K遗传稳定性
Table 2 Genetic stability of Monacolin K production

编号Monacolink产量(mg/L)遗传稳定性(%)原菌129.7199.881-14201.5871.192-2160.0964.213-1184.0867.4311-13300.4599.125-4187.4570.703-5120.6751.065-18197.4772.82
由表2可知,红曲霉原菌和突变株经5次传代培养后,子代相对于第1代产Monacolin K能力均有所下降,但是突变株11-13遗传性能比较稳定,Monacolin K产量相对稳定,故选择该菌株作为后续研究的菌株。
2.5 单因素发酵条件的优化
2.5.1 发酵温度的优化
不同温度下,菌丝的生长速度和代谢速度是不一样的,并且发酵产物的积累量也不一样,因此我们设置了不同的发酵温度,观察红曲11-13中液态发酵物中Monacolin K的含量。

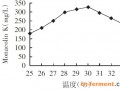
图4 不同温度对Monacolin K的影响
Fig.4 Effects of different temperatures on Monacolin K
由图4可知,随着温度的升高,Monacolin K含量增高,在30 ℃时达到最高值,随后随着温度的升高,发酵产物的含量也下降。因此选择发酵温度30 ℃进行实验。
2.5.2 摇床转速的优化
在发酵温度恒定的条件下,改变摇床转速,可以改变溶氧效果。

图5 不同转速对Monacolin K的影响
Fig.5 Effects of different speed on Monacolin K
由图5可知,随着摇床转速的提高,红曲菌株11-13的发酵液中Monacolin K的含量逐渐增加,摇床转速为200 r/min时,发酵液的Monacolin K达到最大值,继续增加摇床转速,Monacolin K产量反而降低。因此,选取200 r/min作为最佳摇床发酵转速。
2.5.3 接种量的优化
接种量的大小与发酵过程中底物的消耗速率、细胞生长速率有密切的关系,从而影响发酵时间的长短和目标产物的产量。

图6 不同接种量对Monacolin K的影响
Fig.6 Effects of different inoculum size on Monacolin K
由图6可知,在发酵温度30 ℃和摇床转速200 r/min的情况下,接种量少于5%时,菌株11-13的发酵产物中Monacolin K的含量较少;接种量为10%时,Monacolin K达到最高;接种量增加反而不利于Monacolin K的积累。因此,选择10%为最佳接种量。
2.5.4 发酵时间的影响

图7 发酵时间对Monacolin K的影响
Fig.7 Effects of different fermentation time on Monacolin K
由图7可知,随着时间的延长,Monacolin K产量越来越多,14天时达到最高。随着时间的延长,菌株11-13的发酵液中Monacolin K含量降低,说明营养物质消耗已尽,发酵结束。因此选择发酵周期为14天。
3 讨论
本研究采用N+离子注入法对紫红曲霉M2进行诱变,经过构巢曲霉对峙培养、Monacolin K抗性平板筛选和HPLC检测得到1株遗传稳定的诱变菌株11-13,该菌株产Monacolin K的能力是原菌株M2的2.3倍。并对部分发酵培养条件进行了研究,发现最佳发酵培养条件为:温度30 ℃,转速200 r/min,接种量10%,发酵时间14天。
与原始菌株M2的产量相比,N+离子注入法诱变得到的突变株产量虽高,但是真正用于生产,还需要综合考虑产品品质和经济效益,并且紫红曲霉M2次生代谢产物中还包括影响人类健康的有毒物质桔霉素,因此拟在后续实验中,从降低有毒物质桔霉素含量、改进液态发酵工艺等方面着手,从而筛选出高产量的红曲诱变菌株,进而推动工业生产。
参考文献:
[1]Cheng M J,Wu M D,Chan H Y,et al.A new azaphilone metabolite from the fungus Monascus ruber[J].Chem Nat Compd,2016,52:231-233.
[2]Cheng M J,Wu M D,Chen J J,et al.Secondary metabolites from the red mould rice of Monascus pupureus BCRC38113[J].Nat Prod Res,2010,24:1719-1725.
[3]Sham T T,Chan C O,Wang Y H,et al.A review on the traditional Chinese medicinal herbs and formulae with hypolipidemic effect[J].Biomed Res Int,2014:21-24.
[4]Liu M T,Wang A L,Zhen S,et al.Cytotoxic monacolin analogs from Monascus pupureus fermented rice[J].J Asian Nat Prod Res,2013,15:600-609.
[5]Dajung J,Deokyeong C,Kyunghwa N,et al.Biological evaluation of novel derivatives of the orange pigments from Monascus pupureus sp.as inhibitors of melanogenesis[J].Biotechnol Lett,2014,36:1605-1613.
[6]Su Y C,Wang J J,Lin T T,et al.Production of the secondary metabolites γ-aminobutyric acid and monacolin K by Monascus[J].J Ind Microbiol Biotechnol,2003,30:41-46.
[7]Endo A.Monacolin K,a new hypocholesterolemic agent produce by a Monascus species[J].J Antibiot,1979,32(8):852-854.
[8]Alberts A W,Chen J,Kuron G,et al.Mevinolin,a highly protent competitive inhibitor of hydroxymethylglutaryl coenzyme A reduciase and a cholesterol-lowering agent[J].P Natl Acad Sci,1980,77(7):3957-3961.
[9]Endo A.Monacolin K,a new hypocholesterolemic agent that specifically inhibits 3-hydroxy-3-methylglutaryl coenzyme a reductase[J].J Antibiot,1980,33(3):334-336.
[10]Feuerstein J,Bjerke W.P02.88.powdered red yeast rice and plant stanols and sterols to lower cholesterol[J].BMC Complem Altern,2012,9(2):110-115.
[11]Chen H H,Chen Y Y,Yeh J Z,et al.Immune-stimulated antitumor effect of different molecular weight polysaccharides from Monascus pupureus on human leukemic U937 cells[J].Cyta-J Food,2014,12:134-140.
[12]Patel S.Functional food red yeast rice (RYR) for metabolic syndrome amelioration:a review on pros and cons[J].World J Microb Biot,2016,32(87):1-12.
[13]Klawitter J,Shokati T,Moll V,et al.Effects of lovastatin on breast cancer cells:a proteo-metabonomic study[J].Breast Cancer Res,2010,12(2):1-20.
[14]Francielo V,Rose M B,Julio C C,et al.Monascus:a reality on the production and application of microbial pigments[J].Appl Biochem Biotech,2016,178:211-223.
[15]缪建顺,杨建设,张苗苗,等.重离子辐照微生物效应及诱变育种进展[J].辐射研究与辐射工艺学报,2014,32(2):1-8.
[16]朱华,许赣荣,陈蕴.HPLC法测定红曲中酸型与内酯型Monacolin K[J].无锡轻工大学学报,2003,22(3):46-52.
[17]邵春林,余增亮.离子束辐照下微生物、植物组织存活模型的研究[J].核技术,1997,20(7):423-430.
[18]宋道军,姚建铭,邵春林,等.离子注入微生物产生“马鞍型”存活曲线的可能作用机制[J].核技术,1999,22(3):129-132.
[19]Joiner M C,Marples B,Lambin P,et al.Low-dose hypersensitivity: current status and possible mechanisms[J].Int J Radiat oncol Biol Phys,2001,49(2):379-389.
[20]韩荣飞,吴跃进,卞坡,等.低能重离子剂量-存活率效应及其拟合模型探讨[J].原子核物理评论,2009,26(4):352-355.
[21]陈泉,吴远征,扈进冬,等.高产Monacolin K红曲霉菌种的筛选及液态发酵条件优化[J].中国酿造,2015,34(6):43-47.
Screening of Monascus with High-yield Monacolin K and Optimization of Liquid-state Fermentation Conditions
LI Ling1, CHEN Kai1, WANG Yi-lian1, ZHANG Wei2, YANG Yu-zhong1, HU Jin-dong1, LI Ji-shun1*
(1.Ecology Institute of Shandong Academy of Sciences, Shandong Provincial Key Lab for Applied Microbiology, Ji'nan 250014, China;2.Institute for the Control of Agrochemicals,Ministry of Agriculture, Beijing 100026, China)
Abstract: In order to improve the yield of Monacolin K, Monascus purpureus M2 is mutagenized by 30 keV N+ ion implantation. The dose is 1×1015, 5×1015, 1×1016, 5×1016, 1×1017 N+/cm2 respectively Excellent mutant strains are obtained through the screening method of plate confrontation culture of Aspergillus nidulans, Monacolin K resistance and high performance liquid chromatography (HPLC). And the fermentation conditions are optimized by liquid-state fermentation experiments.The results show that the Monacolin K yield of the best mutant 11-13 is 2.3 times higher than initial strain M2.It remains steady after 5 generations of serial cultivation.The optimum liquid-state fermentation conditionsof 11-13 are as follows:the temperature is 30 ℃, the inoculum size is 10%,the rotating speed is 200 r/min, the fermentation time is 14 days.
Key words: Monascus;Monacolin K;N+ ion implantation;mutation breeding;fermentation conditions
中图分类号:TS261.12
文献标志码:A
doi:10.3969/j.issn.1000-9973.2017.12.019
文章编号:1000-9973(2017)12-0089-05
收稿日期:2017-06-17 *通讯作者
基金项目:山东省科学院青年基金项目(2017QN009)资助;山东省重点研发计划(2016GNC113009)
作者简介:李玲(1985-),女,山东泰安人,助理研究员,博士,研究方向:应用与环境微生物;
李纪顺(1971-),男,山东沂水人,高级工程师,主要从事应用微生物和耐盐植物方面的研究