关键词: 番茄红素 三孢布拉霉 菌种选育 工艺优化 化学调控
Advance in production of lycopene by Blakeslea trispora
WANG Qiang, YU Xiao-Bin
The Key Laboratory of Industrial Biotechnology,Ministry of Education, School of Biotechnology, Jiangnan University, Wuxi, Jiangsu 214122, China Abstract: Lycopene is a member of important carotenoids with antioxidation, anti-aging, immunity enhancement, and other physiological functions. Although commercial production of lycopene has been realized in some enterprise, poor lycopene production remains the key restricting factor for lycopene biosynthesis by Blakeslea trispora. Combining with the latest achievements of lycopene production by B.trispora, this mini-review summarized the genetic breeding of strain, the optimization of fermentation process, chemical regulation, and the prospects of future research.
Key words: Lycopene Blakeslea trispora Genetic breeding Process optimization Chemical regulation
番茄红素是一种重要的类胡萝卜素,被广泛用作抗氧化剂、抗癌剂和着色剂等[1,2,3,4]。它是由40个碳原子构成的直链碳氢化合物,全反式结构包括11个共轭双键和两个非共轭双键(图 1)。这种共轭多烯链的结构赋予了番茄红素极强的猝灭单线态氧和清除自由基能力。目前,番茄红素市场尚处于发展阶段,主要体现在昂贵的价格和日益扩增的市场需求方面。天然提取的番茄红素面临着植物中色素含量低和纯化工艺复杂等问题。尽管化学合成番茄红素成本低廉,但是其副产物多,产品难以达到食品安全的要求。近年来,随着生物技术的蓬勃发展,利用微生物发酵生产番茄红素受到越来越多人的关注。在众多产番茄红素菌株中,三孢布拉霉(Blakeslea trispora)是目前唯一实现工业化生产的菌株。然而,番茄红素的产量仍然是制约发酵法生产番茄红素的重要因素,虽然已经有部分企业实现了番茄红素的工业化生产,但番茄红素产量还有很大的提升空间。本文从遗传育种、发酵工艺优化、化学调控等方面综述了提高三孢布拉霉中番茄红素产量的研究进展。

图 1 全反式番茄红素结构图
Figure 1 Molecular structure of all-trans-lycopene
注:分子式:C40H56;分子量:536.89.
Note: Molecular formula: C40H56; Molecular Weight: 536.89.
图选项
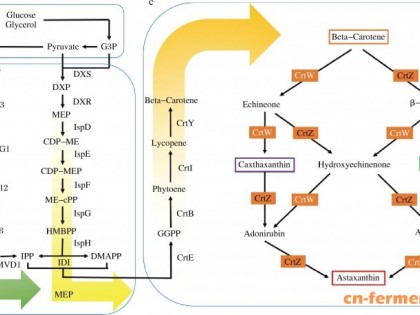
目前已发现的番茄红素生物合成途径有两条,即甲基戊酸(MVA)途径[5]和2-甲基-D-赤藻糖醇-4-磷酸(MEP)途径[6],在三孢布拉霉中是经典的MVA途径(图 2)。MVA途径是以三羧酸循环产生的乙酰辅酶A为前体,进一步转化成重要的萜烯类前体化合物异戊二烯焦磷酸(IPP)。其中,催化3-羟基-3甲基戊二酸单酰辅酶A (HMG-CoA)形成3-甲基-3,5二甲基戊酸(MVA)的HMG-CoA还原酶是番茄红素合成途径中的第一个关键限速酶。IPP在IPP异构酶的催化作用下可逆的形成二甲基丙烯焦磷酸(DMAPP),这是番茄红素合成途径的又一关键步骤,IPP和DMAPP的比例大约为1:9[7]。接下来经过一系列的缩合反应,碳链延长至40个碳的八氢番茄红素,八氢番茄红素再经过四步脱氢形成番茄红素,番茄红素在番茄红素环化酶的催化下经过两步环化形成β-胡萝卜素[8]。在发酵过程中需添加环化酶抑制剂或者利用其它手段抑制环化酶基因的表达,从而大量获得番茄红素,避免β-胡萝卜素会作为终产物大量积累。

图 2 三孢布拉霉中番茄红素的合成途径
Figure 2 Biosynthetic pathway for lycopene formation in Blakeslea trispora
图选项
1 三孢布拉霉的遗传育种和改造
1.1 菌种选育
三孢布拉霉是一种整个生命周期均为多核的微生物,包括菌丝体和孢子[9]。该菌番茄红素代谢调控机理的研究尚处于发展阶段,利用基因工程手段对其进行代谢调控还处于起步阶段。因此,诱变育种仍然是常用且有效的育种方法。三孢布拉霉是一种接合真菌,分为正菌和负菌,其中负菌是番茄红素的主要产生菌,正菌作为配对菌与负菌共同发酵产生三孢酸,从而极大的促进了番茄红素的 合成[10,11]。
Rodriguez等[12]在专利中提到,利用紫外(UV)、亚硝基胍(NTG)和甲基磺酸乙酯(EMS)分别对B. trispora (+)和B. trispora (−)进行复合诱变,根据诱变后负菌在添加一定量三孢酸的固体平板上菌落颜色差异进行初步筛选。并将负菌与诱变后的正菌进行配对实验,根据接合区条带颜色差异做进一步筛选。最终,获得在摇瓶实验中产量高达3.7 g/L的优良菌株。本研究室利用NTG处理和氮离子注入B. trispora (−),经过添加三孢酸粗提液和洛伐他汀的固体平板初筛,优良菌株再与B. trisp ora (+)在固体平板上进行配对实验,根据正负菌接合区菌落颜色进一步筛选,最终获得番茄红素产量较出发菌株提升64%的优良菌株[13]。洛伐他汀是HMG-CoA还原酶的竞争性抑制剂,可阻断HMG-CoA向MVA的转化,而MVA是番茄红素和固醇合成的共同前体,一定量洛伐他汀的添加可抑制菌株的生长。而能在洛伐他汀平板上生长的突变菌株可能是HMG-CoA还原酶发生改变不受洛伐他汀抑制或者具有更高的表达量,因此可能有更高的番茄红素合成能力。由于B. trispora (−)在单独培养的过程中仅能合成少量的番茄红素,诱变后不同产量菌株在平板上差异并不明显。三孢酸是一种性激素,可极大的刺激B. trispora (−)单独培养中番茄红素的合成。因此,一定量三孢酸的添加可显著放大高产菌株与普通菌株在平板上的菌落颜色差异,提高筛选效率。在之后的研究中我们又利用ARTP诱变系统处理B. trispora (−),经过数轮筛选,得到一株产量达1.2 g/L的突变菌株,较出发菌株提升了55%[14]。常压室温等离子体(ARTP)诱变技术是近年来陆续被用于工业微生物的育种,这种诱变技术具有设备简单、安全无毒、突变率高等特征。Mehta等[15]通过NTG处理B. trispora孢子,经过数轮接合培养,最终获得产量达39 mg/g的β-胡萝卜素的两性异核体以及番茄红素环化酶缺陷型菌株。
诱变育种是获得番茄红素高产菌株简单有效的方法,但同时也存在诱变安全性差、筛选工作量大等问题。在传统诱变方法中,化学诱变剂多为强致癌物,极易对操作者和环境造成危害,紫外诱变等穿透力差,突变率低。低能离子注入近年来被广泛应用于工业微生物的遗传育种,并已获得酶、抗生素等代谢产物的高产优良菌株。低能离子诱变是集物理、化学诱变为一体的综合诱变方法,具有突变率高、死亡率低、性状稳定等特点,可作为获得番茄红素优良菌株的重要诱变方法。诱变育种的盲目性和不确定性对优良菌株的获得造成了巨大的困难,合理设计筛选方案,提高正突变率和筛选效率是诱变育种的重要工作。然而,提高番茄红素筛选效率的报道并不多见,尤其是如何有效获得番茄红素环化酶缺陷型菌株。因此,如何根据关键酶基因的调控特点合理设计筛选方案仍然是今后研究的重点。
1.2 遗传改造
在正常情况下,番茄红素在三孢布拉霉中的积累量仅占类胡萝卜素总量的5%左右,而β-胡萝卜素则大量积累。番茄红素向β-胡萝卜素的转化是在番茄红素环化酶的催化下经过两步环化完成的。番茄红素环化酶受carRA基因的编码,而carRA基因又同时编码着八氢番茄红素合成酶,而该酶是番茄红素的前体八氢番茄红素合成的关键基因[16]。李 晔[17]利用RNAi技术沉默carRA基因的表达,虽然实现了对番茄红素环化酶基因表达的抑制,但同时类胡萝卜素的产量也大幅度下降。目前,通过基因工程手段完成仅对carRA基因的番茄红素环化酶编码区域进行定点突变的技术尚无报道。Lorca-Pascual等[18]和Nicolás-Molina等[19]发现crgA基因作为类胡萝卜素合成的负调控基因存在于卷枝毛霉(Mucor circinelloides)中,该基因是光诱导型和光适应型基因。卷枝毛霉的crgA基因缺陷型菌株无论在黑暗还是光照条件下,类胡萝卜素合成基因的mRNA水平均显著高于野生菌株。在之后的研究中,Quiles-Rosillo等[20]通过三孢布拉霉与卷枝毛霉异源杂交技术成功从三孢布拉霉中克隆出crgA基因,并发现其光调控机理在这些丝状真菌中是基本保守的。关于该基因与类胡萝卜素合成基因之间的调控机理还有待进一步的研究,还没有关于三孢布拉霉的crgA基因缺陷型菌株的报道。
由于三孢布拉霉自身复杂的基因特征,分子改造并没有直接获得番茄红素高产菌株。虽然在大肠杆菌和毕赤酵母中也都成功构建了产番茄红素基因工程菌,但极低的产量和生物量使其难以实现工业化生产,目前仅作为理论研究。如何利用分子手段抑制carRA基因番茄红素环化酶编码区域的表达仍是今后研究的重点之一。另外,虽然番茄红素的生物合成途径已经研究清楚,但关键基因的调控机理尚待进一步研究。
2 发酵工艺的调控
2.1 培养基优化
在工业规模的生产中,接种所用孢子量是巨大的,贫瘠的孢子量势必会引起产孢子培养基成本的增加。Roukas等[21]利用响应面法对三孢布拉霉产孢子培养基进行优化,得到的新培养基上可产孢子2×107个/平板(直径9 cm培养皿),较PDA培养基提升95%。Filotheou等[22]利用响应面法对三孢布拉霉产类胡萝卜素的基本培养基和微量元素进行优化,优化后类胡萝卜素总产量达154 mg/g (其生物量未见报道),较优化前提升了35倍。López-Nieto等[23]利用遗传算法优化三孢布拉霉产番茄红素的培养基,并对其在半工业化规模的 800 L发酵罐中的发酵参数进行优化,最终番茄红素在发酵罐中产量达0.8 g/L。三孢布拉霉产番茄红素的发酵为正负菌混合发酵,两者的比例对类胡萝卜素产量的影响非常显著。Varzakakou等[24]研究正负菌接种比例对类胡萝卜素合成的影响时发现,当正负菌接种比例为1:10时,类胡萝卜素产量达到最大值1.4 g/L,不同比例对发酵液中菌丝体形态有较大影响。尽管关于正负菌接种比例的报道不尽相同,但负菌的比例均明显高于正菌,这是由于负菌是类胡萝卜素的主要生产者,而正菌仅作为配对菌产生性激素刺激负菌色素的合成。
在已报道的文献中,培养基的组成成分差异较大,这说明三孢布拉霉的酶系丰富,可利用的碳氮源非常广泛。这种差异往往会对之后的研究者造成困惑,不得不重新优化培养基的组成,在培养基的选择上参考价值较低。目前,关于培养基组成和培养条件优化的报道较多,但关于其对番茄红素产量提高作用机制的研究并不多见。因此,在未来的研究中应更多的倾向于培养基成分和发酵条件对三孢布拉霉产番茄红素的作用机制。
2.2 外源植物油
一些研究者发现,外源植物油(如大豆油、橄榄油等)的添加可显著提升类胡萝卜素在三孢布拉霉中的的含量。早在1958年,Ciegler等[25]就发现了外源植物油(尤其是富含油酸和亚油酸的油类)可显著促进三孢布拉霉中β-胡萝卜素的合成。Mantzouridou等[26]报道,10 g/L粗橄榄油或粗大豆油的添加明显促进了三孢布拉霉中类胡萝卜素的合成,其含量与对照组相比分别提升了14倍和40倍。该作者随后的研究发现,在添加上述植物油的情况中,三孢布拉霉胞内脂肪中不饱和三酰甘油的含量明显增加,并且在低浓度粗橄榄油存在时,可检测到明显的脱氢酶活性[27]。Vereschagina等[28]研究外源脂肪与番茄红素合成关系发现,只有富含亚麻油酸的外源植物油可显著提升三孢布拉霉中番茄红素的积累,同时伴随着中性脂肪酸在总脂肪酸中比例的上升。
外源植物油的添加一方面作为辅助碳源提供乙酰辅酶A以及番茄红素合成中间代谢产物的来源,另一方面富含亚麻油酸的外源植物油的添加可提升中性酯中脂肪酸的不饱和度。番茄红素主要贮藏于三孢布拉霉的脂肪体中,脂肪体是一种主要由中性酯构成。番茄红素作为一种胞内产物,中性酯不饱和度的增加可提高番茄红素在其中的溶解度,解除高浓度番茄红素的代谢产物抑制作用。
2.3 环化酶抑制剂
番茄红素环化酶抑制剂主要包括一些胺类和含氮杂环化合物,例如咪唑、吡啶及其衍生物等。Hsu等[29]研究表明,一定量2-(4硫代氯苯基)-三乙胺盐酸盐(CPTA,35 mg/L)的添加可有效抑制环化酶活性,番茄红素作为主要色素在三孢布拉霉中大量积累。另外,100−150 mg/L CPTA的添加不仅可以抑制环化酶活性,还作为番茄红素合成途径中某些酶调控基因的去阻遏物。Pegklidou等[30]研究指出,2-甲基咪唑可在较低浓度时(50 mg/L)有效抑制番茄红素环化酶的活性,番茄红素积累量占总类胡萝卜素的94%,与其他含氮杂环化合物相比,具有更好的抑制作用。国内学者修宇等[31]报道称,在三孢布拉霉发酵48 h添加0.75 g/L 2-(4-甲基苯氧)-三乙基胺(MPTA)可有效抑制β-胡萝卜素的合成(番茄红素占总类胡萝卜素的96%);添加15 g/L烟草可促进总类胡萝卜素的产量,但其对β-胡萝卜素的合成抑制作用低于MPTA。
目前,利用分子学手段抑制番茄红素环化酶基因编码区表达的成功案例尚未见报道,仅有少量报道通过随机诱变获得番茄红素环化酶基因缺陷型菌株。因此,为获得大量番茄红素,环化酶抑制剂的添加显得必不可少。然而,番茄红素作为一种食品添加剂,环化酶抑制剂的添加势必会对其安全性产生一定的隐患。目前,寻找一种高效、低毒甚至无毒的环化酶抑制剂依然是待解决的重要难题 之一。
2.4 其他化学促进剂
促进番茄红素合成的化学添加剂种类繁多,主要包括三孢酸结构类似物,表面活性剂,代谢促进剂和支路抑制剂等。Dandekar等[32]研究了三孢酸及其结构类似物脱落酸、β-紫罗兰酮、α-紫罗兰酮和维生素A对三孢布拉霉合成类胡萝卜素的影响。结果发现,这些化合物对类胡萝卜素的合成均有促进作用,它们含有相同的三甲基环己烷环,其中三孢酸的促进作用最明显。Desai等[33]在发酵开始后24 h添加1 mg/L青霉素可有效促进三孢布拉霉中类胡萝卜素的合成,并且不会影响细胞蛋白质和碳水化合物的合成,青霉素可刺激甲基戊酸激酶的活性提升2倍。Kim等[34]研究不同表面活性剂对三孢布拉霉产β-胡萝卜素的影响发现,10 g/L的Span-20可促进β-胡萝卜素的产量从0.15 g/L提升至2.16 g/L。其作用机理是Span-20改变了发酵液中菌丝体的形态,增加了菌丝体在发酵液中的分散度,强化了混合和传质。国内学者王永生等[35]的研究也表明,非离子型表面活性剂Span-20对三孢布拉霉菌丝体形态和番茄红素的影响明显优于其他表面活性剂。Shi等[36]报道称,番茄红素合成的前体物质如异戊二烯醇、二甲基烯丙醇、香叶醇和MVA可有效增加番茄红素的产量,降低成本。Hu等[37]报道称,在发酵36 h添加0.4 g/L花生四烯酸可促进β-胡萝卜素在三孢布拉霉中的产量增加73%,hmgR (编码HMG-CoA还原酶)、carRA (编码八氢番茄红素合成酶和番茄红素环化酶)和carB (编码八氢番茄红素脱氢酶)基因的表达量较对照分别提升了31%、22%和 39%。
氧胁迫是通过破坏促氧化-抗氧化平衡,产生细胞损伤的潜在可能,从而激发细胞的酶促和非酶促保护机制。好氧微生物的酶促保护机制主要是通过提升其超氧化物歧化酶(SOD)和过氧化物酶(CAT)等活性,从而猝灭自由基,维持氧化平衡。非酶促保护机制主要是某些微生物可产生的抗氧化类物质,如类胡萝卜素、谷胱甘肽、抗坏血酸、生育酚、海藻糖等。因此,提高氧化胁迫,可触发三孢布拉霉的抗氧化保护机制,促进其产生更多的类胡萝卜素,从而提升番茄红素产量。Jeong等[38]通过添加H2O2增加对三孢布拉霉的氧化胁迫,诱发细胞的抗氧化保护机制,发酵36 h添加10 μmol/L的H2O2可促进β-胡萝卜素提升46%。Nanou等[39]通过溶氧而产生氧胁迫,类胡萝卜素的产量显著增加,同时SOD和CAT的活性也明显增加。该作者在随后的研究中通过添加氯化铁诱发三孢布拉霉的氧胁迫响应,改变了不同类胡萝卜素的比例,但其总量并未增加[40]。朱艳等[41]通过添加氧载体(正己烷、正十二烷和过氧化氢),有效改善发酵体系中的氧传递速率,从而促进了三孢布拉氏霉菌合成番茄红素的能力。氧载体正十二烷和表面活性剂吐温-80的同时添加可促进番茄红素产量提升114.83%。
尽管三孢布拉霉合成番茄红素的化学促进剂种类繁多,但多数仍处于摇瓶发酵试验阶段,在工业化生产中依旧存在诸多挑战。例如,三孢酸虽然效果很好,但其纯化成本高,在生产中可用发酵液或粗提液替代;Span-20作为一种表面活性剂,其起泡性是重要的限制因素。另外,化学添加剂的安全性和对下游提取工艺的影响也是需要考虑的重要因素。氧胁迫对三孢布拉霉发酵产番茄红素的影响及作用机制近年来被陆续报道,通过添加强氧化物质或者提高通气等增加氧化胁迫,从而提高番茄红素的产量。若将氧胁迫应用于驯化或者筛选番茄红素高产菌株,或许能获得不错的效果。
3 展望
随着人们保健意识的增强,番茄红素以其优秀的抗氧化、抗癌等生理功能受到越来越多研究者的关注和消费者的亲睐,目前番茄红素的产量远远无法满足市场需求。当前要迫切解决的问题是进一步提高番茄红素在三孢布拉霉中的产量,从而降低成本,实现更大规模的工业化生产。根据以上综述和分析,可以从以下几个方面寻找突破点:(1) 高产番茄红素菌株的选育,提高番茄红素产量,降低发酵成本;(2) 寻找低毒甚至无毒的番茄红素环化酶抑制剂,或者利用分子学手段抑制环化酶基因编码区的表达;(3) 分析三孢布拉霉中番茄红素合成的代谢通量分布,利用代谢工程手段促进番茄红素的积累;(4) 分析番茄红素合成关键基因的调控机理,通过添加外源促进剂或其他手段促进关键基因的表达,抑制负调控基因的表达。
参考文献
[1] Kong KW, Khoo HE, Prasad KN, et al. Revealing the power of the natural red pigment lycopene[J]. Molecules, 2010, 15(2): 959-987
[2] Prakash A, Kumar A. Lycopene protects against memory impairment and mito-oxidative damage induced by colchicine in rats: An evidence of nitric oxide[J]. European Journal of Pharmacology, 2013, 721(1): 373-381
[3] Li X, Xu J. meta-analysis of the association between dietary lycopene intake and ovarian cancer risk in postmenopausal women[J]. Scientific Reports, 2014. DOI: 10.1038/srep04885
[4] Published online Jaswir I, Noviendri D, Hasrini RF, et al. Carotenoids: Sources, medicinal properties and their application in food and nutraceutical industry[J]. Journal of Medicinal Plants Research, 2011, 5(33): 7119-7131
[5] Ciegler A. Microbial carotenogenesis[J]. Advances in Applied Microbiology, 1965, 7: 1-14
[6] Rohmer M, Knani M, Simonin P, et al. Isoprenoid biosynthesis in bacteria: a novel pathway for the early steps leading to isopentenyl diphosphate[J]. Biochemical Journal, 1993, 295(2): 517-524
[7] Ladygin VG. Biosynthesis of carotenoids in the chloroplasts of algae and higher plants[J]. Russian Journal of Plant Physiology, 2000, 47(6): 796-814
[8] Goodwin TW. Biosynthesis of carotenoids and plant triterpenes[J]. Biochemical Journal, 1971, 123(3): 293-329
[9] Mehta B, Cerdá-Olmedo E. Mutants of carotene production in Blakeslea trispora[J]. Applied Microbiology and Biotechnology, 1995, 42(6): 836-838
[10] Van DEH. Relationship between sexuality and carotene synthesis in Blakeslea trispora[J]. Journal of Bacteriology, 1968, 96(4): 1298-1303
[11] Wang JD, Yuan QP, Qian ZM. The new advances in trisporic acid-a key metabolite in fermentation production of β-carotene[J]. Microbiology China, 2004, 31(3): 147-150 (in Chinese)王见冬, 袁其朋, 钱忠明. β-胡萝卜素发酵过程中关键的代谢产物——三孢酸[J]. 微生物学通报, 2004, 31(3): 147-150
[12] Rodriguez M, Teresa A, De E, et al. Improved method of production of lycopene by the fermentation of selected strains of Blakeslea trispora: EP Patent, 1,471,151[P]. 2004-10-27
[13] Wang Q, Luo W, Gu QY, et al. Enhanced lycopene content in Blakeslea trispora by effective mutation-screening method[J]. Applied Biochemistry and Biotechnology, 2013, 171(7): 1692-1700
[14] Wang Q, Feng LR, Luo W, et al. Mutation breeding of lycopene-producing strain Blakeslea trispora by a novel atmospheric and room temperature plasma (ARTP)[J]. Applied Biochemistry and Biotechnology, 2014, Published online
[15] Mehta BJ, Obraztsova IN, Cerda-Olmedo E. Mutants and intersexual heterokaryons of Blakeslea trispora for production of β-carotene and lycopene[J]. Applied And Environmental Microbiology, 2003, 69(7): 4043-4048 =
[16] Rodriguez-Saiz M, Paz B, De JL, et al. Blakeslea trispora genes for carotene biosynthesis[J]. Appllied Environmental Microbiology, 2004, 70(9): 5589-5594
[17] Li Y. Study on silencing of the carRA gene by RNA interference in filamentous fungus Blakeslea trispora[D]. Beijing: Doctoral dissertation of Beijing University of Chemical Technology, 2009 (in Chinese)李晔. RNA干扰三孢布拉氏霉菌番茄红素环化酶基因的研究[D]. 北京: 北京化工大学博士学位论文, 2009
[18] Lorca-Pascual JM, Murcia-Flores L, Garre V, et al. The RING-finger domain of the fungal repressor crgA is essential for accurate light regulation of carotenogenesis[J]. Molecular Microbiology, 2004, 52(5): 1463-1474
[19] Nicolás-Molina FE, Navarro E, Ruiz-Vazquez RM. Lycopene over-accumulation by disruption of the negative regulator gene crgA in Mucor circinelloides[J]. Appllied Microbiology Biotechnology, 2008, 78(1): 131-137
[20] Quiles-Rosillo MD, Ruiz-Vazquez RM, Torres-Martinez S, et al. Light induction of the carotenoid biosynthesis pathway in Blakeslea trispora[J]. Fungal Genetics and Biology, 2005, 42(2): 141-153
[21] Roukas T, Niavi P, Kotzekidou P. A new medium for spore production of Blakeslea trispora using response surface methodology[J]. World Journal of Microbiology and Biotechnology, 2010, 27(2): 307-317
[22] Filotheou A, Nanou K, Papaioannou E, et al. Application of response surface methodology to improve carotene production from synthetic medium by Blakeslea trispora in submerged fermentation[J]. Food and Bioprocess Technology, 2012, 5(4): 1189-1196
[23] López-Nieto MJ, Costa J, Peiro E, et al. Biotechnological lycopene production by mated fermentation of Blakeslea trispora[J]. Appllied Microbiology Biotechnology, 2004, 66(2): 153-159
[24] Varzakakou M, Roukas T, Kotzekidou P. Effect of the ratio of (+) and (−) mating type of Blakeslea trispora on carotene production from cheese whey in submerged fermentation[J]. World Journal of Microbiology and Biotechnology, 2010, 26(12): 2151-2156
[25] Ciegler A, Arnold M, Anderson RF. Microbiological production of carotenoids. V. Effect of lipids and related substances on production of beta-carotene[J]. Applied Microbiology, 1959, 7(2): 98-101
[26] Mantzouridou F, Tsimidou MZ, Roukas T. Performance of crude olive pomace oil and soybean oil during carotenoid production by Blakeslea trispora in submerged fermentation[J]. Journal of Agricultural and Food Chemistry, 2006, 54(7): 2575-2581
[27] Mantzouridou F, Tsimidou MZ. Carotenoid pattern in Blakeslea trispora grown on oil-enriched substrates with regard to triacylglycerol species accumulation[J]. European Journal of Lipid Science and Technology, 2007, 109(1): 3-10
[28] Vereschagina OA, Memorskaya AS, Tereshina VM. The role of exogenous lipids in lycopene synthesis in the mucoraceous fungus Blakeslea trispora[J]. Microbiology, 2010, 79(5): 593-601
[29] Hsu WJ, Yokoyama H, Coggins JCW. Carotenoid biosynthesis in Blakeslea trispora[J]. Phytochemistry, 1972, 11(10): 2985-2990
[30] Pegklidou K, Mantzouridou F, Tsimidou MZ. Lycopene production using Blakeslea trispora in the presence of 2-methyl imidazole: yield, selectivity, and safety aspects[J]. Journal of Agricultural And Food Chemistry, 2008, 56(12): 4482-4490
[31] Xiu Y, Yuan QP. The application of tobacco and MPTA during lycopene production by Blakeslea trispora[J]. Journal of Beijing University of Chemical Technology (Natural Science Edition), 2009, 36(1): 81-84 (in Chinese)修宇, 袁其朋. 烟草和MPTA对三孢布拉氏霉合成番茄红素的影响[J]. 北京化工大学学报: 自然科学版, 2009, 36(1): 81-84
[32] Dandekar S, Modi VV, Jani UK. Chemical regulators of carotenogenesis by Blakeslea trispora[J]. Phytochemistry, 1980, 19(5): 795-798
[33] Desai HG, Modi VV. Stimulation of carotenogenesis by penicillin in Blakeslea trispora[J]. Phytochemistry, 1977, 16(9): 1373-1376
[34] Kim SW, Seo WT, Park YH. Enhanced production of beta-carotene from Blakeslea trispora with Span 20[J]. Biotechnology Letters, 1997, 19(6): 561-562
[35] Wang YS, Wang JD, Yuan QP, et al. The effect of mycelial mophology on lycopene fermentation[J]. Microbiology China, 2003, 30(6): 47-51 (in Chinese)王永生, 王见冬, 袁其朋, 等. 菌体形态对发酵法生产番茄红素的影响[J]. 微生物学通报, 2003, 30(6): 47-51
[36] Shi YQ, Xin XL, Yuan QP. Improved lycopene production by Blakeslea trispora with isopentenyl compounds and metabolic precursors[J]. Biotechnology Letters, 2012, 34(5): 849-852
[37] Hu X, Sun J, Yuan Q. Improved β-carotene biosynthesis and gene transcription in Blakeslea trispora with arachidonic acid[J]. Biotechnology Letters, 2012, 34(11): 2107-2111
[38] Jeong JC, Lee IY, Kim SW, et al. Stimulation of β-carotene synthesis by hydrogen peroxide in Blakeslea trispora[J]. Biotechnology Letters, 1999, 21(8): 683-686
[39] Nanou K, Roukas T, Papadakis E. Oxidative stress and morphological changes in Blakeslea trispora induced by enhanced aeration during carotene production in a bubble column reactor[J]. Biochemical Engineering Journal, 2011, 54(3): 172-177
[40] Nanou K, Roukas T. Oxidative stress response of Blakeslea trispora induced by iron ions during carotene production in shake flask culture[J]. Applied Biochemistry and Biotechnology, 2013, 169(8): 2281-2289
[41] Zhu Y, Yuan QP, Wang H. Enhancement of lycopene production by Blakeslea trispora using oxygen-vectors and surface active agents[J]. Microbiology China, 2006, 33(1): 90-93 (in Chinese)朱艳, 袁其朋, 王航. 添加氧载体及表面活性剂对番茄红素发酵的影响[J]. 微生物学通报, 2006, 33(1): 90-93