1. 蒽环类药物发展历史
蒽环类药物,1950年由H·Brockmann所命名,通常指的是蒽环类抗肿瘤抗生素,又叫做蒽环糖苷类抗生素。其结构通常由蒽环结构和糖苷两部分组成,以阿霉素、表阿霉素和吡喃阿霉素为例,基本结构为蒽环与一个氨基糖以糖苷键相连。
1963年,柔红霉素首先被合成,立即被应用于血液系统恶性肿瘤等疾病的治疗,至今仍发挥重要作用。1968年,多柔比星问世,其同时具有抑制RNA与DNA合成作用,对RNA的抑制作用最强,抗瘤谱最广,对各种生长周期的肿瘤细胞均有效。吡柔比星、表柔比星与多柔比星相比,其疗效相当,心脏毒性更低,获得广泛应用;而脂质体ADM的问世,使心脏毒性进一步降低,同时具有某些肿瘤靶向性的特点。
目前,临床上常用的蒽环类药物有柔红霉素、多柔比星、吡柔比星、伊达比星、戊柔比星以及米托蒽醌等;广泛地用于治疗血液系统恶性肿瘤和实体肿瘤,包括急性白血病、淋巴瘤、乳腺癌、卵巢癌、胃癌及软组织肉瘤等;其不良反应主要表现为心脏毒性、骨髓抑制、胃肠道反应、脱发等。

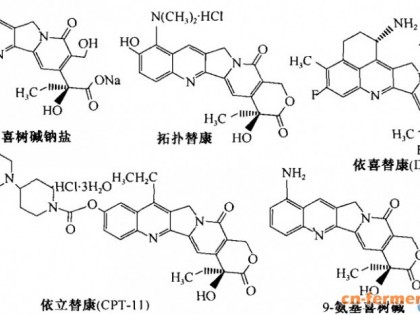
(部分蒽环类药物结构)
2. 蒽环类药物~国内相关指南
蒽环类药物,自上市至今已积累很多临床数据,故而国内外对该类药物所制定的指南也相对较多。在我国,不仅对其进行了分类治疗指南,甚至对这类结构所产生的非常明确的不良反应(如严重的心脏毒),也制定了相关指南。国内指南包括(但不限于)以下;
《中国蒽环类药物治疗恶性肿瘤专家共识》
《中国蒽环类药物治疗淋巴瘤专家共识》
《中国蒽环类药物治疗白血病专家共识》
《中国蒽环类药物治疗乳腺癌专家共识》
《中国蒽环类药物治疗泌尿系统恶性肿瘤专家共识》
《中国蒽环类药物特性专家共识》
《中国蒽环类药物应用心脏毒性处理专家共识》
3. 蒽环类药物~显著的不良反应
临床数据证实,蒽环类药物的不良反应主要表现为心脏毒性、骨髓抑制、胃肠道反应等。在今天,任何一个药物的上市,心脏毒性问题是必不可少的研究项目,而心脏毒问题也恰好是蒽环类药物的重要软肋之一,这也正是笔者总结这类药物结构的缘由所在。
心脏毒性
蒽环类药物导致的心脏毒性,按照出现的时间可以分为急性、慢性和迟发性。急性心脏毒性在给药后的几小时或几天内发生,常表现为心脏传导紊乱和心律失常,极少数病例表现为心包炎和急性左心衰。慢性心脏毒性在用药后1年内发生,表现为左心室功能障碍,最终可导致心衰。迟发性心脏毒性在用药后数年发生,可表现为心衰、心肌病及心律失常等。多数患者在蒽环类药物给药后可较快地发生心肌损伤,且随着时间的延长愈加明显。在给予蒽环类药物数年后,超过50%患者可发生左心室亚临床超声变化,如后负荷增加或收缩能力下降。蒽环类药物的慢性和迟发性心脏毒性与其累积剂量呈正相关。

骨髓抑制
蒽环类药物另一个常见的不良反应,为骨髓抑制,当前可通过给予重组人粒细胞集落刺激因子、重组人粒细胞-巨噬细胞集落刺激因子、促血小板生成素和成分输血等治疗来解决。患者中性粒细胞低于1.0×109/L时应给予rhG-CSF,血小板数低于20×109/L时需静脉输注血小板,也可使用TPO等促进血小板恢复。在使用rhG-CSF、rhGM-CSF时应在化疗结束后24~48h开始使用,不在化疗前或化疗过程中使用。
4. 从作用机制来理解不良反应
蒽环类药物不良反应是如何产生的呢?这要看它的作用机制。最主要的为:蒽环类药物嵌入DNA分子,非特异性插入相邻碱基对之间,与核糖-磷酸骨架结合,导致DNA分子局部解螺旋,并可干扰拓扑异构酶Ⅱ重新连接断裂的DNA双链,从而阻碍DNA复制、转录和RNA合成过程。
总的来说,蒽环类药物作用机制有如下推断:1)嵌入DNA碱基对之间,干扰DNA转录、信使核糖核酸(mRNA)合成;2)促使拓扑异构酶Ⅱ裂解DNA,破坏其3级结构;3)抑制DNA多聚酶Ⅰ,抑制DNA合成;4)产生氧自由基,破坏细胞膜功能,这与心脏毒性相关;5)主要由多药耐药基因(MDR1)介导耐药,部分药物之间有不完全交叉耐药;6)抑制RNA合成所需浓度仅为抑制DNA合成浓度的1/10~1/6。
5. 多种假说~进一步支撑不良反应诱因
氧自由基损伤学说
在还原型辅酶I脱氢酶和多种还原酶的作用下,蒽环类药物的蒽醌基团被还原成半醌自由基,完成电子传递过程后生成超氧阴离子和羟自由基,导致线粒体及微粒体脂质过氧化,损伤心肌细胞。同时,蒽环类药物降低心肌细胞中抗氧化酶系如超氧化物歧化酶和谷胱甘肽过氧化物酶的含量,使自由基、超氧化物不能被及时清除,加重心肌细胞的损伤。
铁离子代谢紊乱学说
铁调节蛋白与铁效应元件的结合发生改变,可能也是蒽环类药物心脏毒性的一个重要机制。蒽环类药物进入体内,一方面,引起氧化反应,激活铁调节蛋白,使转铁蛋白受体的表达增加,细胞内铁沉积增加;另一方面,与铁形成复合物,这种复合物不仅催化电子从巯基转移给氧,形成活性氧,而且与心脏磷脂的亲和力很高,结合后导致多种细胞器膜功能的损伤从而产生心脏毒性。
钙超载及代谢学说
蒽环类药物进入体内,一方面,可激活肌浆网上的Ca2+通道,使胞浆内Ca2+增加,此过程称为心肌细胞钙超载。钙超载通过影响心肌的电活动从而诱发心律失常;另一方面,可抑制肌浆网膜上的钙泵,使肌浆网摄取Ca2+能力下降,三磷酸腺苷(ATP)合成障碍导致心脏毒性。
细胞凋亡学说
蒽环类药物可直接激活转录因子,上调肿瘤细胞Fas基因的表达、下调Bcl-2基因表达,增强p53蛋白表达启动细胞凋亡程序,使得心肌细胞内铁和过氧化氢进一步沉积,最终导致心力衰竭。

(举例:多柔比星毒性的分子机制)
小 结
从不良反应来看,细胞毒类药物存在的不良反应较为严重,是很正常的事情,但很难避免,因此,这也成为靶向药物的快速发展的驱动因素之一。
从药物的临床状态来说,目前许多化疗方案中均含有蒽环类药物,当前循证医学还不足以支持在相关化疗方案中“去蒽环”,故当前该类药物的临床价值还很重要。
从药物结构设计来说,相信该类结构是许多同行非常熟悉的改造对象,一般而言,研究方向应该是肿瘤;但许多在研方向不是肿瘤的小伙伴就要注意了,当你设计一类药物,且随着活性的筛选将要碰触到蒽环类结构时,就要多加考虑安全性问题了!当然,这也并不意味着这类结构就不能碰!
参考:
1.Molecular mechanism of doxorubicin-induced cardiomyopathy – An update.2018
2.Deciphering the molecular mechanism during doxorubicin-mediated oxidative stress, apoptosis through Nrf2 and PGC-1α in a rat testicular milieu.2019
3. Role of Endothelium in Doxorubicin-Induced Cardiomyopathy.2018
4. Doxorubicin induced heart failure:Phenotype and molecular mechanisms.2018
5. 国内相关指南
6. 药渡数据
7. CNKI