2 Beijing Key Laboratory of Nutrition, Health and Food Safety, Beijing 102209, China;
3 Beijing Engineering Laboratory for Geriatric Nutrition Food Research, Beijing 102209, China;
4 Jilin COFCO Biochemistry Co., Ltd. (National Engineering Research Center of Corn Deep Processing), Changchun 130033, Jilin, China
随着城市化进程加快、环境污染日益严重、人们生活方式的改变及人口老龄化,肥胖、糖尿病等慢性代谢性疾病的发病率在全球范围急剧上升。2016年Lancet上发布的相关研究成果称,我国已经超越美国成为全球肥胖人口最多的国家[1]。肥胖症既是一个独立的疾病,又是2型糖尿病、心血管病、脑卒中和多种癌症等慢性病的危险因素,被世界卫生组织列为导致疾病负担的十大危险因素之一。同时,国际糖尿病联合会(IDF)发布,世界范围内糖尿病成年患者大约有4.15亿名,而我国的糖尿病患者最多,约1.1亿(占中国成年人的11.6%),糖尿病前期人群为4.934亿(50.1%)。2017年Lancet Diabetes & Endocrinology发布数据显示[2],2015年由于糖尿病造成全球经济损失达1.31万亿美元,占全球GDP的1.8%;其中,间接经济损失占所有损失的34.7%。2015年,中国糖尿病相关的医疗花费总计510亿美元,居全世界第二位,仅次于美国。糖尿病、超重/肥胖等代谢性疾病已经成为全球性危机,而过多食用糖类、造成能量过剩成为引起肥胖和糖尿病的一个重要原因。因此,新型低热量甜味剂逐渐成为食品、保健和医疗领域的研究热点之一。
D-阿洛酮糖(D-psicose)是近年发现的一种具有特殊保健功能的新型功能性单糖,其甜度相当于蔗糖的70%,热量相当于蔗糖的0.3%[3],具有与蔗糖相近的口感及容积特性,同样可与食物中的氨基酸或蛋白质发生美拉德反应[4],可作为食品中蔗糖理想的替代品[5]。2011年8月,美国食品与药物管理局(FDA)确定D-阿洛酮糖为普遍公认安全食品(Generally regarded as safe,GRAS),并可作为食品或食品添加剂的组成成分[6]。D-阿洛酮糖作为D-果糖的差向异构体,可通过微生物来源的酮糖3-差向异构酶催化D-果糖C-3差向异构化获得。因此,酮糖3-差向异构酶是D-阿洛酮糖生物合成过程中的关键因素。
随着越来越多微生物基因组数据的公布,为基于酮糖3-差向异构酶基因高效筛选D-阿洛酮糖产生菌提供了可能,因此越来越多不同种属来源的D-阿洛酮糖产生菌被报道。然而,多数酮糖3-差向异构酶在最适反应条件下半衰期较短,同时目前已报道的最高转化率仅为33%。本文系统总结了D-阿洛酮糖的主要生理功能,旨在阐释其广泛的应用前景,同时重点综述了D-阿洛酮糖的生物合成及其合成酶的晶体结构,为提高酮糖3-差向异构酶的热稳定性和转化率提供指导,从而满足工业化生产的需求。
1 D-阿洛酮糖的主要生理功能Tsukamoto等[7]发现,采用大鼠静脉注射14C标记的D-阿洛酮糖在肝脏、肾脏和膀胱中可检测到较高水平,然后很快通过尿液排出体外,而大脑中没有检测到D-阿洛酮糖的积累。口服的D-阿洛酮糖由小肠吸收进入血液,然后约70%通过尿液排出[7],大鼠[8]或人体[9]中小部分未被吸收的D-阿洛酮糖会被传输到大肠,最终在盲肠中部分发酵。研究显示,相对于高果糖浆具有引发肥胖和糖尿病的风险,D-阿洛酮糖具有控制肥胖和糖尿病的功效[10-11]。
1.1 D-阿洛酮糖对脂代谢的影响Hossain等[12-13]在自发的2型糖尿病OLETF (Otsuka Long-Evans Tokushima Fatty)大鼠的饮水中添加5%的阿洛酮糖,喂养13周后发现大鼠腹部脂肪和身体脂肪重量明显比对照组降低,且脂肪细胞小于对照组。在高脂饮食诱导的肥胖大鼠的正常饮食中添加不同剂量的D-阿洛酮糖,发现体重和体内脂肪积累的量与对照组相比均有降低,并且降低程度对阿洛酮糖呈现剂量依赖关系[14]。给大鼠喂食3%阿洛酮糖4周,发现D-阿洛酮糖组大鼠有明显较低的血清胰岛素和瘦素水平,肝脏中脂肪合成酶的活性降低,而脂肪氧化酶表达水平上升,推测D-阿洛酮糖能够降低脂肪积累是通过抑制脂肪合成和提高脂肪分解速度实现的[15]。糖尿病模型小鼠经12周5% D-阿洛酮糖喂食实验,与蔗糖组相比,小鼠体重、脂肪增量均显著降低,基因分析显示与脂肪合成相关的PPAR-7、C/EBPα基因表达量下降,与炎症反应相关的TNF-α及IL-6基因表达量也出现下降[16]。Han等[17]的研究发现,5%的饮食D-阿洛酮糖能通过降低小肠中脂调控相关基因表达,下调肝脏中脂肪酸合酶和β-氧化的活性,降低血浆及肝脏脂质含量提高粪脂,最终使食源性肥胖的代谢状态正常化。Kimura等[18]在健康人群中进行的实验发现,餐前摄入少量D-阿洛酮糖(5 g)可起到增强餐后脂肪氧化和降低碳水化合物氧化的效果。因此,阿洛酮糖被认为具有抵抗肥胖的潜力。
1.2 D-阿洛酮糖对血糖代谢的影响多项研究表明,D-阿洛酮糖具有降血糖的功效[19-20]。雄性大鼠喂食蔗糖、麦芽糖或可溶性淀粉,同时按千分之一添加D-阿洛酮糖或D-果糖,结果发现阿洛酮糖能抑制血浆中的葡萄糖浓度;在大鼠实验中发现,阿洛酮糖口服后会经过小肠吸收进入血液,然后由肾脏排出,不会引起血糖波动,还能够抑制α-葡萄糖苷酶的活性[20]。以健康人群为受试对象,食用5 g阿洛酮糖可显著抑制摄入75 g麦芽糊精后导致的血糖上升,同时单独摄入5 g阿洛酮糖对血糖和胰岛素水平没有影响,说明阿洛酮糖不会诱发低血糖[19]。从预防糖尿病的角度出发,以边缘性糖尿病病人为对象,同样发现阿洛酮糖对餐后血糖有明显的抑制效果,并且没有副作用[21]。Hossain等[22]开展的人群试验同样证明,阿洛酮糖能降低正常人和边缘糖尿病人的餐后血糖水平,并且具有剂量依赖性。
1.3 D-阿洛酮糖抗糖尿病的机理Hossain等[10]开展的OLETF大鼠实验显示,阿洛酮糖组餐后血糖、体重和脂肪得到有效控制,免疫组化结果表明,阿洛酮糖可诱导肝葡糖激酶表达,从而提高肝糖原合成。进一步研究发现,阿洛酮糖可减缓β胰岛细胞的纤维化[13]。将实验时间延长至60周,结果发现D-阿洛酮糖的抗2型糖尿病效果主要是通过维持血糖水平、降低体重增长、控制餐后血糖、减少炎症反应、降低糖化血红蛋白水平实现的[10]。Shintani等[11]用Wistar大鼠进行连续10周喂食实验,结果显示,在30–90 min间阿洛酮糖组胰岛素水平明显较低;在90–180 min之间阿洛酮糖组的血糖水平显著降低,阿洛酮糖组的肝糖原水平3倍于对照组,并且肝葡糖激酶核输出显著增加,说明阿洛酮糖可以通过增强葡糖激酶的核输出维持机体正常葡萄糖耐量和胰岛素敏感性。另外,D-阿洛酮糖通过清除活性氧自由基而表现较高的抗氧化作用[23],从而降低胰岛β细胞的氧化损伤。近期,日本Iwasaki等[24]的研究团队在健康小鼠和肥胖糖尿病模型小鼠中的实验发现,服用D-阿洛酮糖能够促进GLP-1的释放并通过GLP-1受体信号影响迷走传入神经,起到抑制食量和高血糖症的效果,并且效果与摄入的时间有关。
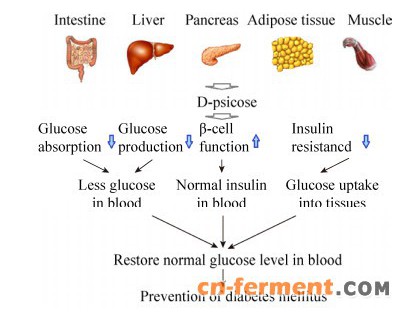
研究显示,D-阿洛酮糖可以通过多种途径预防肥胖和2型糖尿病(图 1)[22]。由肥胖导致的2型糖尿病机体内,脂肪组织增大伴随着炎症巨噬细胞的浸润,随之释放巨噬细胞和脂肪细胞中的炎性细胞因子。此外,在高血糖状态下,胰腺β细胞被迫产生更多的胰岛素来抑制血糖升高,从而导致胰岛肥大进而发展成β细胞损伤以及随后的葡萄糖不耐受和2型糖尿病,同时,肝脏的葡萄糖输出量增加,而脂肪组织和骨骼肌的葡萄糖利用率降低。而D-阿洛酮糖可以抑制脂肪合成和炎症反应相关基因的表达,保护胰岛细胞免受高血糖引起的损伤,促使胰岛素正常分泌,维持血液中正常的胰岛素水平,降低肠道对葡萄糖的吸收,并且增加脂肪和肌肉组织对葡萄糖的摄取,从而实现控制体重和预防糖尿病的作用。
 |
| 图 1 D-阿洛酮糖抗糖尿病和抗肥胖作用示意图[22] Figure 1 Anti-diabetes and anti-obesity actions of D-psicose[22]. |
|
图选项
|
化学法制备D-阿洛酮糖由于产物纯化步骤繁复、化学污染严重和副产物杂多等原因,尚未取得突破性进展。1990年,日本香川大学(Kagawa University) Izumori团队发现,产碱杆菌属细菌A1caligenes sp.可以生产D-阿洛酮糖,开辟了生物法制备D-阿洛酮糖的先河[25]。生物转化方法因反应单一、纯化步骤简单等优点,逐渐成为生产D-阿洛酮糖的主要策略。其中,酮糖3-差向异构酶作为D-阿洛酮糖生物转化的重要催化剂,可催化D-果糖与D-阿洛酮糖(图 2)及D-塔格糖与D-山梨糖之间的相互转化。不同微生物来源的异构酶具有不同的底物特异性,主要分为:D-塔格糖3-差向异构酶(D-tagatose 3-epimerase,DTEase)和D-阿洛酮糖3-差向异构酶(D-psicose 3-epimerase,DPEase)。表 1总结了不同菌株来源酮糖3-差向异构酶的反应情况。
 |
| 图 2 酶催化D-果糖与D-阿洛酮糖间的转化 Figure 2 Enzymatic conversion between D-fructose and D-psicose. |
|
图选项
|
| DTEase family | Strain of enzyme source | Optimal pH | Optimal temperature (℃) | metal ion | D-Psicose/D-fructose equilibrium ratio | Half-life | Reference |
| DPE | C. cellulolyticum | 8.0 | 55 | Co2+ | 32:68 (55 ℃) | 9.5 h (55 ℃) | [34] |
| C. bolteae | 7.0 | 55 | Co2+ | 31:69 (55 ℃) | 2.6 h (55 ℃) | [36] | |
| Ruminococcus sp. | 7.5–8.0 | 60 | – | 28:72 (60 ℃) | 1.6 h (60 ℃) | [36] | |
| A. tumefaciens | 8.0 | 50 | Mn2+ | 32:68 (30 ℃) | 63.5 min (50 ℃) | [31] | |
| Desmospora sp. | 7.5 | 60 | Co2+ | 30:70 (60 ℃) | 2 h (50 ℃) | [40] | |
| T. primitia | 8.0 | 70 | Co2+ | 28:72 (70 ℃) | 50 ℃, 7% after 4 h | [41] | |
| Burkholderia sp. | 5.0–9.0 | 65 | Co2+ | 30:70 (60 ℃) | Not reported | [42] | |
| F. plautii | 7.0 | 65 | Mn2+, Co2+, Ni2+ | 33: 67 (60 ℃, 18 h) | >4.2 h (55 ℃) | [43] | |
| DTE | P. cichorii | 7.5 | 60 | Mn2+ | 20:80 (30 ℃) | 1 h (50 ℃) | [26] |
| R. sphaeroides | 9.0 | 40 | – | 23:77 (40 ℃) | Not reported | [28] | |
| C. scindens | 7.5 | 60 | Mn2+ | 28:72 (50 ℃) | 1.8 h (50 ℃) | [29] | |
| A. globiformis | 7.0–8.0 | 70 | Mg2+ | 24:76 (30 ℃) 27:73 (70 ℃) |
Immobilized DTE 136 d | [30] |
Izumori团队首次报道了菊芋假单胞菌Pseudomonas cichorii来源的DTEase,并将其生物合成基因克隆到大肠杆菌Escherichia coli JMl09中表达[26]。通过工艺优化(以chitopearl beads为载体),结合离子交换,可使酶的结合效率达到90%,装柱后在pH 7.0,温度45 ℃条件下,以60%的D-果糖为底物,转化率可达25%[27]。类球红菌Rhodobacter sphaeroides SK011来源的DTEase以D-果糖为底物,最终比活性为13.4 U/mg,其最适反应条件为pH 9.0,温度40 ℃,不需要金属离子,相反,添加Zn2+或Cu2+会显著降低其活性[28]。Zhang等[29]将闪烁梭菌Clostridium scindens ATCC 35704来源的DTEase基因克隆转入E. coli BL2 (DE3)中,得到的重组酶在pH 7.5和60 ℃条件下,D-阿洛酮糖转化率为28%。Yoshihara等[30]发现球形节杆菌Arthrobacter globiformis M30,作为GRAS菌株,能够表达催化D-果糖和D-阿洛酮糖转化的C-3差向异构酶,其耐热性较高,最适温度为70 ℃。
2.2 D-阿洛酮糖3-差向异构酶2006年,韩国世宗大学Oh团队从根癌农杆菌Agrobacterium tumefaciens中得到的DTEase对D-阿洛酮糖具有较强的特异性,因此被命名为DPEase。利用大肠杆菌表达该dpe基因,以700 g/L D-果糖为底物,在50 ℃、pH 8.0、添加Mn2+的条件下反应100 min后,D-阿洛酮糖浓度达到230 g/L,转化效率为32.9%[31]。2011年该团队利用易错PCR技术构建了DPEase的双突变株(I33L-S213C),其在50 ℃条件下的半衰期提高了29.9倍[32]。2016年,Park等[33]利用该突变株的重组大肠杆菌,采用60 ℃和pH 8.5的反应条件,利用4 g/L细胞浓度,在40 min后可将700 g/L D-果糖转化为230 g/L的D-阿洛酮糖,转化率为33% (W/W),生产速率为345 g/(L·h),比生产率为86.2 g/(g·h),这是目前为止报道的最高转化率及生产率。
Mu等[34]从解纤维梭菌Clostridium cellulolyticum H10 (ATCC 35319)中克隆得到的木糖异构酶结构域TIM barrel蛋白编码基因可在大肠杆菌体内表达。经镍亲合层析纯化和酶活检测证明该酶具有DPEase活性,且其最适温度为55 ℃,最适pH为8.0,反应转化率最高可达32%。此外,该酶在60 ℃高温条件下,加入Co2+后半衰期可达6.8 h。Li等[35]将解纤维梭菌H10来源的DPEase基因克隆至枯草芽胞杆菌Bcillus subtilis WB600,结果显示该重组蛋白具有可溶性、高活性并可高效表达,其最适温度为50 ℃,酶活反应同样不依赖金属离子(转化率为27.61%±0.53%)。无金属离子的情况下,35 ℃时该酶非常稳定,但在50 ℃处理30 min,其活性降低50%;额外添加1 mmol/L Co2+,50 ℃条件下半衰期延长至265 min。因此,说明Co2+对于催化反应是非必需的,但可提高DPEase的热稳定性。
瘤胃球菌Ruminococcus sp.来源的DPEase基因结合芽孢杆菌来源的D-葡萄糖异构酶(BGI)基因,在大肠杆菌Escherichia coli BL21内成功构建了共表达体系,完成了从D-葡萄糖转化形成D-阿洛酮糖的一步法双酶偶联反应。结果表明,BGI和DPE共表达体系在65 ℃、pH 7.0以及Mg2+存在的条件下,以高果糖浆(High-fructose corn syrup,HFCS)为底物,反应达到平衡时,HFCS中的葡萄糖、果糖和D-阿洛酮糖的摩尔比为3.0:2.7:1.0,D-阿洛酮糖的产量为135 g/L,占总糖浆的15%[36]。随后,该研究团队以谷氨酸棒状杆菌为底盘,设计并构建重组途径,利用甘油和葡萄糖为底物,合成山梨糖、阿洛酮糖以及蒜糖醇等稀少糖[37-38]。Li等[39]将瘤胃菌来源的DPEase基因转入食品级宿主短小芽胞杆菌B. pumilus,并实现该酶的高效表达,其比活性为58.6 U/mL,高于大肠杆菌体内的表达效果。同时采用固定化酶、模拟移动床分离技术以及结晶,获得纯度99.1%的D-阿洛酮糖。
其他菌株如Desmospora sp. 8437[40]、鲍氏梭菌Clostridium bolteae ATCC BAA-613[36]、密螺旋体属细菌Treponema primitia ZAS-1[41]、伯克霍尔德氏菌Burkholderia sp. MR1[42]和普氏梭杆菌Flavonifractor plautii[43]均被报道具有DPEase活性。Jia等[36]对鲍氏梭菌ATCC BAA-613进行全细胞反应,确定该菌株具有催化D-果糖差向异构生成D-阿洛酮糖的能力,同时将DPEase基因转入枯草芽孢杆菌WB800中表达,无需外源添加诱导剂即可产生DPEase。当反应进行18 h时,酶活可达6.8 U/mL,其最适pH为7.0,最适温度为55 ℃。Zhang等[40]利用Desmospora sp.来源的DPEase,以500 g/L的D-果糖为底物,可获得142.5 g/L的D-阿洛酮糖。Treponema primitia来源的DPEase在最适条件(pH 8.0,70 ℃)下,利用同样的底物浓度(500 g/L),D-阿洛酮糖的产量为137.5 g/L[41]。
2.3 其他酮糖3-差向异构酶2007年,Oh研究团队从土壤中筛选得到一株可转化D-果糖生产D-阿洛酮糖的根瘤属细菌Sinorhizobium,发现其细胞粗提物在催化反应中显示出不同于DTEase和DPEase的性质,推测使D-果糖发生差向异构反应产生D-阿洛酮糖的酶可能是酮糖3-差向异构酶家族的新成员。利用该根瘤菌渗透化细胞,在pH为8.5、温度为40 ℃以及60 mg/mL的细胞浓度下全细胞转化15 h后,D-果糖的转化率为70%[44]。近年来,测序技术的快速发展为DTEase同系物的快速筛选奠定了基础,特别是为筛选热稳定性强的异构酶提供了指导。热稳定性酶参与机体碳源代谢,能够很好地应用于工业化生产[45]。Sakuraba等[46]筛选得到极端嗜热菌海栖热袍菌Thermotoga maritima来源的D-塔格糖3-差向异构酶相关的蛋白(TM0416p),其单体的主体结构与菊芋假单胞菌来源的DTEase和根癌农杆菌来源的DTEase具有一定的相似性,但表现特殊的溶剂和底物结合区域,从而缺乏一个可覆盖活性位点间隙的α-螺旋。另外,围绕底物营造疏水环境的残基与上述两个酶也完全不同。因此,推测TM0416p和其他酮糖3-差向异构酶具有本质的区别。
除此之外,专利中也报道一些可将果糖转化为D-阿洛酮糖的3-差向异构酶。例如,安信惠等[47]公布了一种使用粘着剑菌Ensifer adhaerens菌株SYG29生产D-阿洛酮糖的方法。利用该细胞、细胞培养物或细胞裂解物,其最适pH为7.0–9.0,在60 ℃条件下细胞细胞活性半衰期为7.6 h,添加Mn2+和Co2+转化活性相对较高。在70 ℃反应6 h后,最大D-阿洛酮糖的转化率约为26%。
3 酮糖3-差向异构酶的晶体结构目前已知晶体结构的具有将果糖转化成阿洛酮糖功能的差向异构酶有3种,分别是来源于根癌农杆菌的D-阿洛酮糖3-差向异构酶(AtDPEase)[48]、来源于解纤维梭菌的D-阿洛酮糖3-差向异构酶CCH10DPEase[49]以及菊芋假单胞菌的D-塔格糖3-差向异构酶(PcDTEase)[50]。本文结合3个酶的结构,对其序列、整体结构、活性中心、底物结合、催化机理及底物选择性等方面进行了比较和分析。
3.1 序列分析多重序列比对结果表明,AtDPEase、CCH10DPEase和PcDTEase具有高度的序列一致性(图 3),其中AtDPEase与CCH10DPEase和PcDTEase的序列一致性分别为61%和40%,活性位点残基(包括金属结合位点和底物结合位点)高度保守。
 |
| 图 3 CCH10DPEase、PcDTEase和AtDPEase的多重序列比对结果 Figure 3 Multiple sequence alignment of AtDPEase, CCH10DPEase and PcDTEase. The residues in red enclosed in a blut box are highly conserved and those with a red background are identical. Sequence numbering is based on AtDPEase, and its secondary structure elements are shown for their corresponding sequences. The filled triangles, open lozenges and filled circles represent the residues involved in the dimeric interface, the tetrameric interface and metal binding, respectively. The sequences of AtDPEase, CCH10DPEase and PcDTEase were downloaded from NCBI database and their GenBank numbers were AAK88700.1, B8I944.1 and BAA24429.1, respectively. Alignments were implemented by ESPript 3.0[51]. |
|
图选项
|
如图 4A所示,AtDPEase、CCH10DPEase和PcDTEase在溶液中都是以不对称的四聚体形式存在。AtDPEase与CCH10DPEase的单体和二聚体的聚合方式相似,而PcDTEase与这两个酶不同,两个二聚体之间形成一个15°的夹角,使得PcDTEase内二聚体的相互作用区域变大,而这个大的内亚基相互作用区域使得PcDTEase的结构比AtDPEase和CCH10DPEase更稳定,导致PcDTEase的热稳定性更高。因此,PcDTEase的最适反应温度为60 ℃,而AtDPEase和CCH10DPEase的最适反应温度分别为50 ℃和55 ℃。
 |
| 图 4 CCH10DPEase、PcDTEase和AtDPEase的晶体结构 Figure 4 Structures of CCH10DPEase, PcDTEase and AtDPEase. (A) Stereoscopic view of the overall structure of CCH10DPEase, PcDTEase and AtDPEase. (B) The residues at the interface between MolA and MolD are shown as stick in green and yellow, respectively[49]. (C) Subunit TIM-barrel fold of CCH10DPEase, PcDTEase and AtDPEase. α-Helices numbered from α1 to α8 and β-strands numbered from β1 to β8 are indicated by blue and purple, respectively. Mn2+ is shown in a blue sphere. The structure of AtDPEase, CCH10DPEase and PcDTEase were downloaded from PDB database and their PDB numbers were 2hk0, 2ou4 and 3vni, respectively. Crystal structure was visualized by PyMol[48]. |
|
图选项
|
图 4B显示了CCH10DPEase的亚基A (绿色)和亚基D (黄色)之间形成的二聚体界面,其中形成主要相互作用的有11个氨基酸残基(Y116、K122、R154、N188、E190、D192、N214、K216、R222、W260和R261),这些残基能够在两个亚基之间形成直接的氢键作用,共形成了34个氢键。如图 3所示,这些氨基酸残基在3个酶中也高度保守。
如图 4C所示,CCH10DPEase和PcDTEase的每个亚基都是由11个α螺旋和8个β折叠形成一个(β/α)8的TIM-桶结构;而AtDPEase的亚基是由12个α螺旋和8个β折叠形成一个(β/α)8的TIM-桶结构。此外,结构显示,CCH10DPEase、PcDTEase和AtDPEase的活性中心都含有一个金属离子。
3.3 金属结合位点比较三种酶在催化过程中都需要金属离子,金属离子在酶中以扭曲的八面体形式存在,通过6个配位键与酶形成相互作用。金属离子与4个保守的氨基酸残基(E150、D183、H209和E244)和2个水分子形成相互作用(图 3和图 5)。
 |
| 图 5 CCH10DPEase、PcDTEase和AtDPEase的金属结合位点结构 Figure 5 Stereoscopic view of the metal-binding site of CCH10DPEase, PcDTEase and AtDPEase. The ions are shown as blue spheres and the water molecules red. Selected interactions among amino acid residues, ions and water molecules are indicated by dashed lines. Crystal structure was visualized by PyMol[48]. |
|
图选项
|
CCH10DPEase、PcDTEase和AtDPEase与底物D-果糖的复合物结构叠加图见图 6。D-果糖O1、O2和O3与3种酶的相互作用很相似,在4、5和6位发现明显的差异。由于电子云密度较弱,虽然很难比较这3个位点分子构象的细节变化,但是仍然能够比较出底物的位置。CCH10DPEase与AtDPEase类似,在这两个酶中,D-果糖的O6与主链Ile66和Ala107形成氢键。在PcDTEase中,D-果糖相对于其他两个酶的构象,围绕C2发生逆时针20°的旋转,并且位于疏水口袋的中心,与Cys66形成氢键作用。在PcDTEase中,D-果糖避免了与Leu108 (CCH10DPEase与AtDPEase中的Ala107)形成短相互作用,并且在Leu108的反向,CCH10DPEase与AtDPEase的Tyr6伸向结合在活性口袋中的底物。因此,PcDTEase与CCH10DPEase和AtDPEase疏水口袋的形状和疏水性不同,分别是Phe7/Tyr6、Cys66/Gly65和Leu108/Ala107。因此,PcDTEase与CCH10DPEase和AtDPEase具有不同的底物特异性和亲和性。
 |
| 图 6 CCH10DPEase、PcDTEase和AtDPEase与D-果糖复合物的结构叠加图[48] Figure 6 Stereoscopic view of the superimposed D-fructose-binding structure of PcDTEase (yellow and yellow labels), CCH10DPEase (pink and pink labels) and AtDPEase (green and green labels). The structure of AtDPEase, CCH10DPEase and PcDTEase with D-fructose were downloaded from PDB database and their PDB numbers were 2hk1, 2qun and 3vnk, respectively. Crystal structure was visualized by PyMol[48]. |
|
图选项
|
基于晶体结构及序列比对的结果,3种酶具有相似的催化机制。Chan等[49]推测CCH10DPEase催化机制如图 7所示:首先,其中一个Glu残基(E150和E244)与Mn离子结合,然后移除C3的质子,产生一个cis-enediolate中间体,最后另外一个Glu残基从相反方向将C3重新质子化,完成两者之间的转化。综上,通过对酮糖3-差向异构酶结构的解析,为基于蛋白质工程技术,提高酶的活性及D-果糖生成D-阿洛酮糖的转化效率提供重要理论依据。
 |
| 图 7 推测的阿洛酮糖差向异构酶的催化机制[49] Figure 7 The presumed catalytic mechanism of DPEase[49]. |
|
图选项
|
动物实验显示,绝大多数D-阿洛酮糖不被机体吸收,但可通过多种途径介导机体的脂代谢、血糖代谢以及抗氧化作用,从而减少体内脂肪沉积,降低血糖水平[7, 10-20]。然而被机体吸收的D-阿洛酮糖在肠道内的代谢方式,以及D-阿洛酮糖对人体各项机能的影响还有待进一步研究。随着对下游D-阿洛酮糖应用研究的逐渐深入,上游D-阿洛酮糖的高效生物合成也一直是研究者的目标。国内关于D-阿洛酮糖的研究工作起步较晚,主要进行了菌种筛选、酶基因克隆和酶的固定化研究等。由于酶的高度选择性、特异性以及反应温和和环境友好等特点,使得生物催化方法较化学合成方法制备D-阿洛酮糖具有较明显的优势。针对D-阿洛酮糖的生物合成需解决以下3个方面的关键问题:第一,目前报道的酮糖3-差向异构酶产生菌多不是GRAS,可能存在安全隐患,因此需要将相关的酶转入GRAS宿主并实现高效表达。目前,本实验室利用Huang等[52]建立的枯草芽孢杆菌表达系统,可实现外源DPEase基因的高效表达(未发表)。第二,生物合成过程多涉及两种糖之间差向异构化的化学平衡问题,因而可能会面临产率较低或分离纯化难等问题。鉴于此,可采用双酶偶联或工艺改善等手段,提高生产效率和效益。第三,现有的差向异构酶在最适反应条件下热稳定性较低。可通过在自然界极端环境筛选优良菌株,或结合酮糖3-差向异构酶家族晶体结构的信息,进行基因改造,改善酶的反应活性和热稳定性。王小艳等[53]基于PGUS-P模拟结构分析,采用半理性方法设计并通过定点突变引入新的N-糖基化位点,经毕赤酵母重组表达后得到了系列糖基化突变酶,显示其对底物甘草酸的亲和力和催化效率均得到提高,同时热稳定性也得到显著改善。综上,为满足D-阿洛酮糖的工业化生产需求,采用生物技术与工艺过程优化等多种方式相结合的策略,着力解决上述关键问题。
5 展望随着经济水平的提高,居民的膳食结构发生变化,肥胖、糖尿病、高血糖、高血脂等慢性病在全球范围内大流行[1]。因此,人们在饮食中越来越注重糖分的“健康摄取”,促使低热量甜味剂展示了广阔的应用前景。2011年FDA认可甜味剂D-阿洛酮糖可以作为食品添加剂使用[6]。自此,D-阿洛酮糖得到了迅速发展,国外市场上出现了多种含D-阿洛酮糖的产品。尽管我国对D-阿洛酮糖的研究起步较晚,市场尚未开发,但随着对其生理功能研究和临床试验探索的逐步深入,D-阿洛酮糖将具有更加广泛的市场价值。同时,随着合成生物学、基因工程、代谢工程和测序技术的发展,结合本单位已建立的商品糖生产线,为D-阿洛酮糖的工业生产提供了可能,从而填补国内空白。
| [1] | NCD Risk Factor Collaboration (NCD-RisC). Trends in adult body-mass index in 200 countries from 1975 to 2014: a pooled analysis of 1698 population-based measurement studies with 19·2 million participants. Lancet, 2016, 387(10026): 1377–1396. DOI: 10.1016/S0140-6736(16)30054-X |
| [2] | Bommer C, Heesemann E, Sagalova V, et al. The global economic burden of diabetes in adults aged 20-79 years: a cost-of-illness study. Lancet Diabetes Endocrinol, 2017, 5(6): 423–430. DOI: 10.1016/S2213-8587(17)30097-9 |
| [3] | Matsuo T, Suzuki H, Hashiguchi M, et al. D-psicose is a rare sugar that provides no energy to growing rats. J Nutrit Sci Vitaminol, 2002, 48(1): 77–80. DOI: 10.3177/jnsv.48.77 |
| [4] | Baek SH, Kwon SY, Lee HG, et al. Maillard browning reaction of D-psicose as affected by reaction factors. Food Sci Biotechnol, 2008, 17(6): 1349–1351. |
| [5] | Mu WM, Zhang WL, Feng YH, et al. Recent advances on applications and biotechnological production of D-psicose. Appl Microbiol Biotechnol, 2012, 94(6): 1461–1467. DOI: 10.1007/s00253-012-4093-1 |
| [6] | GRAS Notice Inventory. Agency Response Letter GRAS Notice No. GRN 000400.[2017-10-17]. https://www.fda.gov/Food/IngredientsPackagingLabeling/GRAS/NoticeInventory. |
| [7] | Tsukamoto I, Hossain A, Yamaguchi F, et al. Intestinal absorption, organ distribution, and urinary excretion of the rare sugar D-psicose. Drug Des Devel Ther, 2014, 8: 1955–1964. |
| [8] | Matsuo T, Tanaka T, Hashiguchi M, et al. metabolic effects of D-psicose in rats: studies on faecal and urinary excretion and caecal fermentation. Asia Pac J Clin Nutr, 2003, 12(2): 225–231. |
| [9] | Iida T, Hayashi N, Yamada T, et al. Failure of d-psicose absorbed in the small intestine to metabolize into energy and its low large intestinal fermentability in humans. metabolism, 2010, 59(2): 206–214. DOI: 10.1016/j.metabol.2009.07.018 |
| [10] | Hossain A, Yamaguchi F, Hirose K, et al. Rare sugar D-psicose prevents progression and development of diabetes in T2DM model Otsuka Long-Evans Tokushima Fatty rats. Drug Des Devel Ther, 2015, 9: 525–535. |
| [11] | Shintani T, Yamada T, Hayashi N, et al. Rare sugar syrup containing D-allulose but not high-fructose corn syrup maintains glucose tolerance and insulin sensitivity partly via hepatic glucokinase translocation in wistar rats. J Agric Food Chem, 2017, 65(13): 2888–2894. DOI: 10.1021/acs.jafc.6b05627 |
| [12] | Hossain MA, Kitagaki S, Nakano D, et al. Rare sugar D-psicose improves insulin sensitivity and glucose tolerance in type 2 diabetes Otsuka Long-Evans Tokushima Fatty (OLETF) rats. Biochem Biophys Res Commun, 2011, 405(1): 7–12. DOI: 10.1016/j.bbrc.2010.12.091 |
| [13] | Hossain A, Yamaguchi F, Matsunaga T, et al. Rare sugar D-psicose protects pancreas β-islets and thus improves insulin resistance in OLETF rats. Biochem Biophys Res Commun, 2012, 425(4): 717–723. DOI: 10.1016/j.bbrc.2012.07.135 |
| [14] | Chung YM, Hyun Lee J, Youl Kim D, et al. Dietary D-psicose reduced visceral fat mass in high-fat diet-induced obese rats. J Food Sci, 2012, 77(2): H53–H58. DOI: 10.1111/jfds.2012.77.issue-2 |
| [15] | Nagata Y, Kanasaki A, Tamaru S, et al. D-psicose, an epimer of D-fructose, favorably alters lipid metabolism in Sprague-Dawley rats. J Agric Food Chem, 2015, 63(12): 3168–3176. DOI: 10.1021/jf502535p |
| [16] | Kim SJ, Sung MK, Kim SE, et al. Dietary D-psicose in substitution for sucrose influences adipose tissue metabolism in a mouse model of obesity. FASEB J, 2015, 29(1 Supplement). |
| [17] | Han YJ, Han HJ, Kim AH, et al. D-Allulose supplementation normalized the body weight and fat-pad mass in diet-induced obese mice via the regulation of lipid metabolism under isocaloric fed condition. Mol Nutr Food Res, 2016, 60(7): 1695–1706. DOI: 10.1002/mnfr.v60.7 |
| [18] | Kimura T, Kanasaki A, Hayashi N, et al. D-Allulose enhances postprandial fat oxidation in healthy humans. Nutrition, 2017, 43-44: 16–20. DOI: 10.1016/j.nut.2017.06.007 |
| [19] | Iida T, Kishimoto Y, Yoshikawa Y, et al. Acute D-psicose administration decreases the glycemic responses to an oral maltodextrin tolerance test in normal adults. J Nut Sci Vitaminol, 2008, 54(6): 511–514. DOI: 10.3177/jnsv.54.511 |
| [20] | Matsuo T, Izumori K. D-psicose inhibits intestinal α-glucosidase and suppresses the glycemic response after ingestion of carbohydrates in rats. J Clin Biochem Nutr, 2009, 45(2): 202–206. DOI: 10.3164/jcbn.09-36 |
| [21] | Hayashi N, Iida T, Yamada T, et al. Study on the postprandial blood glucose suppression effect of D-psicose in borderline diabetes and the safety of long-term ingestion by normal human subjects. Biosci Biotechnol Biochem, 2010, 74(3): 510–519. DOI: 10.1271/bbb.90707 |
| [22] | Hossain A, Yamaguchi F, Matsuo T, et al. Rare sugar D-allulose: potential role and therapeutic monitoring in maintaining obesity and type 2 diabetes mellitus. Pharmacol Ther, 2015, 155: 49–59. DOI: 10.1016/j.pharmthera.2015.08.004 |
| [23] | Murata A, Sekiya K, Watanabe Y, et al. A novel inhibitory effect of D-allose on production of reactive oxygen species from neutrophils. J Biosci Bioeng, 2003, 96: 89–91. DOI: 10.1016/S1389-1723(03)90104-6 |
| [24] | Iwasaki Y, Sendo M, Dezaki K, et al. GLP-1 release and vagal afferent activation mediate the beneficial metabolic and chronotherapeutic effects of D-allulose. Nat Commun, 2018, 9: 113. DOI: 10.1038/s41467-017-02488-y |
| [25] | Izumori K, Yamakita M, Tsumura T, et al. Production of D-psicose from D-talitol, D-tagatose or D-galactitol by Alcaligenes sp. 701B. J Ferment Bioeng, 1990, 70(1): 26–29. DOI: 10.1016/0922-338X(90)90025-R |
| [26] | Ishida Y, Kamiya T, Izumori K. Production of D-tagatose 3-epimerase of Pseudomonas cichorii ST-24 using recombinant Escherichia coli. J Ferment Bioeng, 1997, 84(4): 348–350. DOI: 10.1016/S0922-338X(97)89257-4 |
| [27] | Takeshita K, Suga A, Takada G, et al. Mass production of D-psicose from D-fructose by a continuous bioreactor system using immobilized D-tagatose 3-epimerase. J Biosci Bioeng, 2000, 90(4): 453–455. DOI: 10.1016/S1389-1723(01)80018-9 |
| [28] | Zhang LT, Mu WM, Bo J, et al. Characterization of D-tagatose-3-epimerase from Rhodobacter sphaeroides that converts D-fructose into D-psicose. Biotechnol Lett, 2009, 31(6): 857–862. DOI: 10.1007/s10529-009-9942-3 |
| [29] | Zhang WL, Fang D, Xing QC, et al. Characterization of a novel metal-dependent D-psicose 3-epimerase from Clostridium scindens 35704. PLoS ONE, 2013, 8(4): e62987. DOI: 10.1371/journal.pone.0062987 |
| [30] | Yoshihara A, Kozakai T, Shintani T, et al. Purification and characterization of D-allulose 3-epimerase derived from Arthrobacter globiformis M30, a GRAS microorganism. J Biosci Bioeng, 2017, 123(2): 170–176. DOI: 10.1016/j.jbiosc.2016.09.004 |
| [31] | Kim HJ, Hyun EK, Kim YS, et al. Characterization of an Agrobacterium tumefaciens D-psicose 3-epimerase that converts D-fructose to D-psicose. Appl Environ Microbiol, 2006, 72(2): 981–985. DOI: 10.1128/AEM.72.2.981-985.2006 |
| [32] | Choi JG, Ju YH, Yeom SJ, et al. Improvement in the thermostability of D-psicose 3-epimerase from Agrobacterium tumefaciens by random and site-directed mutagenesis. Appl Environ Microbiol, 2011, 77(20): 7316–7320. DOI: 10.1128/AEM.05566-11 |
| [33] | Park CS, Park CS, Shin KC, et al. Production of D-psicose from D-fructose by whole recombinant cells with high-level expression of d-psicose 3-epimerase from Agrobacterium tumefaciens. J Biosci Bioeng, 2016, 121(2): 186–190. DOI: 10.1016/j.jbiosc.2015.06.010 |
| [34] | Mu WM, Chu FF, Xing QC, et al. Cloning, expression, and characterization of a D-psicose 3-epimerase from Clostridium cellulolyticum H10. J Agric Food Chem, 2011, 59(14): 7785–7792. DOI: 10.1021/jf201356q |
| [35] | Li XB, Zhu YM, Zeng Y, et al. Overexpression of D-psicose 3-epimerase from Clostridium cellulolyticum H10 in Bacillus subtilis and its prospect for D-psicose production. Adv J Food Sci Technol, 2013, 5(3): 264–269. DOI: 10.19026/ajfst.5.3255 |
| [36] | Jia M, Mu WM, Zhang T, et al. expression of D-Psicose 3-epimerase in Bacillus subtilis. J Food Sci Biotechnol, 2014, 33(11): 1129–1135. |
| [37] | Yang JG, Li JT, Men Y, et al. Biosynthesis of L-sorbose and L-psicose based on C—C bond formation catalyzed by aldolases in an engineered Corynebacterium glutamicum strain. Appl Environ Microbiol, 2015, 81(13): 4284–4294. DOI: 10.1128/AEM.00208-15 |
| [38] | Yang JG, Zhu YM, Yan M, et al. Pathway construction in Corynebacterium glutamicum and strain engineering to produce rare sugars from glycerol. J Agric Food Chem, 2016, 64(50): 9497–9505. DOI: 10.1021/acs.jafc.6b03423 |
| [39] | Li C, Lin JQ, Guo QQ, et al. D-Psicose 3-epimerase secretory overexpression, immobilization, and D-psicose biotransformation, separation and crystallization. J Chem Technol Biotechnol, 2017, 93(2): 350–357. |
| [40] | Zhang WL, Fang D, Zhang T, et al. Characterization of a metal-dependent D-psicose 3-epimerase from a novel strain, Desmospora sp. 8437. J Agric Food Chem, 2013, 61(47): 11468–11476. DOI: 10.1021/jf4035817 |
| [41] | Zhang WL, Zhang T, Jiang B, et al. Biochemical characterization of a D-psicose 3-epimerase from Treponema primitia ZAS-1 and its application on enzymatic production of D-psicose. J Sci Food Agric, 2016, 96(1): 49–56. DOI: 10.1002/jsfa.7187 |
| [42] | Wu HG, Yu YD, Zhu J, et al. DPE deriving from Burkholderia and application thereof: China, CN106119235A. 2016-11-16 (in Chinese). 吴会广, 余允东, 祝俊, 等.一种来源于伯克霍尔德氏菌的DPE及其应用: 中国, CN106119235A. 2016-11-16. |
| [43] | Kim TG, Kim MS, Kim TY, et al. Psicose epimerase and psicose production method using same: China, CN106164265A. 2016-11-23 (in Chinese). 金泰均, 金玟秀, 金泰龙, 等.阿洛酮糖差向异构酶和使用它生产阿洛酮糖的方法: 中国, CN106164265A. 2016-11-23. |
| [44] | Oh DK, Kim NH, Kim HJ, et al. D-Psicose production from D-fructose using an isolated strain, Sinorhizobium sp. World J Microbiol Biotechnol, 2007, 23(4): 559–563. DOI: 10.1007/s11274-006-9265-7 |
| [45] | Lee DW, Jang HJ, Choe EA, et al. Characterization of a thermostable L-arabinose (D-galactose) isomerase from the hyperthermophilic eubacterium Thermotoga maritima. Appl Environ Microbiol, 2004, 70(3): 1397–1404. DOI: 10.1128/AEM.70.3.1397-1404.2004 |
| [46] | Sakuraba H, Yoneda K, Satomura T, et al. Structure of a D-tagatose 3-epimerase-related protein from the hyperthermophilic bacterium Thermotoga maritima. Acta Cryst, 2009, 65(3): 199–203. |
| [47] | Ahn SH, Kim HJ, Han EJ, et al. Ensifer sp. strain and method for producing psicose using same: China, CN105849261A. 2016-08-10 (in Chinese). 安信惠, 金慧贞, 韩恩珍, 等.剑菌属菌株和使用其生产阿洛酮糖的方法: 中国, CN105849261A. 2016-08-10. |
| [48] | Kim K, Kim HJ, Oh DK, et al. Crystal structure of D-psicose 3-epimerase from Agrobacterium tumefaciens and its complex with true substrate D-fructose: a pivotal role of metal in catalysis, an active site for the non-phosphorylated substrate, and its conformational changes. J Mol Biol, 2006, 361(5): 920–931. DOI: 10.1016/j.jmb.2006.06.069 |
| [49] | Chan HC, Zhu YM, Hu YM, et al. Crystal structures of D-psicose 3-epimerase from Clostridium cellulolyticum H10 and its complex with ketohexose sugars. Protein Cell, 2012, 3(2): 123–131. DOI: 10.1007/s13238-012-2026-5 |
| [50] | Yoshida H, Yamada M, Nishitani T, et al. Crystal structures of D-tagatose 3-epimerase from Pseudomonas cichorii and its complexes with D-tagatose and D-fructose. J Mol Biol, 2007, 374(2): 443–453. DOI: 10.1016/j.jmb.2007.09.033 |
| [51] | Robert X, Gouet P. Deciphering key features in protein structures with the new ENDscript server. Nucleic Acids Res, 2014, 42(Web Server issue): W320–W324. |
| [52] | Huang XL, Li Z, Du CY, et al. Improved expression and characterization of a multidomain xylanase from Thermoanaerobacterium aotearoense SCUT27 in Bacillus subtilis. J Agric Food Chem, 2015, 63(28): 6430–6439. DOI: 10.1021/acs.jafc.5b01259 |
| [53] | Wang XY, Fan YS, Han BJ, et al. Improvement of thermostability of recombinant β-glucuronidase by glycosylation. CIESC J, 2015, 66(9): 3669–3677. (in Chinese). 王小艳, 樊艳爽, 韩蓓佳, 等. 糖基化改造β-葡萄糖醛酸苷酶的热稳定性. 化工学报, 2015, 66(9): 3669-3677. |