ta-name="摘要" style="font-size: medium; text-align: justify; text-indent: 0px; line-height: 1.8em; margin: 0.5em 0em; font-family: SimSun;">ta-name="摘要.标题" style="font-weight: bold !important;">摘 要 氨基葡萄糖(glucosamine,GlcN)是葡萄糖2位碳上的羟基被氨基取代后的氨基单糖。GlcN及其衍生物N-乙酰氨基葡萄糖(GlcNAc)在食品、医药和化妆品领域具有广泛应用。文章综述了生物法生产N-乙酰氨基葡萄糖及其衍生物代谢工程策略的研究进展,并对其潜在问题及应用前景进行了展望。
ta-name="关键词" style="font-size: medium; text-align: justify; text-indent: 0px; line-height: 1.8em; margin: 0.5em 0em; font-family: SimSun;">ta-name="关键词.标题" style="font-weight: bold !important;">关键词 N-乙酰氨基葡萄糖;N-乙酰氨基葡萄糖衍生物;氨基葡萄糖;代谢工程策略;基因工程菌
N-乙酰氨基葡萄糖(N-acetylglucosamine,GlcNAc) 和氨基葡萄糖(glucosamine,GlcN)是重要的功能性单糖,是生物体内多糖透明质酸(hyaluronic acid,HA)、肝素、硫酸角质素等组成的重要单体之一,同时也是母乳寡糖、神经氨酸、壳寡糖合成的前体物质,可以维持生物体正常的生理功能。近年来,GlcNAc广泛应用于食品、医疗保健、化妆品等领域,并且需求量逐年增加,市场应用前景广阔。在欧美等发达国家,GlcNAc作为保健产品的重要组成成分,为人体提供必需的生物活性物质,因而被广泛应用[1]。
GlcNAc存在于细菌、真菌、植物体和动物体中,广泛分布于自然界中,同时也是几丁质和壳聚糖的主要组成成分[2-3]。随着GlcNAc市场需求的日益增加,传统的生产方法面临许多潜在问题[3-4]。例如,甲壳素原料供应短缺、环境污染、易产生过敏反应[5]。因此,生产更高效、更安全的G1cNAc是目前消费者需求的产品。近年来,由于微生物发酵法不受原料限制,生产效率高,污染小,而且不会产生过敏反应,越来越受到研究人员的关注。因此,构建高效生产GlcNAc的基因工程菌,能够有效解决传统生产方法所带来的诸多问题,为社会生产发展带来巨大的经济效益[6]。
随着GlcNAc市场需求的日益增加,构建高效生产GlcNAc的基因工程菌在工业化生产中表现出了巨大的潜力和吸引力。现如今国内外研究生产GlcNAc的基因工程菌主要为大肠杆菌(Escherichia coli,E.coli)、枯草芽孢杆菌(Bacillus subtilis,B.subtilis)和谷氨酸棒杆菌(Corynebacterium glutamicum,C.glutamicum)。重组E.coli相对于甲壳素水解法具有巨大优势及应用潜力。然而,由于E.coli不是食品安全级菌株;因此,适合于工业规模发酵生产的食品安全级生产菌株是微生物发酵法生产GlcNAc的理想菌株。许多通常被认为安全的微生物菌株己被鉴定,而且已经利用这些菌株实现了许多重要营养制品的生产[7]。C.glutamicum和B.subtilis的发酵工艺成熟、遗传背景清晰、基因操作技术成熟并且不易受噬菌体污染,作为食品安全级工业生产菌株,被广泛应用于发酵工业以生产氨基酸、透明质酸(hyaluronic acid,HA)、核黄素等各种化合物[8-11]。本文主要论述了产GlcNAc及其衍生物透明质酸和乙酰神经氨酸工程菌的构建中应用的代谢途径改造与调控相关的代谢改造策略,并展望其重点的研究方向和存在的问题,以期为工业化发酵生产GlcNAc及广泛应用提供支持。
1 GlcNAc合成途径的构建
N-乙酰氨基葡萄糖合成途径中2个关键的基因是氨基葡萄糖合成酶(glucosamine synthase,GlmS)基因和异源GlcN-6-磷酸乙酰转移酶基因(GNA1)。由于E.coli、C.glutamicum和B.subtilis中都不存在GNA1基因,因此,构建完整的GlcNAc合成通路是合成目的产物的首要问题。2005年DENG等[12]在大肠杆菌中过表达异源GNA1,以葡萄糖为碳源合成GlcNAc。2012年,陈鑫等[13]通过共表达glmS和GNA1,构建了有效生产GlcN和GlcNAc的重组大肠杆菌。丁振中等[14]将pET24(a)-glmS-gna1表达载体转化入大肠杆菌,GlcNAc发酵产量达到了31.2 g/L。
LIU等[15]选取了1株食品安全生产菌株B.subtilis作为出发菌株,将基因glmS和GNA1共表达并控制2个基因的不同表达强度以增强GlcNAc的合成,使GlcNAc的产量由1.83 g/L提高至4.55 g/L。由于在B.subtilis中,GlmS的表达受到由glmS核酶介导的反馈抑制[16-17],从而限制关键前体物质GlcN6P的积累,因此,glmS核酶的反馈抑制是限制GlcNAc合成的限速步骤,所以解除glmS核酶的反馈抑制是积累GlcN6P的有效策略。NIU等通过敲除glmS核酶,同时在此位置整合一段终止子和强启动子序列,已达到增强glmS基因的表达,从而有效解除核酶反馈抑制,使GlcNAc的产量明显增加。
王雅婷等[18]选取谷氨酸生产菌株C.glutamicum ATCC13032作为出发菌株,表达关键酶GlmS和GNA1,增强GlcNAc的合成途径,实现以葡萄糖为碳源生产GlcNAc。
2 阻断GlcNAc降解途径
有效阻断代谢产物的降解是代谢工程中一种有效积累目的产物的方法。将代谢产物有效分泌到细胞外,减少或阻断代谢产物从胞外进入到细胞内,敲除代谢产物的降解途径都可以有效减少代谢产物的降解。2005年DENG等[12]敲除nagBACD操纵子和乙酰氨糖转运基因nagE,以阻断GlcN向胞内运输并降解,使GlcN产量达到了17 g/L。2012年,陈鑫等[13]敲除大肠杆菌中nagE与甘露糖磷酸转运编码基因manX,GlcN产量达到了最大值4.82 g/L,同时GlcNAc产量达到118.78 g/L。该结果表明,敲除氨糖的转运编码基因nagE和manX可有效降低胞外的GlcN与GlcNAc向胞内转运,减少氨糖在胞内的代谢降解,可有效提高GlcN与GlcNAc在发酵液中的积累量。
在B.subtilis中存在氨糖的转运途径和降解途径,LIU等[15]通过敲除GlcNAc专一性磷酸转运编码基因nagP,降低了GlcNAc向胞内的运输,进一步敲除GlcNAc-6-P脱乙酰酶nagA、GlcN-6-P脱氨酶gamA和nagB,从而阻断了前体物质GlcNAc-6-P和GlcN-6-P在胞内的降解,有效阻断了GlcNAc在细胞内降解。在3 L发酵罐,经过补料分批发酵,G1cNAc产量达到5.19 g/L。C.glutamicum中同样存在GlcNAc的降解途径,王雅婷等[18]通过敲除nagAB使得构建的工程菌glmS-gna1-C.g-ΔnagAB在250 mL摇瓶发酵体系中GlcNAc产量达到1.43 g/L左右。
3 阻断副产物积累
副产物的积累一直是工业化发酵生产中面临的问题,由于副产物的产生,不仅降低了底物转化成产物的转化率,而且还为产物的分离带来更复杂的工序和投资成本,所以消除副产物的积累,不仅能够有效增加底物转化率,同时能够减少工业化生产中的加工工序,所以消除副产物的积累同样是代谢工程改造中的一种重要策略。大肠杆菌的发酵中最常见的副产物是乙酸,陈鑫等[13]通过改变葡萄糖的吸收速率,ptsG缺陷的重组菌株经过发酵乙酸的积累量降低了71%,同时,GlcN和GlcNAc的总产量增加65.4%,达到128.75 g/L。
B.subtilis在稳定期能够形成芽孢,相比于其他芽孢杆菌,维持较高代谢水平,降低了产物合成效率[19]。因此,工业生产 B.subtilis 需要阻断芽孢产生[19-20]。LIU等[21]通过敲除spo0A和sigE阻断了芽孢形成。此外,通过敲除编码细胞色素的基因以减少维持代谢。在3 L发酵罐中GlcNAc的产量提高到了20.58 g/L。在摇瓶发酵中,乳酸和乙酸质量浓度分别达到4.1和3.3 g/L,这不仅抑制细胞生长,同时还降低了GlcNAc转化效率。为促进GlcNAc合成,敲除乳酸脱氢酶编码基因ldh和乙酰磷酸酶编码基因pta阻断乳酸和乙酸的合成,GlcNAc产量进一步提高44.9%,达到3.55 g/L。GlcNAc对底物葡萄糖的得率达到0.09 g/g,比未敲除ldh和pta前提高了50%[7]。然而发酵中另一副产物乙偶姻的质量浓度达到16.7 g/L,MA等[22]通过敲除乙偶姻合成相关基因alsR、alsS、alsD,阻断了副产物乙偶姻的积累,在3 L生物反应器中GlcNAc的产量达到48.9 g/L,葡萄糖产率提高至0.32 g/L。
王雅婷等[18]将C.glutamicum的ldh敲掉,使得glmS-gan1-C.g-ΔnagABΔldh生产GlcNAc能力达到2.23 g/L,副产物乳酸浓度几乎为0。但是对于谷氨酸棒杆菌,由于其是氨基酸生产菌,所以其副产物中可能会含有大量的氨基酸。因此,尝试调控氨基酸的代谢以获得更高的产率。
4 代谢网络调控提高GlcNAc的积累
代谢工程通过对底盘微生物进行遗传改造,通过调控内源基因的表达和引入异源途径,通常会导致代谢途径通量不平衡,引起中间代谢物过量积累,从而抑制胞内代谢活动,降低菌体的生理活性和发酵性能[23]。因此,解决代谢失衡问题,可以有效改善微生物细胞生长状况、代谢物产量和产率。
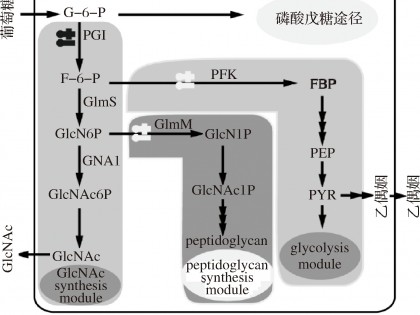
B.subtilis中GlcNAc代谢网络可以分为GlcNAc合成模块、中心代谢模块(6-磷酸果糖激酶Pfk是该模块关键酶)和肽聚糖合成模块(磷酸氨基葡萄糖变位酶GlmM是该模块关键酶) (图1),而中心代谢模块和肽聚糖合成模块是GlcNAc合成的竞争模块。要实现GlcNAc的高效合成,需要在强化GlcNAc合成的同时弱化中心代谢和肽聚糖合成模块,而由于中心代谢和肽聚糖合成模块是细胞生长所必须的,只能进行弱化表达而不能完全敲除。LIU等[7]通过利用反义调节RNA对3个代谢模块的关键节点基因pfk和glmM进行优化组装调控,经过发酵GlcNAc产量由3.55 g/L提高到8.30 g/L,通过这种补料分批发酵方式,GlcNAc产量达到了31.65 g/L。
通过对代谢节点的调控可以实现代谢流量的分流作用,从而能够使得不同代谢途径之间重新分配代谢流量。有效分配代谢流量可以平衡代谢途径,从而提高代谢产物的产率。因此,开发潜在的代谢调控工具是代谢工程的重要基础。NIU等[24]使用glmS核糖开关作为调控工具,因其具有动态响应胞内GlcN-6-P的浓度改变自身活性,从而能够调控下游基因表达这一特性,利用glmS核糖开关分别调控pfk和glmM的表达,同时glmS核酶突变体M9调控pgi(磷酸葡萄糖异构酶基因)的表达(图1),胞内积累的GlcN-6-P作为信号分子,通过glmS核酶介导调控3个代谢节点关键基因的表达,当3个位点协同作用,才能有效分配代谢途径之间的代谢流量,最终使得GlcNAc的产量达到了16.60 g/L,且无副产物乙偶姻的积累。WU等[25]开发了CRISPRi技术调控3个关键基因pfk、glmM、zwf,并通过进一步优化sgRNA的抑制能力,最终GlcNAc的产量达到20.5 g/L,得率为0.46 g/g(葡萄糖),在3 L生物反应器中GlcNAc产量达到103.1 g/L,这表明平衡代谢途径可以有效提高代谢物的产量和得率。

图1 枯草芽孢杆菌中乙酰氨基葡萄糖合成代谢网络图
Fig.1 metabolic pathway of GlcNAc in B.subtilis
因此,解决代谢失衡问题,是代谢工程中的难题,随着代谢工程技术的发展,不同代谢工程调控元件被加以设计,改造和组装以实现平衡代谢途径,重新分配代谢流量,调控重组菌适应性进化强度及途径酶的定向进化等。最近新开发的用于代谢调控工程菌的调控元件有转录因子,同时还包括合成启动子、动态响应启动子、合成RNA及蛋白降解元件等[26-30]。
5 N-乙酰氨基葡萄糖衍生物的代谢合成
透明质酸(HA)是以β-1-3 N-乙酰氨基葡萄糖和β-1-4葡萄糖醛酸(GlcA)为二糖重复单元的线性聚合物[31]。在人体内,脐带、滑液、眼睛玻璃体液中含有大量的HA。因其具有显著的流变性、黏弹性和吸湿性属性,除广泛应用在许多化妆品中,也被广泛用于眼病、风湿病和皮肤病等的治疗中[32]。WINDER等[33]在B.subtilis中表达来源于嗜热链球菌的透明质酸合酶(hasA),成功合成了1 MDa分子质量的HA。IZAWA等[34]在嗜热链球菌中表达透明质酸合酶(hasA)和尿苷二磷酸-葡萄糖脱氢酶基因(hasB),使得HA的产量提高6倍达到1.2 g/L。JIA等[35]在B.subtilis中表达来源于Pasteurella multocida中的HA合成酶基因和前体供应基因,合成分子质量为4.5 MDa的HA,产量达到6.8 g/L。并指出通过采用不同的策略能够控制分子质量在8 kDa~5.4 MDa。2014年,JEONG等[36]在毕赤酵母中表达来源于X.laevis中的xhasA、xhasB和内源的hasC、hasD、hasE,合成分子质量为1.2 MDa的HA,并通过控制基因的表达强度,获得不同分子质量的HA,最终在1 L发酵罐中HA的产量达到0.8~1.7 g/L。CHENG等[37]在C.glutamicum中表达hasA和相关内源HA合成基因,进一步通过培养条件的优化,使得在5 L发酵罐中HA产量达到8.3 g/L,产率为0.24 g/(L·h),得率为0.22 g/g。CHENG等[38]进一步通过调控HA代谢合成途径,比较不同操纵子组合对HA生产的影响,最终确定HasAB和HasABC是最有效的组合,同时阻断乳酸的积累,最后在5 L发酵罐中HA产量达到21.6 g/L。CHENG等[39]基于基因组代谢模型iCW773,利用OptForceMUST算法进行代谢流平衡分析,确定改造靶点,利用系统设计和代谢改造,减弱糖酵解途径、戊糖磷酸途径和丙酮酸降解途径的代谢流量,其中所使用的策略包括:启动子PdapB控制hasB的表达、反义RNA减弱fba、zwf的表达、删除乳酸和乙酰合成途径,最终使得HA产量达到28.7 g/L。这是目前为止报道的最高产量。因此,结合模型技术的系统生物学方法,能够更加综合与精确的理解细胞的生理状态,扩大代谢工程的改造范围,有效解决代谢瓶颈问题,为实现工业化生产提供理论基础。
N-乙酰神经氨酸(NeuAc)在细胞中通常存在于细胞膜表面的糖蛋白和糖脂的末端,在细胞识别和信号传递中起重要作用[40]。膳食中添加NeuAc可以促进婴儿大脑的发育,维持老年人的大脑功能和大脑健康[41]。已报到一些NeuAc的衍生物被用作纳米载体的稳定剂用于癌症靶向和治疗[42]。因此,NeuAc具有潜在的食用和制药应用价值,需要大规模生产NeuAc。ISHIKAWA等[43]最初采用全细胞催化合成NeuAc,但是操作复杂、产率低;为了高效合成NeuAc,利用E.coli过表达slr1975、neuB两个基因,NeuAc产量达到25 g/L;进一步利用大肠杆菌高密度发酵,在添加120 g/L GlcNAc条件下,反应22 h NeuAc产量达到53 g/L。KANG等[44]在E.coli中设计了NeuAc的合成途径,通过引入外源基因GNA1和乙酰氨基葡萄糖异构酶基因(slr1975)构建完整的合成途径。进一步通过氨基葡萄糖-6-磷酸合成酶的去抑制,删除GlcN-6-P分解代谢基因nagB,增强GlcNAc的积累;删除ManNAc分解代谢基因manK、nanE,增加ManNAc的积累;删除丙酮酸分解代谢基因ldhA、poxB、ackA,促进丙酮酸积累;删除NeuAc输入基因nanT,减少NeuAc的降解;以葡萄糖为碳源进行分批发酵,NeuAc的产量达到7.85 g/L。YAN等[45]利用几丁质降解细菌Serratia marcescens直接利用几丁质合成NeuAc。首先共表达合成途径关键基因slr1975、nanA。进一步利用RNASeq数据筛选不同强度的启动子对这2个关键基因进行优化组合,并将催化可逆反应的nanA替换成不可逆的neuB基因;最终工程菌可利用20 g/L GlcNAc合成0.48 g/L NeuAc,利用5 g/L几丁质合成0.3 g/L的NeuAc。ZHANG等[46]构建食品安全生产菌株B.subtilis合成NeuAc。首先通过过表达合成途径关键酶GNA1、AGE、NeuB,形成完整的NeuAc重头合成途径,NeuAc产量达到0.33 g/L;进一步通过添加葡萄糖和苹果酸平衡GlcNAc合成模块和PEP供应模块,使得NeuAc产量达到1.65 g/L;继续阻断糖酵解途径、引入ED途径、过表达苹果酸酶YtsJ以平衡NeuAc生产与细胞生长之间的碳流量;最终NeuAc的产量达到2.18 g/L,为进一步构建工业化生产NeuAc菌株奠定基础。
6 结论
GlcNAc作为一种在食品、医疗、化妆品领域应用广泛的功能性单糖,同时也是许多功能性多糖和寡糖重要组成部分,越来越受到人们的关注。利用生物法制备GlcNAc是具有良好应用前景的GlcNAc生产新方法。目前,微生物法合成GlcNAc除了通过传统的基因敲除和基因调控,还可以通过发掘潜在的代谢网络调控工具进行调控。研究表明,有效的代谢网络调控工具可以在代谢流的重新分配中起着重要作用,同时也是提高代谢物产量和产率的最佳选择。目前的代谢工程中,对有效调控工具的发掘也将是代谢工程发展的一个重要环节。然而在生物体内,GlcNAc是通过前体物质GlcNAc-6-P经过磷酸酶催化发生去磷酸化作用而生成,大量积累的GlcNAc-6-P对细胞产生一定的毒性,所以,磷酸糖的去磷酸化反应也是GlcNAc合成的一步关键反应。目前只有来源于E.coli的HAD磷酸酶YqaB对GlcNAc-6-P具有水解去磷酸化作用,并没有其他菌体来源的磷酸酶被报道。由于磷酸糖过量积累对细胞产生毒性作用,因此,进一步解析GlcNAc-6-P的分泌途径,强化GlcNAc-6-P的去磷酸化作用,对GlcNAc的合成将会有促进作用。总的来说,要充分利用传统的发酵工程手段,以及从基因工程的角度对工程菌株进行合理的优化和改造,以得到更高产量的符合工业化应用的GlcNAc生产菌株。
ta-name="参考文献" style="font-size: 1em; text-align: justify; text-indent: 0em; line-height: 1.8em; margin: 0.5em 0em;">ta-name="参考文献.标题" style="font-weight: bold !important;">参考文献
ta-name="参考文献.条目" style="font-size: 1em; text-align: justify; line-height: 1.8em; margin: 0.5em 0em;">[1] EL ASHRY E,ALY M.Synthesis and biological relevance of N-acetylglucosamine-containing oligosaccharides[J].Pure and Applied Chemistry,2007,79(12):2 229-2 242.
ta-name="参考文献.条目" style="font-size: 1em; text-align: justify; line-height: 1.8em; margin: 0.5em 0em;">[2] YADAV V,PANILAITIS B,SHI H,et al.N-acetylglucosamine 6-phosphate deacetylase (nagA) is required for N-acetyl glucosamine assimilation in Gluconacetobacter xylinus[J].PLoS One,2011,6(6):e18 099.
ta-name="参考文献.条目" style="font-size: 1em; text-align: justify; line-height: 1.8em; margin: 0.5em 0em;">[3] CHEN J K,SHEN C R,YEH C H,et al.N-acetyl glucosamine obtained from chitin by chitin degrading factors in Chitinbacter tainanesis[J].International Journal of Molecular Sciences,2011,12(2):1 187-1 195.
ta-name="参考文献.条目" style="font-size: 1em; text-align: justify; line-height: 1.8em; margin: 0.5em 0em;">[4] HULIKOVA K,SVOBODA J,BENSON V,et al.N-acetyl-D-glucosamine-coated polyamidoamine dendrimer promotes tumor-specific B cell responses via natural killer cell activation[J].International Immunopharmacology,2011,11(8):955-961.
ta-name="参考文献.条目" style="font-size: 1em; text-align: justify; line-height: 1.8em; margin: 0.5em 0em;">[5] DENG M D,SEVERSON D K,GRUND A D,et al.metabolic engineering of Escherichia coli for industrial production of glucosamine and N-acetylglucosamine[J].metabolic Engineering,2005,7(3):201-214.
ta-name="参考文献.条目" style="font-size: 1em; text-align: justify; line-height: 1.8em; margin: 0.5em 0em;">[6] LIU L,LIU Y,SHIN H D,et al.Developing Bacillus spp.as a cell factory for production of microbial enzymes and industrially important biochemicals in the context of systems and synthetic biology[J].Applied Microbiology and Biotechnology,2013,97(14):6 113-6 127.
ta-name="参考文献.条目" style="font-size: 1em; text-align: justify; line-height: 1.8em; margin: 0.5em 0em;">[7] LIU Y,ZHU Y,LI J,et al.Modular pathway engineering of Bacillus subtilis for improved N-acetylglucosamine production[J].metabolic Engineering,2014,23:42-52.
ta-name="参考文献.条目" style="font-size: 1em; text-align: justify; line-height: 1.8em; margin: 0.5em 0em;">[8] WANG Y Y,XU J Z,ZHANG W G.metabolic engineering of l-leucine production in Escherichia coli and Corynebacterium glutamicum:a review[J].Critical Reviews in Biotechnology,2019,39(5):633-647.
ta-name="参考文献.条目" style="font-size: 1em; text-align: justify; line-height: 1.8em; margin: 0.5em 0em;">[9] JIN P,KANG Z,YUAN P,et al.Production of specific-molecular-weight hyaluronan by metabolically engineered Bacillus subtilis 168[J].metabolic Engineering,2016,35:21-30.
ta-name="参考文献.条目" style="font-size: 1em; text-align: justify; line-height: 1.8em; margin: 0.5em 0em;">[10] WESTBROOK AW,REN X,OH J,et al.metabolic engineering to enhance heterologous production of hyaluronic acid in Bacillus subtilis[J].metabolic Engineering,2018,47:401-413.
ta-name="参考文献.条目" style="font-size: 1em; text-align: justify; line-height: 1.8em; margin: 0.5em 0em;">[11] LIU L,LIU Y,SHIN H D,et al.Microbial production of glucosamine and N-acetylglucosamine:advances and perspectives[J].Applied Microbiology and Biotechnology,2013,97(14):6 149-6 158.
ta-name="参考文献.条目" style="font-size: 1em; text-align: justify; line-height: 1.8em; margin: 0.5em 0em;">[12] DENG M D,ANGERER J D,CYRON D,et al.Process and material for production of glucosamine and N-acetylglucosamine:US8124381[P].2012-2-28.
ta-name="参考文献.条目" style="font-size: 1em; text-align: justify; line-height: 1.8em; margin: 0.5em 0em;">[13] 陈鑫.代谢工程改造大肠杆菌发酵生产氨基葡萄糖及过程优化与控制[D].无锡:江南大学,2012.
ta-name="参考文献.条目" style="font-size: 1em; text-align: justify; line-height: 1.8em; margin: 0.5em 0em;">[14] 丁振中,冯小海,张超,等.产氨基葡萄糖工程菌的构建与发酵培养基优化[J].化工管理,2018(3):73-75.
ta-name="参考文献.条目" style="font-size: 1em; text-align: justify; line-height: 1.8em; margin: 0.5em 0em;">[15] LIU Y,LIU L,SHIN H D,et al.Pathway engineering of Bacillus subtilis for microbial production of N-acetylglucosamine[J].metabolic Engineering,2013,19:107-115.
ta-name="参考文献.条目" style="font-size: 1em; text-align: justify; line-height: 1.8em; margin: 0.5em 0em;">[16] COLLINS J A,IRNOV I,BAKER S,et al.Mechanism of mRNA destabilization by the glmS ribozyme[J].Genes &Development,2007,21(24):3 356-3 368.
ta-name="参考文献.条目" style="font-size: 1em; text-align: justify; line-height: 1.8em; margin: 0.5em 0em;">[17] WINKLER W C,NAHVI A,ROTH A,et al.Control of gene expression by a natural metabolite-responsive ribozyme[J].Nature,2004,428(6 980):281-286.
ta-name="参考文献.条目" style="font-size: 1em; text-align: justify; line-height: 1.8em; margin: 0.5em 0em;">[18] 王雅婷.生物法合成N-乙酰氨基葡萄糖[D].北京:北京化工大学,2016.
ta-name="参考文献.条目" style="font-size: 1em; text-align: justify; line-height: 1.8em; margin: 0.5em 0em;">[19] TANNLER S,DECASPER S,SAUER U.Maintenance metabolism and carbon fluxes in Bacillus species[J].Microbiology Cell Factories,2008,7:19.
ta-name="参考文献.条目" style="font-size: 1em; text-align: justify; line-height: 1.8em; margin: 0.5em 0em;">[20] PERKINS J,WYSS M,SAUER U,et al.metabolic Pathway Engineering Handbook[M].New York:CRC Press,2009.
ta-name="参考文献.条目" style="font-size: 1em; text-align: justify; line-height: 1.8em; margin: 0.5em 0em;">[21] LIU Y,ZHU Y,MA W,et al.Spatial modulation of key pathway enzymes by DNA-guided scaffold system and respiration chain engineering for improved N-acetylglucosamine production by Bacillus subtilis[J].metabolic Engineering,2014,24:61-69.
ta-name="参考文献.条目" style="font-size: 1em; text-align: justify; line-height: 1.8em; margin: 0.5em 0em;">[22] MA W,LIU Y,SHIN H D,et al.metabolic engineering of carbon overflow metabolism of Bacillus subtilis for improved N-acetylglucosamine production[J].Bioresource Technology,2018,250:642-649.
ta-name="参考文献.条目" style="font-size: 1em; text-align: justify; line-height: 1.8em; margin: 0.5em 0em;">[23] LO T M,TEO W S,LING H,et al.Microbial engineering strategies to improve cell viability for biochemical production[J].Biotechnology Advances,2013,31(6):903-914.
ta-name="参考文献.条目" style="font-size: 1em; text-align: justify; line-height: 1.8em; margin: 0.5em 0em;">[24] NIU T,LIU Y,LI J,et al.Engineering a glucosamine-6-phosphate responsive glmS ribozyme switch enables dynamic control of metabolic flux in Bacillus subtilis for overproduction of N-acetylglucosamine[J].ACS Synthetic Biology,2018,7(10):2 423-2 435.
ta-name="参考文献.条目" style="font-size: 1em; text-align: justify; line-height: 1.8em; margin: 0.5em 0em;">[25] WU Y,CHEN T,LIU Y,et al.CRISPRi allows optimal temporal control of N-acetylglucosamine bioproduction by a dynamic coordination of glucose and xylose metabolism in Bacillus subtilis[J].metabolic Engineering,2018,49:232-241.
ta-name="参考文献.条目" style="font-size: 1em; text-align: justify; line-height: 1.8em; margin: 0.5em 0em;">[26] SEGALL-SHAPIRO T H,SonTAG E D,VOIGT C A.Engineered promoters enable constant gene expression at any copy number in bacteria[J].Nature Biotechnology,2018,36(4):352-358.
ta-name="参考文献.条目" style="font-size: 1em; text-align: justify; line-height: 1.8em; margin: 0.5em 0em;">[27] GUPTA A,REIZMAN IM,REISCH C R,et al.Dynamic regulation of metabolic flux in engineered bacteria using a pathway-independent quorum-sensing circuit[J].Nature Biotechnology,2017,35(3):273-279.
ta-name="参考文献.条目" style="font-size: 1em; text-align: justify; line-height: 1.8em; margin: 0.5em 0em;">[28] YANG J,SEO S W,JANG S,et al.Synthetic RNA devices to expedite the evolution of metabolite-producing microbes[J].Nature Communications,2013,4:1 413.
ta-name="参考文献.条目" style="font-size: 1em; text-align: justify; line-height: 1.8em; margin: 0.5em 0em;">[29] CAROTHERS J M,GOLER J A,JUMINAGA D,et al.Model-driven engineering of RNA devices to quantitatively program gene expression[J].Science,2011,334(6 063):1 716-1 719.
ta-name="参考文献.条目" style="font-size: 1em; text-align: justify; line-height: 1.8em; margin: 0.5em 0em;">[30] DAHL R H.Engineering dynamic pathway regulation using stress-response promoters[J].Nature Biotechnology,2013,31:1 039-1 046.
ta-name="参考文献.条目" style="font-size: 1em; text-align: justify; line-height: 1.8em; margin: 0.5em 0em;">[31] WEISSMANN B,MEYER K.The Structure of hyalobiuronic acid and of hyaluronic acid from umbilical cord[J].Journal of the American Chemical Society,1954,76:1 753-1 757
ta-name="参考文献.条目" style="font-size: 1em; text-align: justify; line-height: 1.8em; margin: 0.5em 0em;">[32] KOGAN G,SOLTES L,STERN R,et al.Hyaluronic acid:a natural biopolymer with a broad range of biomedical and industrial applications[J].Biotechnology Letters,2007,29(1):17-25.
ta-name="参考文献.条目" style="font-size: 1em; text-align: justify; line-height: 1.8em; margin: 0.5em 0em;">[33] WIDNER B,BEHR R,VON DOLLEN S,et al.Hyaluronic acid production in Bacillus subtilis[J].Applied and Environmental Microbiology,2005,71(7):3 747-3 752.
ta-name="参考文献.条目" style="font-size: 1em; text-align: justify; line-height: 1.8em; margin: 0.5em 0em;">[34] IZAWA N,SERATA M,SONE T,et al.Hyaluronic acid production by recombinant Streptococcus thermophilus[J].Journal of Bioscience and Bioengineering,2011,111(6):665-670.
ta-name="参考文献.条目" style="font-size: 1em; text-align: justify; line-height: 1.8em; margin: 0.5em 0em;">[35] JIA Y,ZHU J,CHEN X,et al.metabolic engineering of Bacillus subtilis for the efficient biosynthesis of uniform hyaluronic acid with controlled molecular weights[J].Bioresource Technology,2013,132:427-431.
ta-name="参考文献.条目" style="font-size: 1em; text-align: justify; line-height: 1.8em; margin: 0.5em 0em;">[36] JEONG E,SHIM W Y,KIM J H.metabolic engineering of Pichia pastoris for production of hyaluronic acid with high molecular weight[J].Journal of Biotechnology,2014,185:28-36.
ta-name="参考文献.条目" style="font-size: 1em; text-align: justify; line-height: 1.8em; margin: 0.5em 0em;">[37] CHENG F,GONG Q,YU H,et al.High-titer biosynthesis of hyaluronic acid by recombinant Corynebacterium glutamicum[J].Biotechnology Journal,2016,11(4):574-584.
ta-name="参考文献.条目" style="font-size: 1em; text-align: justify; line-height: 1.8em; margin: 0.5em 0em;">[38] CHENG F,LUOZHONG S,GUO Z,et al.Enhanced biosynthesis of hyaluronic acid using engineered Corynebacterium glutamicum via metabolic pathway regulation[J].Biotechnology Journal,2017,12(10).DOI:10.1002/biot.201700191.
ta-name="参考文献.条目" style="font-size: 1em; text-align: justify; line-height: 1.8em; margin: 0.5em 0em;">[39] CHENG F,YU H,STEPHANOPOULOS G.Engineering Corynebacterium glutamicum for high-titer biosynthesis of hyaluronic acid[J].metabolic Engineering,2019.DOI:10.1016/j.ymben.2019.08.011.
ta-name="参考文献.条目" style="font-size: 1em; text-align: justify; line-height: 1.8em; margin: 0.5em 0em;">[40] VARKI A.Diversity in the sialic acids[J].Glycobiology,1992,2(1):25-40.
ta-name="参考文献.条目" style="font-size: 1em; text-align: justify; line-height: 1.8em; margin: 0.5em 0em;">[41] WANG B.Sialic acid is an essential nutrient for brain development and cognition[J].Annual Review of Nutrition,2009,29:177-222.
ta-name="参考文献.条目" style="font-size: 1em; text-align: justify; line-height: 1.8em; margin: 0.5em 0em;">[42] BonDIOLI L,RUOZI B,BELLETTI D,et al.Sialic acid as a potential approach for the protection and targeting of nanocarriers[J].Expert Opinion on Drug Delivery,2011,8(7):921-937.
ta-name="参考文献.条目" style="font-size: 1em; text-align: justify; line-height: 1.8em; margin: 0.5em 0em;">[43] ISHIKAWA M,KOIZUMI S.Microbial production of N-acetylneuraminic acid by genetically engineered Escherichia coli[J].Carbohydrate Research,2010,345(18):2 605-2 609.
ta-name="参考文献.条目" style="font-size: 1em; text-align: justify; line-height: 1.8em; margin: 0.5em 0em;">[44] KANG J,GU P,WANG Y,et al.Engineering of an N-acetylneuraminic acid synthetic pathway in Escherichia coli[J].metabolic Engineering,2012,14(6):623-629.
ta-name="参考文献.条目" style="font-size: 1em; text-align: justify; line-height: 1.8em; margin: 0.5em 0em;">[45] YAN Q,FONG S S.Design and modularized optimization of one-step production of N-acetylneuraminic acid from chitin in Serratia marcescens[J].Biotechnology and Bioengineering,2018,115(9):2 255-2 267.
ta-name="参考文献.条目" style="font-size: 1em; text-align: justify; line-height: 1.8em; margin: 0.5em 0em;">[46] ZHANG X,LIU Y,LIU L,et al.Modular pathway engineering of key carbon-precursor supply-pathways for improved N-acetylneuraminic acid production in Bacillus subtilis[J].Biotechnology and Bioengineering,2018,115(9):2 217-2 231.
ta-name="译文篇名" style="font-size: 1.8em; color: rgb(195, 101, 0); text-align: center; margin: 0em 0em 0.5em;">Research progress on microbiological synthesis of N-acetylglucosamine and its derivatives
ta-name="译文摘要" style="font-size: 1em; text-align: justify; text-indent: 0em; line-height: 1.8em; margin: 0.5em 0em;">ta-name="译文摘要.标题" style="font-weight: bold !important;">ABSTRACT Glucosamine (GlcN) is an amino sugar derived from substituting a 2-hydroxyl group of a glucose molecule with an amino group.GlcN and its derivative,N-acetylglucosamine (GlcNAc),are widely used in food,medicine and cosmetics industries.This paper summarized and reviewed recent metabolic engineering strategies in biosynthesis of GlcNAc and its derivatives and its potential challenges in engineering and application.
ta-name="译文关键词" style="font-size: 1em; text-align: justify; text-indent: 0em; line-height: 1.8em; margin: 0.5em 0em;">ta-name="译文关键词.标题" style="font-weight: bold !important;">Key words N-acetylglucosamine;N-acetylglucosamine derivatives;glucosamine;metabolic engineering strategy;genetically engineered bacteria
ta-name="doi" style="font-size: 1em; text-align: justify; text-indent: 0em; line-height: 1.8em; margin: 0.5em 0em;">ta-name="doi.标题" class="key" style="font-weight: bold !important;">DOI:10.13995/j.cnki.11-1802/ts.022263
ta-name="引文格式" style="font-size: 1em; text-align: justify; text-indent: 0em; line-height: 1.8em; margin: 0.5em 0em;">ta-name="引文格式.标题" style="font-weight: bold !important;">引用格式:牛腾飞,李江华,堵国成,等.微生物法合成N-乙酰氨基葡萄糖及其衍生物的研究进展[J].食品与发酵工业,2020,46(1):274-279.NIU Tengfei,LI Jianghua,DU Guocheng,et al.Research progress on microbiological synthesis of N-acetylglucosamine and its derivatives[J].Food and Fermentation Industries,2020,46(1):274-279.
ta-name="作者简介" style="font-size: 1em; text-align: justify; text-indent: 0em; line-height: 1.8em; margin: 0.5em 0em;">ta-name="作者简介.标题" class="key" style="font-weight: bold !important;">第一作者:博士研究生(李江华教授和刘龙教授为共同通讯作者,E-mail:lijianghua@jiangnan.edu.cn;longliu@jiangnan.edu.cn)
ta-name="基金项目" style="font-size: 1em; text-align: justify; text-indent: 0em; line-height: 1.8em; margin: 0.5em 0em;">ta-name="基金项目.标题" class="key" style="font-weight: bold !important;">基金项目:国家优秀青年基金(31622001);国家自然科学基金面上项目(21676119)
ta-name="收稿日期" style="font-size: 1em; text-align: justify; text-indent: 0em; line-height: 1.8em; margin: 0.5em 0em;">ta-name="收稿日期.标题" class="key" style="font-weight: bold !important;">收稿日期:2019-09-15,改回日期:2019-09-26