子囊霉素(ascomycin, FK520) , 由聚酮合酶-非核糖体合成酶共同合成, 是具有高效的抗真菌和免疫抑制活性的天然化合物。子囊霉素作为抗真菌的抗生素, 还具有免疫抑制特性, 近年来被成功用于预防器官移植排异, 并且在类风湿性关节炎和牛皮癣等方面的治疗也有显著功效。子囊霉素除了在治疗自身免疫疾病中有不错的疗效, 还具有抗痉挛、抗疟疾、神经保护再生等活性[1], 有巨大的药用和市场价值。目前, 我国对子囊霉素的相关研究还正处于发展阶段, 获得具有我国自主知识产权的高产子囊霉素的工程菌株和发酵技术迫在眉睫。
本论文主要对子囊霉素的理化性质与免疫抑制活性、生物合成基因簇、子囊霉素合成前体以及发酵法生产子囊霉素等方面进行了综述, 同时对子囊霉素的研究开发进行了展望。
1 子囊霉素的理化性质与免疫抑制活性子囊霉素(ascomycin, FK-520) 是23元大环内酯类化合物。子囊霉素的化学名为17α-乙基-1β, 14α-二羟基-12β[2-(4α-羟基-3β-甲氧基-1β-1-(E)-甲基乙烯基)]-23α, 25β-二甲氧基-13α, 19, 21α, 27β-四甲基-11, 28-二氧杂-4-氮杂三环[22, 3, 1, O]二十八碳-18-2, 3, 10, 16-四酮, 一水合物, 相对分子质量为822.5, 分子式C44H69NO12·H2O[2], 其化学式结构如图 1。
 |
| 图 1 子囊霉素结构式[2] Figure 1 Structure of ascomycin[2] |
|
图选项
|
子囊霉素属于钙调磷酸酶抑制剂, 主要是通过阻断白细胞介素-2(interleukin-2) 等细胞因子的表达从而抑制T淋巴细胞的免疫活性。研究表明子囊霉素分为结合域和效应域2个域:结合域是C24-C15, 与FKBP-12(FK 结合蛋白12, 免疫亲和蛋白12) 有高亲和力的作用, 效应域是C13-C23, 主要作用于钙调磷酸酶的靶点。子囊霉素与免疫亲和蛋白FKBP-12结合后, 再与钙调磷酸酶结合形成子囊霉素-FKBP-12-钙调磷酸酶组成的三元复合物, 形成的三元复合物能够抑制钙调磷酸酶的脱磷酸化, 钙调磷酸酶脱磷酸化作用的抑制将直接导致其活性受阻。钙调磷酸酶的脱磷酸化作用是活化T细胞核转录因子NF-AT脱磷酸化和转移作用必须的。而NT-AT会启动转录基因形成淋巴因子, 如白细胞介素-2(IL-2) , 从而阻止了胞内信号传导途径, 其生物学效应是由阻碍炎症细胞因子形成的[3]。相比于环孢菌素A(CsA), 子囊霉素对IL-2的抑制作用更强。子囊霉素还可以通过抑制神经碱磷酸酯酶, 从而抑制人类中性粒细胞中的IL-8形成。子囊霉素对IL-8的抑制生长能力比CsA要强10倍[4], 而西罗莫司则没这种抑制功能。
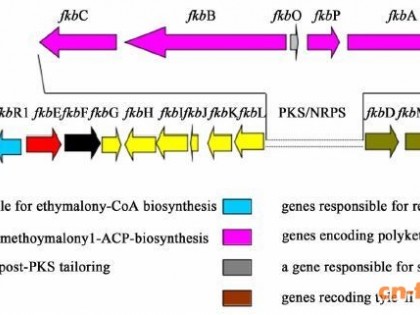
2 子囊霉素生物合成基因簇的研究进展2000年, Wu等[5]克隆并分析了Streptomyces hygroscopicus var. ascomyceticus (ATCC 14891) 的子囊霉素生物合成基因簇, FK520合成基因簇的结构与功能如图 2所示。
 |
| 图 2 子囊霉素生物合成基因簇的组成 Figure 2 The composition of gene cluster of biosynthesis of ascomycin |
|
图选项
|
子囊霉素作为聚酮-聚肽杂合的天然产物, 由PKS/NRPS共同合成, 其骨架结构是由3个PKS(分别由结构基因fkbB、fkbC、fkbA编码)和1个NRPS(基因fkbP编码)催化形成[6]。子囊霉素合成基因簇长达77 357 bp, 其中fkbB、fkbC、fkbA 3个大片段结构基因分别编码PKS的FkbB、FkbC、FkbA 3个多肽。fkbP编码的蛋白FkbP可以将L-哌啶酸分子合并到聚酮链上, FkbP含有的C1-A-PCP-C2功能域通过特殊的酰胺键向FK520的骨架中引入1个非蛋白组成的氨基酸, C2功能域在C-1位和C-26位间形成C—O内酯键, 进行骨架组装的最后解离和环化步骤[7]。fkbO编码的FkbO则负责PKS起始单元的合成。
子囊霉素骨架形成的基本过程:FkbB由莽草酸衍生物作为起始单位, 添加4个延伸模块;第2个多肽FkbC和第3个多肽FkbA分别添加2个和4个延伸模块。每个延伸模块再分别与1个特定的延伸单位进行特定的β-酮步骤, 然后再把合成链延伸到下1个延伸模块上。经PKS复合物结合的FkbP肽链合成酶的催化作用, 中间体与哌啶酸的氮原子发生缩合反应。与PKS复合物解除后, 前体的第9位碳原子被FkbD羟基化, 再被FkbO氧化, 而产生β-羰基酰胺作用, 同时31位碳上的羟基被FkbM甲基化[8]。经过以上系列反应后, 聚酮-聚肽长链从PKS-NRPS组装链上脱离下来, 再经过环化作用得到FK520骨架。
通过对FK520生物合成基因簇序列进行生物信息学分析, 获得了可能的特异调控基因fkbR1、fkbR2、fkbN。其中, fkbR1、fkbR2编码的产物分别与LysR家族转录调控子和以单胺氧化酶调控蛋白为代表的蛋白家族密切相关, fkbN编码的蛋白是LuxR家族的ATP结合转录调控子。fkbR和fkbN基因已被证实是FK506生物合成基因簇上与FK506合成相关的2个正调控基因[9]。目前, 本课题组正在研究子囊霉素合成基因簇上相关的特异调控基因对生物合成子囊霉素的调控作用。此外, 基因簇上还有一些与途径特异性前体合成相关的基因, 如编码甲氧基丙二酰-ACP的基因fkbGHIJK和编码乙基丙二酰CoA的基因fkbU、fkbE、fkbS等, 在下面的子囊霉素合成前体部分将进行相关叙述。
3 子囊霉素合成前体的研究进展用于组装子囊霉素骨架的杂合PKS-NRPS系统能够识别12分子的前体, 除了2分子的丙二酰辅酶A和5分子的甲基丙二酰辅酶A外[10], 还可以识别1分子的4, 5-二羟基-1-烯-环己酸(DHCHC)、2分子的甲氧基丙二酰ACP、1分子的乙基丙二酰CoA和1分子的L-哌啶甲酸, 如图 3所示。
 |
| 图 3 子囊霉素的合成前体[2] Figure 3 Precursors of ascomycin[2] |
|
图选项
|
正是由于这些特异性前体, 子囊霉素具备了独特的化学结构以及优良的药理活性。下文主要介绍4种途径特异性前体的合成研究, 这些特异前体不是直接来源于初级代谢产物, 而是由子囊霉素生物合成基因簇中相关基因编码形成的。
3.1 PKS起始单元4, 5-二羟基-1-烯-环己酸(DHCHC)的合成机制Paiva等[11]通过同位素标记实验指出FK520侧链4-羟基-3-甲氧基环己基结构来源于莽草酸。2011年, Jennifer等[12]根据Lowden等提出的FK520生物合成直接起始单元为4, 5-二羟基-1-烯-环己酸(DHCHC)的观点[13], 分别以莽草酸和分支酸作为底物, 对分支酸水解酶进行体外测活。结果发现在以莽草酸为底物的实验中没有检测到产物的生成, 而在以分支酸为底物的实验中检测到了3, 4-二羟基-1, 5-二烯-环己酸(DCDC)和丙酮酸的生成, 证实了DCDC的生物合成是以分支酸为直接底物的水解反应。Jennifer等[12]还指出DHCHC形成的关键步骤是分支酸水解作用形成DCDC, 根据fkbO基因可能编码分支酸水解酶, 利用HPLC-MS和NMR分析测定经纯化重组的FkbO能够有效地提高分支酸酶的催化效率, 表明了FkbO可以作用于分支酸的水解反应。最终阐明了PKS起始单元DHCHC的形成过程, 如图 4所示:分支酸在FkbO的作用下, 水解为丙酮和DCDC, DCDC再经过氧化过程形成DHCHC。
 |
| 图 4 PKS起始单元DHCHC的形成机制[12] Figure 4 Formation mechanism of DHCHC[12] |
|
图选项
|
Carroll等[14]通过异源表达实验验证了FkbG具有O-甲基转移酶的活性, 又通过敲除实验证明了FkbG是在延伸单元上载前起作用, 由此指出了PKS识别的延伸单元是甲氧基丙二酰ACP。Chan等[15]分析总结前人工作, 推导了由FkbGHIJK催化的PKS延伸单元甲氧基丙二酰ACP的代谢机制:FkbH催化1, 3-二磷酸甘油酸脱磷酸化, 通过硫酯键联结到ACP(由fkbJ编码);甘油酰ACP在FkbK催化作用下形成2-羟基-3-氧代酰基ACP, FkbK的产物再经酰基ACP脱氢酶FkbI氧化生成羟基丙二酰ACP, 羟基丙二酰ACP通过FkbG甲基化作用生成甲氧基丙二酰ACP。
3.3 PKS延伸单元乙基丙二酰CoA的合成机制FK520与他克莫司(FK506) 化学结构唯一的差别在于FK506 C-21位的特异侧链是烯丙基侧链, 而子囊霉素在相应的位置是乙基官能团。子囊霉素PKS延伸单元AT4(acyl transfer, AT)结构域特异性识别乙基丙二酰CoA, 使得子囊霉素C-21位的特异侧链是乙基。Wu等[5]通过研究分析推测出了吸水链霉菌中乙基丙二酰CoA的合成途径, 如图 5所示:吸水链霉菌在营养生长期积累的聚羟基丁酸酯(PHB)在fkbU基因编码的PHB解聚酶作用下, 生成3-羟基丁酰CoA;3-羟基丁酰CoA在fkbE编码的脱水酶催化下, 脱水形成巴豆酰CoA;巴豆酰CoA经fkbS基因编码的巴豆酰CoA还原酶催化下, 生成丁酰CoA;丁酰CoA经酰基CoA羧化酶作用最终合成乙基丙二酰CoA。
 |
| 图 5 吸水链霉菌中乙基丙二酰CoA合成途径[5] Figure 5 Biosynthetic pathway of ethylmalonyl-CoA[5] |
|
图选项
|
Paiva等[16]通过同位素发酵饲喂实验发现, 引入哌啶结构的NRPS延伸单元可能来源于L-赖氨酸的哌啶甲酸。Schwecke等[17]指出, 负责编码环化脱氨酶的rapL可能负责L-赖氨酸直接转变为L-哌啶甲酸, 而FK520基因簇上rapL的同源基因是fkbL。Gatto等[18]报道RapL具有L-赖氨酸环化脱氨酶的活性, RapL作用底物是L-赖氨酸, 辅助因子为烟酰胺。通过测定RapL的体外反应动力学的数据, 提出RapL(FkbL)作用于L-赖氨酸环化脱氨酶的酶催化的反应机制。其催化过程如图 6所示:NAD+与FkbL蛋白结合, 可辅助催化L-赖氨酸发生氧化作用, 而NAD+转变为还原态NADH;氧化后的亚氨基酸在FkbL的活性位点完成分子内环化和脱氢反应;最后, NADH为环化亚胺的环化作用提供还原氢, L-赖氨酸则可以从蛋白解离, 而NAD+可循环参与下一轮的催化反应。
 |
| 图 6 L-赖氨酸环化脱氨酶RapL(FkbL)的酶催化反应机理[18] Figure 6 Catalytic mechanism of RapL(FkbL)[18] |
|
图选项
|
子囊霉素是由日本藤泽(Fujiasawa)制药公司于1962年首次从吸水链霉菌Streptomyces hygroscopicus No.KK317的发酵液中提取得到的。2007年, Parveen等[19]改变种子培养基和发酵培养基的成分及比例, 优化了Streptomyces hygroscopicus 的发酵培养通气量和温度, 并在发酵过程中添加一定量的糊精使得子囊霉素产量达到了350~400 mg/L。
目前, 国内对发酵法生产子囊霉素的研究主要关于诱变选育突变菌株和发酵条件的优化。2008年, 穆[20]等诱变筛选获得了诱变菌株M-7-21, 子囊霉素产量约为原始产生菌的5倍, 并研究了在发酵过程中添加莽草酸作为前体物质, 最终产量达到131.7 mg/L。2012年, Qi等[2, 21]通过钛宝石激光系统对出发菌株 NT2-11 进行诱变选育子囊霉素高产突变株, 建立了最适宜的诱变条件, 并选育出了稳定遗传的子囊霉素高产突变菌株FS35, 其产量提高了45%, 达到了240 mg/L。2013年, 本课题组将吸水链霉菌莽草酸耐受筛选及外源添加优化应用于提高子囊霉素产量的研究中, 获得了高产子囊霉素突变株SA68[22], 在最优莽草酸添加条件下, 子囊霉素产量提高到了450 mg/L, 提高了66.7%。为了深入揭示莽草酸耐受和添加对子囊霉素合成的影响, 对子囊霉素发酵特性、相关酶活、代谢物和基因转录水平进行了解析和评估。确定了高产子囊霉素的潜在靶标:增强DAHPS酶活提高莽草酸代谢通量, 消除芳香族氨基酸(色氨酸、酪氨酸和苯丙氨酸)对DAHPS的反馈抑制作用, 过表达fkbO基因增强FkbO酶活以提高子囊霉素合成前体DHCHC的合成通量。这些潜在靶标的揭示为我们工程改造高产子囊霉素菌株提供了指导价值。此外, 在选育高产菌株的同时, 大孔吸附树脂HP-20添加结合代谢轮廓分析被用来改进子囊霉素发酵工艺。在发酵24 h添加5%(质量体积比)吸附树脂HP-20, 发酵效果最佳, 子囊霉素产量从300 mg/L提高到380 mg/L。进一步利用基于GC-MS代谢轮廓分析手段, 动态对比了菌体在2种不同培养条件下(正常发酵和添加树脂发酵)的胞内代谢水平及子囊霉素合成水平, 解析了菌株在树脂条件下高产子囊霉素的代谢状态, 确定了子囊霉素进一步提高的潜在限制因素。进而对发酵培养基进行理性改进:24 h添加2%(体积比)正十六烷、48 h添加1.0 g/L的缬氨酸和72 h添加0.6 g/L的赖氨酸, 子囊霉素产量提高到了460 mg/L, 提高了53%[23]。
5 总结与展望近年来, 虽然对子囊霉素菌株改造和发酵的生产研究投入了大量的精力, 但子囊霉素产量低、生产周期长、中间产物复杂、生产成本高等传统问题依旧亟待解决。除了传统的诱变育种获得高产菌种和优化发酵培养基以及条件的控制, 系统生物学、合成生物学等学科的应用已经成为目前控制微生物代谢, 提高微生物代谢产物产量的有效手段。今后, 可以从以下两方面入手构建高产FK520工程菌株:
1) 通过构建高精度、FK520代谢网络模型, 采用代谢组学结合通量组学的研究方法, 分析子囊霉素整个代谢途径, 确定子囊霉素生物合成的限速步骤和关键靶点, 对FK520生物合成相关靶基因进行基因工程改造, 进而获得子囊霉素的高产菌株。
2) 随着合成生物学的蓬勃发展, 可以建立子囊霉素人工合成途径系统, 从生物元件库中募集不同来源的高效催化元件构建多酶耦合体系, 应用蛋白纳米纤维和病毒颗粒包装蛋白构建新的通用型、纳米尺度、串联的“蛋白脚手架”, 在元件比例、类型等方面进行精确组合设计, 对人工合成途径中的催化元件进行有序“铆定”, 建立高效的多酶耦合催化系统, 使更多的代谢流流向子囊霉素的合成途径, 阻断或减少代谢流流向副产物合成途径, 提高子囊霉素的产量和药效, 最终获得高效子囊霉素合成菌株。
| [1] | Sierra P G, Sierra M G. Ascomycin and FK506:Pharmacology and therapeutic potential as anticonvulsants and neuroprotectants[J]. CNS Neuroscience & Therapeutics , 2008, 14 : 36–46. |
| [2] | 齐海山. 子囊霉素高产菌株选育及本征动力学研究[D]. 天津:天津大学, 2012 Qi Haishan. Study on the breeding of high-yielding strain and intrinsic kinetics for ascomycin[D]. Tianjin:Tianjin University, 2012(in Chinese) |
| [3] | 杨文革, 陈林, 雷子瑜, 等. 发酵法生产子囊霉素的研究进展[J]. 化工进展 , 2010 , 29 (7) : 1309–1313. Yang Wenge, Chen Lin, Lei Ziyu, et al. Progress in production of ascomycin via fermentation[J]. Chemical Industry and Engineering Progress , 2010, 29(7) : 1309–1313. |
| [4] | 吴绍熙, 郭宁如. 大环内酯类免疫抑制剂研究进展[J]. 中国新药杂志 , 2001 , 10 (8) : 566–569. Wu Shaoxi, Guo Ningru. Progress in macrolide immunosuppressant[J]. Chinese New Drugs Journal , 2001, 10(8) : 566–569. |
| [5] | Wu K, Chung L, Pevill W P, et al. The FK520 gene cluster of Streptomyces hygroscopicus var^ ascomyceticus (ATCC 14891) contains genes for biosynthesis of unusual polyketide extender units[J]. Gene , 2000, 251 : 81–90. DOI: 10.1016/S0378-1119(00)00171-2 |
| [6] | Sang J M, Young J Y, Yeon H B. Roles of fkbN in Positive regulation and tcs7 in negative regulation of FK506 biosynthesis in Streptomyces sp^ Strain KCTC 11604BP[J]. Applied and Environmental Microbiology , 2012, 78 : 2249–2255. DOI: 10.1128/AEM.06766-11 |
| [7] | Carlos B, Miriam M C. Trends in the biosynthesis and production of the immunosuppressant tacrolimus (FK506)[J]. Applied Microbiology and Biotechnology , 2014, 98(2) : 497–507. DOI: 10.1007/s00253-013-5362-3 |
| [8] | Gatto G J, Mcloughlin S M, Wash C T, et al. Elucidating the substrate specificity and condensation domain activity of FkbP, the FK520 pipecolate-incorporating enzyme[J]. Biochemistry , 2005, 44(16) : 5993–6002. DOI: 10.1021/bi050230w |
| [9] | Dušan G, Marko B, Vasilka M, et al. FK506 biosynthesis is regulated by two positive regulator elements in Streptomyces tsukubaensis[J]. BMC Microbiology , 2012, 12 : 238–252. DOI: 10.1186/1471-2180-12-238 |
| [10] | 陈单丹, 岑沛霖, 刘文, 等. 大环内酯类免疫抑制剂他克莫司的生物合成机制研究进展[J]. 有机化学 , 2013 , 33 : 1254–1262. Chen Dandan, Cen Peilin, Liu Wen, et al. Progress in studing the biosynthetic mechanicm of the macrolide immunosuppressant tacrolimus[J]. Chinesse Journal of Organic Chemistry , 2013, 33 : 1254–1262. DOI: 10.6023/cjoc201212004 |
| [11] | Paiva N L, Roberts M F, Demain A L. The cyclohexane moiety of rapamycin id derived from shikimic acid in Streptomyces-hygroscopicus[J]. Journal of Industrial Microbiology & Biotechnology , 1993, 12 : 423–428. |
| [12] | Andexer J N, Kendrew S G, Mohammad N E A, et al. Biosynthesis of the immunosuppressants FK506, FK520, and rapamycin involves a previously undescribed family of enzymes acting on chorismate[J]. Proceedings of the National Academy of Sciences , 2011, 108(12) : 4776–4781. DOI: 10.1073/pnas.1015773108 |
| [13] | Lowden P A S, Bohm C A, Staunton J, et al. The nature of the stater unite for the rapamycin polyketide synthase[J]. Angew Angewandte Chemie International Edition , 1996, 35 : 2249–2251. DOI: 10.1002/(ISSN)1521-3773 |
| [14] | Carroll B J, Moss S J, Floss H G. Identification of a set of genes involved in the formation of the substrate for the incorporation of the unusual "glycolate" chain extension unit inansamitocin biosynthesis[J]. Journal of the American Chemical Society , 2002, 124 : 4176–4177. DOI: 10.1021/ja0124764 |
| [15] | Chan Y A, Boyne M T, Podevel A M, et al. Hydroxymalonylacyl carrier protein (ACP) and aminomalonyl-ACP are two additional type I polyketide synthase extender units[J]. Proceedings of the National Academy of Sciences , 2006, 103(39) : 14349–14354. DOI: 10.1073/pnas.0603748103 |
| [16] | Paiva N L, Demain A L, Roberts M F. The immediate precursor of the nitrogen-containing ring of rapamycin is free pipecolic acid[J]. Enzyme and Microbial Technology , 1993, 15 : 581–585. DOI: 10.1016/0141-0229(93)90020-3 |
| [17] | Schwecke T, Aparicio J F, Molnar I, et al. The biosynthetic gene cluster for the polyketide immunosuppressant rapamycin[J]. Proc Natl Acad Sci USA , 1995, 92 : 7839–7843. DOI: 10.1073/pnas.92.17.7839 |
| [18] | Gatto G J, Boyne M T, Wash C T, et al. Biosynthesis of pipecolic acid by RapL, a lysine cyclodeaminase encoded in the rapamycin gene cluster[J]. Journal of the American Chemical Society , 2006, 128(11) : 3838–3847. DOI: 10.1021/ja0587603 |
| [19] | Parveen K, Kumar S S, Kumar M H, et al. An improved fermentation process for preparing ascomycin:WO, 029082[P]. 2007-03-15 |
| [20] | 穆云龙, 余旭亚, 孟庆雄. 莽草酸对子囊霉素生物合成的影响[J]. 中国抗生素杂志 , 2008 , 6 (23) : 3–4. Mu Yunlong, Yu Xuya, Meng Qingxiong. Effect of shikimic acid on the ascomycin biosynthesis[J]. Chinese Journal of Antibiotics , 2008, 6(23) : 3–4. |
| [21] | Qi H, Xin X, Wen J, et al. Higher-Lever production of ascomycin(FK520) by Streptomyces hygroscopicus var^ ascomyceticus irradiated by femtosecond laser[J]. Biotechnology and Bioengineering , 2012, 17 : 770–779. |
| [22] | Qi H, Zhao S, Wen J, et al. Analysis of ascomycin production enhanced by shikimic acid resistance and addition in Streptomyces hygroscopicus var^ ascomyceticus[J]. Biochemical Engineering Journal , 2014, 82 : 124–133. DOI: 10.1016/j.bej.2013.11.006 |
| [23] | Qi H, Zhao S, Wen J, et al. Enhancement of ascomycin production in Streptomyces hygroscopicus var^ ascomyceticus by combining resin HP20 addition and metabolic profiling analysis[J]. Journal of Industrial Microbiology , 2014, 41(9) : 1365–1374. DOI: 10.1007/s10295-014-1473-9 |