在种类多样的糖基化修饰中, 鼠李糖基化修饰是很重要的一种, 且取代形式多样.如许多发现的天然化合物是在常见的黄酮类或萜类苷元分子上直接引入单个鼠李糖基取代; 另外有一些天然化合物是在糖苷类天然产物结构基础上进一步引入鼠李糖基取代形成的双糖苷产物, 例如:牡荆素鼠李糖苷、橙皮苷、柚皮苷等; 还有一些鼠李糖苷产物可能是多个鼠李糖基/糖基修饰的化合物, 如: 2"-O-Rhamnosylicariside Ⅱ等.药理学研究显示, 许多鼠李糖苷类化合物均表现出了显著的药理学活性, 如:分离自Myrtus communis叶片中的杨梅素-3-O-鼠李糖苷(1), 能通过调节细胞的氧化应激反应和DNA损伤修复参与到细胞的防御体系中[6]; 花旗松素-7-O-鼠李糖苷(2)与头孢他啶联合作用时, 能显著抑制已产生甲氧西林抗药性的金黄色葡萄球菌的生长[7]; 槲皮素-7-O-鼠李糖苷(3)对猪源性腹泻病毒的复制有较强的抑制作用[8], 其结构类似物槲皮素-3-O-鼠李糖苷(4, quercetin-3-O-rhamnoside)对人流感A/WS/33病毒也表现出了较好的抑制作用[8, 9]; 山奈酚-3-O-鼠李糖苷(5, kaempferol-3-O-rhamnoside)广泛分布于多种植物中, 也是目前报道的药理学活性最广泛的鼠李糖苷类化合物, 研究显示, 其能够作为小肠SGLT1协同转运蛋白的竞争性抑制剂, 从而抑制小肠上皮细胞对葡萄糖的吸收[10]; Diantini等[11]研究发现, 化合物5还能通过激活Caspase级联反应从而抑制MCF-7乳腺癌细胞的增殖; Sharoar等[12]报道发现, 化合物5能够通过对单聚体和多聚体进行重构从而消除β淀粉样蛋白的毒性, 从而有望成为治疗阿兹海默症的小分子药物; 在化合物5的结构基础之上进行进一步修饰, 在鼠李糖的2-OH和4-OH分别引入一个香豆酰基取代, 所获得的衍生物能够抑制NorA介导的药物外排作用, 从而在临床上改善细菌对抗生素类药物产生的耐药性[13].
此外, 有报道发现, 在化合物5的7位羟基再引入一个鼠李糖基取代, 所生成的的黄酮醇双糖苷山奈酚-3-O-鼠李糖-7-O-鼠李糖苷(6, kaempferol-3-O-rhamnoside-7-O-rhamnoside)在拟南芥体内能够作为内源性的生长素转运抑制剂参与调节植物生长发育[14].还有报道的鼠李糖基化内酯类化合物(7, 8)及1-O-乙酰基吡喃鼠李糖苷类化合物(9), 它们能够抑制3α-羟基类固醇脱氢酶的活性, 而后者参与在花生四烯酸生物合成途径中, 是寻找抗炎药物的重要靶点; Bols等[15]报道鼠李糖基化蒽醌类化合物aranciamycin (10)能通过抑制吉田氏肿瘤的DNA复制从而抑制肿瘤生长.
综上, 结构多样的鼠李糖苷类化合物是药用活性先导物的重要来源, 且在调节植物体内激素水平、维持细胞结构、信号传导及化学防御等方面发挥着不可替代的作用, 对该类化合物进行研究具有重要意义[16].
化学法及酶法是目前对化合物进行鼠李糖基化修饰的主要方法.利用化学法进行鼠李糖基修饰早有研究, 使用最广泛的糖基供体为卤代糖, 以三乙酰-L-鼠李糖溴代糖(或氯代糖)和各种酚类化合物为反应物, 在银盐或汞盐催化下进行糖基化反应, 然后将得到的糖基化产物经甲醇钠脱酰化可实现酚羟基上的鼠李糖基修饰(Scheme 1A).但这种方法收率较低, 且所用到的重金属盐类催化剂毒性较大[17].此外较常用的方法是利用四乙酰基鼠李糖在酸催化下直接糖基化, 然后经过甲醇钠脱酰化得到鼠李糖基化产物(Scheme 1B)[18].但由于糖基供体上羟基较多, 利用化学方法进行糖基化修饰都不免要涉及到糖基供体的酰化和去酰化, 反应过程不易操控, 且环境不友好, 此外化学催化糖基化反应的位置特异性较差, 相比之下, 酶法糖基化由于具有反应效率高、位置特异性强、反应条件温和、后处理简单、环境友好等优点, 从而成为化学法的有力补充, 在许多化学修饰难以实现的反应中发挥越来越大的作用.
图 1
图式 1
催化糖基化反应的酶统称为糖基转移酶(Glycosyl- transferase, GT, EC 2.4.x.y).它是通过合成糖苷键将活性糖基从核苷糖转移到特定受体的一类酶, 其广泛存在于各种原核生物、真核生物、古生物和病毒中, 能识别不同受体和供体形成结构多样的产物.根据氨基酸序列相似度可将糖基转移酶家族划分为至少103个超家族[19], 目前已鉴定最多的是葡萄糖基转移酶, 其识别UDP-葡萄糖(Uridine Diphosphate-Glucose, UDP-Glc)作为糖基供体[20].从广义上讲, 鼠李糖基转移酶也是糖基转移酶中重要的一类酶, 通常以NDP-鼠李糖(Nucleoside Diphosphate-Rhamnose, NDP-Rha)为供体, 参与鼠李糖苷类化合物的生物合成, 其中最常见的活性糖基供体包括尿苷二磷酸-鼠李糖(Uridine Diphosphate- Rhamnose, UDP-Rha)和胸苷二磷酸-鼠李糖(Thymidine Diphosphate-Rhamnose, TDP-Rha)[21].
关于糖基转移酶的研究进展已有较多文献涉及[16, 22, 23], 而对于这一类特定的鼠李糖基转移酶, 其相关研究进展国内外尚无专门的综述.本文对目前已报道的来源自植物及微生物中的鼠李糖基转移酶从酶催化功能、蛋白三维结构、鼠李糖基供体合成、酶催化底物杂泛性以及其在代谢工程中的应用等方面进行了综述, 以期对这类化合物的合成修饰及深入研究提供借鉴.
2. 鼠李糖基转移酶功能研究
目前报道的与活性小分子鼠李糖基化修饰相关的鼠李糖基转移酶主要来自于植物及微生物.通过生物信息学分析及各种分子生物学手段, 已从植物及微生物中鉴定了多种鼠李糖基转移酶基因, 它们广泛参与到结构多样性次生代谢产物的生物合成中, 同时与细胞结构维持及生物体内的许多生理功能紧密相关.
2.1 植物来源鼠李糖基转移酶的功能研究
黄酮类化合物是植物中普遍存在的次生代谢产物, 大多数以糖基化形式存在.与苷元相比, 黄酮苷具有更好的稳定性、生物活性和溶解度[24].黄酮的糖基化修饰多发生在活泼羟基, 部分直接连接在骨架的碳原子上.目前已报道的植物来源的鼠李糖基转移酶多与黄酮类化合物(包括花青素类化合物)的糖基化修饰相关.如已从拟南芥、大豆、玉米、牵牛花、葡萄、淫羊藿属、柑橘属等植物中克隆并鉴定了多种鼠李糖基转移酶, 植物来源的鼠李糖基转移酶可催化黄酮类不同位置酚羟基的鼠李糖基化反应生成多种糖苷类化合物.
2.1.1 模式植物拟南芥中鼠李糖基转移酶研究
拟南芥是目前分子克隆研究最多的模式植物, 借助于其清晰的遗传背景, 已从中鉴定了多条鼠李糖基转移酶基因.如Jones等[25]通过同源比对的方法从拟南芥中克隆获得UGT78D1基因, 并构建了UGT78D1基因缺陷植株, 与野生型进行代谢产物对比发现, 突变植株失去了合成黄酮醇-3-O-鼠李糖苷及其衍生物的能力.进一步将UGT78D1在大肠杆菌(Escherichia coli, E. coli)中进行外源表达, 体外酶促催化反应发现重组蛋白能分别催化槲皮素和山奈酚的3-OH位鼠李糖基化生成槲皮素-3-O-鼠李糖苷(4)和山奈酚3-O-鼠李糖苷(5), 为黄酮醇- 3-O-鼠李糖基转移酶(Scheme 2); Yonekura-Sakakibara等[21]通过转录组共表达分析及转基因植株的构建, 发现拟南芥中的UGT89C1基因与黄酮醇-7-O-鼠李糖苷的生成密切相关, 且UGT89C1蛋白只能接受UDP-Rha作为糖基供体, 催化黄酮醇苷(3-O-糖苷, 包括单糖苷和双糖苷)在其7-OH位再引入一个鼠李糖基取代(Scheme 2), 当以黄酮醇苷元或花青素作为底物时, 反应不能发生.
图式 2
2.1.2 传统农作物玉米、大豆中鼠李糖基转移酶研究
得益于基因测序技术的飞速发展, 除模式植物拟南芥外, 作为主要的农作物, 大豆和玉米的全基因组测序也已经完成, 基因序列的获得以及生物信息学分析技术的进步, 为从这些植物中获得不同的次级代谢酶提供了便利.如Rojas等[26]从大豆中克隆了黄酮醇3-O-葡萄糖苷(1→6)鼠李糖基转移酶GmF3G6"R, 其能以UDP-Rha为糖基供体, 催化山奈酚或槲皮素的3-O-葡萄糖苷/半乳糖苷在其糖分子的6-OH位发生鼠李糖基化, 为一类黄酮醇3-O-葡萄糖苷(1→6)鼠李糖基转移酶; McMullen等[27]通过经典遗传学、基因座定位(quantitative trait locus, QTL)以及分析化学的方法鉴定了位于玉米2号染色体上的第二个sm基因座sm2, 推测其可能编码鼠李糖基转移酶, Casas等[28]进一步从sm2基因座中克隆得到了糖基转移酶UGT91L1的编码基因, 酶功能鉴定结果表明UGT91L1能以UDP-Rha作为底物, 催化异荭草素转化成2"-O-鼠李糖基异荭草素, 后者是玉米中抗虫害成分maysin生物合成的重要前体.
2.1.3 药用植物淫羊藿中鼠李糖基转移酶研究
模式植物中多种糖基转移酶的获得为这类酶序列与功能的研究奠定了基础, 对其蛋白保守域的分析也为从许多药用植物中挖掘与药用活性成分生物合成相关的糖基转移酶提供了可能.
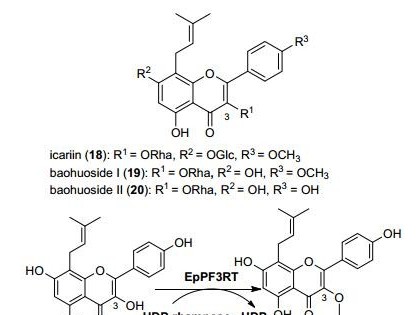
淫羊藿作为传统中药, 具有治疗肾虚和强筋壮骨的疗效.其主要活性成分淫羊藿苷(18, icariin)、宝霍苷Ⅰ (19, baohuoside Ⅰ)、宝霍苷Ⅱ (20, baohuoside Ⅱ)为黄酮苷类化合物, 其苷元均为含异戊烯基取代的黄酮醇类, 3-OH位为位置特异性的鼠李糖基取代. Feng等[29]从拟巫山淫羊藿中克隆中获得了鼠李糖基转移酶EpPF3RT的基因, 并在大肠杆菌中实现了该基因的异源表达.体外酶促催化反应发现EpPF3RT能够以UDP-Rha为供体, 以异戊烯基取代的黄酮醇类化合物为受体, 位置特异性的催化3-OH位发生鼠李糖基取代反应(图 2).但当受体为黄酮苷类化合物时, 反应不能发生, 说明EpPF3RT具有严格的底物特异性和催化位置特异性, 可用作制备活性黄酮醇鼠李糖苷类化合物的生物催化剂.
图 2
2.1.4 柑橘属植物与果实风味相关鼠李糖基转移酶研究
上述鼠李糖基转移酶所催化合成的小分子多与植物生理功能密切相关, 同时也有诸多报道显示, 植物中的鼠李糖基转移酶还能影响其花(如花的颜色)或果实(如果实风味)的性状特征.例如:苦味的轻重是柑橘属植物品种选育及优化中所参考的重要依据, 而影响植物果实苦味程度的是其中的黄酮苷类化合物的组成, 其决定性因素是两类鼠李糖基转移酶:它们都以二氢黄酮-7-O-葡萄糖苷为底物, 一类催化葡萄糖C-2位羟基发生鼠李糖基取代, 生成具有明显苦味的二氢黄酮-7-O-新橙皮苷类化合物, 这类酶主要存在于柚子、葡萄柚等苦味较明显的植物中.另一类催化葡萄糖C-6位羟基发生鼠李糖基取代, 生成无苦味的二氢黄酮-7-O-芸香苷类化合物, 这类酶主要存在于橙子、橘子等无苦味的柑橘属植物中.
Frydman等对决定果实风味的这一类关键酶进行了深入研究, 分别从苦柚Citrus maxima和甜橙Citrus sinensis中克隆获得了催化这两类反应的鼠李糖基转移酶Cm1, 2RhaT[30, 31]和Cs1, 6RhaT[32]的编码基因(Scheme 3). Cm1, 2RhaT能够催化二氢黄酮/黄酮-7-O-葡萄糖苷在葡萄糖糖分子2-OH位发生位置特异性鼠李糖基化, 生成黄酮-7-O-新橙皮苷类化合物如柚皮苷, 新橙皮苷, 圣草苷和枸橼苷, 但当受体为黄酮醇苷类化合物时, 鼠李糖基化反应不能发生. Cs1, 6RhaT催化黄酮苷类化合物在葡萄糖分子6-OH位发生位置特异性的鼠李糖基化, 该酶的底物谱相对更广泛, 包括黄酮苷、二氢黄酮苷、黄酮醇苷、花色素苷类化合物(同时包括7-O-葡萄糖苷和3-O-葡萄糖苷)均能被催化生成相应的黄酮芸香苷产物, 如柚皮芸香苷, 橙皮苷, 圣草次苷等.此外, 最新的研究从甜橙中分离出一个黄酮醇鼠李糖基转移酶CsUGT76F1, 该酶能催化槲皮素和山奈酚在7-OH位发生鼠李糖基化, 而且过表达CsUGT76F1可显著提高槲皮素-7-O-鼠李糖苷和山奈酚7-O-鼠李糖苷在体内的积累[33].这一系列研究为柑橘属植物品种选育及驯化提供了重要理论依据.
图式 3
2.1.5 花青素及其它类型化合物合成相关鼠李糖基转移酶研究
花青素是植物体内产生的一类重要的次级代谢产物, 属于黄酮类化合物, 为天然水溶性色素, 可以使花和果实呈现出红、紫和蓝等系列颜色, 而这些颜色是植物吸引昆虫进行授粉等行为所不可缺少的条件.此外, 花青素还有助于植物抵御紫外线辐射、强光、低温、营养缺乏等逆境胁迫.在花青素的生物合成途径中, 糖基化修饰是重要的一步后修饰反应, 通常可增强花青素的稳定性与水溶性[34].目前已经分别从牵牛花[35]和荔枝[36]中克隆鉴定了与花青素类化合物糖基化修饰相关的鼠李糖基转移酶3RT与LcFGRT4, 它们均能催化矢车菊素-3-葡萄糖苷鼠李糖基化生成矢车菊素-3-芸香糖苷; Li等[37]从拟南芥中克隆获得了鼠李糖基转移酶UGT79B2和UGT79B3, 其能特异性催化矢车菊素/矢车菊素-3-O-葡萄糖苷的鼠李糖苷化, 低温或外界环境胁迫下, 两个蛋白的表达量明显上升, 说明UGT79B2/B3能够通过自身过表达调节花青素在细胞中的积累量, 从而提高植物对非生物胁迫的耐受性.此外, 在六倍利Lobelia erinus中发现了能够催化飞燕草素-3-O-葡萄糖苷生成飞燕草素3-O-芸香糖苷的鼠李糖基转移酶[38].
除黄酮类和花青素类化合物外, 植物中鉴定的鼠李糖基转移酶也有参与其它结构类型化合物结构修饰的报道.如McCue等[39]通过EST序列同源比对的方法从马铃薯cDNA中分离得到一个编码鼠李糖基转移酶SGT3的基因, 通过反向遗传学分析发现SGT3能够催化β-茄碱/β-卡茄碱生成α-茄碱/α-卡茄碱, 与马铃薯中有毒类成分甾体糖苷类生物碱的生物合成相关.
2.1.6 与维持植物细胞结构相关鼠李糖基转移酶研究
除上述参与天然小分子化合物的生物合成或糖基化修饰外, 鼠李糖基转移酶还与植物细胞结构的维持密切相关.果胶是一种富含于植物细胞壁以及胞间层的多糖, 它在植物细胞生长、细胞间粘附、形态发生和气孔开合中起重要作用.植物细胞壁中的果胶由三个结构域组成:聚半乳糖醛酸、鼠李糖半乳糖醛酸(RG)RG-Ⅰ和RG-Ⅱ.其中, 鼠李糖基转移酶参与RG-Ⅰ骨架的生物合成. Uehara等[40]制备了不同聚合度的RG-I骨架寡糖, 使用这些寡糖为底物, 以UDP-β-L-Rha为供体, 从红豆中检测到参与RG-Ⅰ主链二糖基重复单元(-4GalUAα1- 2Rhaα1-)生物合成的鼠李糖基转移酶RRT. RRT位于高尔基体和内质网, 其活性与植物上胚轴的生长呈正相关, 证实RG-Ⅰ的合成与植物生长密切相关.
综上所述, 植物来源的鼠李糖基转移酶已取得了较大进展, 但仍存在如下问题: (1)目前已鉴定功能的鼠李糖基转移酶仍为少数, 因此还无法通过多序列比对分析来总结出鼠李糖基转移酶的特征性保守序列; (2)鼠李糖基转移酶从大类上讲为糖基转移酶, 这类酶的序列保守区域已有较深入的研究, 但目前利用保守序列扩增的方法获得的大部分都是葡萄糖基转移酶, 至今仍没有特异性的针对鼠李糖基转移酶的有效扩增方法; (3)许多糖基转移酶具有催化不同类型糖基化反应的能力, 但这一酶活性评价需要有不同结构类型糖基供体的参与, 而相对于已商业化生产的葡萄糖基供体来说, 鼠李糖基供体的来源非常有限, 且合成困难, 这在很大程度上限制了更多鼠李糖基转移酶的鉴定; (4)植物的遗传背景庞大, 且基因并不成簇存在, 除了拟南芥等模式生物的功能基因有较系统的研究外, 在其它植物中寻找具有特定功能的基因仍有较大的难度和挑战性, 如能针对某些已完成基因组测序的植物, 例如番茄或水稻、小麦等, 开展大规模糖基转移酶功能基因组研究, 克隆出所有能催化鼠李糖基化的鼠李糖基转移酶, 并对其序列-功能进行分析, 找出其序列特征性, 可为后续的研究提供非常好的指导; 另外, 目前植物中鼠李糖基转移酶的研究多数集中在体外生化功能的确定上.而植物体内的生理生化环境是一个非常复杂的体系, 很多因素如辅因子、蛋白互作、复杂的代谢通路等, 都会影响酶的生物活性和理化性质.因此通过生化方法对糖基转移酶活性及生理功能的体外研究结果与体内是否一致, 还需要做大量的确证.
2.2 微生物来源鼠李糖基转移酶的功能研究
微生物是活性天然产物的重要来源, 在抗生素、免疫调节剂、酶抑制剂等药物研发中发挥着必不可少的作用.目前已知的许多来源自微生物的活性分子都含有鼠李糖基取代, 它们在临床药用、微生物结构及生理功能的调节中发挥重要作用.
抗生素是最具代表性的微生物来源药物, 且富含糖基化修饰是抗生素类化合物最显著的结构特征之一.与植物相比, 微生物的遗传背景更为清晰, 功能基因大多成簇存在, 且分子操作比较容易.另一方面由于三代测序技术的飞速发展, 越来越多微生物来源的鼠李糖基转移酶基因得以揭示.其中包括多条与抗生素类化合物(如蒽环类抗生素、大环内酯类抗生素、烯二炔类抗生素等)生物合成相关的糖基转移酶基因.
2.2.1 蒽环类抗生素合成相关鼠李糖基转移酶研究
蒽环类抗生素是其中重要的一种, 分离自链霉菌属Streptomyces, 临床被广泛应用于治疗乳腺癌、小细胞肺癌、急性髓性白血病、胰腺癌、胃癌等[41].其代表性化合物aranciamycin (10)及steffimycin (11)由一分子蒽环配基通过糖苷键与一分子甲基鼠李糖组成, 构效关系研究显示, 糖链部分在抗生素分子与DNA拓扑异构酶Ⅱ的识别与相互作用中发挥重要作用, 是其行使生物功能的关键[42].
Luzhetskyy等[41]对S. echinatus中编码化合物10生物合成的基因簇进行了克隆和测序, 序列分析筛选出一条编码糖基转移酶的基因AraGT可能与化合物10结构中鼠李糖基的引入相关. Sianidis等[43]进一步从S. echinatus ssp.中克隆获得了AraGT基因, 并在E. coli中进行了外源表达, 纯化获得大小为45 kDa的蛋白, 酶功能鉴定结果表明, 该酶能够以2-O-甲基-L-Rha为糖基供体, 催化anthracycline苷元生成目的抗生素10.
Gullón等[44]通过基因簇序列分析从S. steffisbur- gensis NRRL 3193中表征了可能与抗生素steffimycin 11生物合成相关的基因簇, 该基因簇含有15个开放阅读框, 将其与一个鼠李糖供体合成酶基因在S. albus中共表达, 成功生成了目的产物11.利用基因敲除技术将该基因簇中一个编码糖基转移酶的基因StfG敲除后, 菌体只能产生苷元结构类似物, 证实StfG基因所编码的糖基转移酶与化合物11中鼠李糖基的取代相关.
Elloramycin也是一种分离自链霉菌S. olivaceus Tu 2353的蒽环类抗生素, 具有抵抗革兰氏阳性细菌的作用, 同时也有较强的抗肿瘤活性. Decker等[45]从S. olivaceus染色体DNA文库中分离得到16F4粘粒, Blanco等[46]进一步在S. lividans TK64中表达了16F4粘粒, 并通过分子杂交从16F4中扩增了与elloramycin生物合成相关的鼠李糖基转移酶ElmGT编码基因, 功能鉴定显示ElmGT可催化8-去甲基特曲霉素C (8-demethyltetracenomycin C, 8-DMTC)的鼠李糖苷化, 为elloramycin生物合成中的关键步骤.
2.2.2 大环内酯类抗生素合成相关鼠李糖基转移酶研究
大环内酯类抗生素是放线菌产生的次级代谢产物, 其化学结构由12-, 14-或16-元大环内酯环及1到多个6-脱氧己糖单元构成, 竹桃霉素(oleandomycin)和红霉素(erythromycin)是典型的14-元大环内酯类抗生素. oleG2是竹桃霉素合成途径中编码糖基转移酶的基因, Doumith等[47]在Saccharopolyspora erythraea中将该基因进行了过表达, 合成了一种含有L-鼠李糖(L-rhamnose)的新红霉素衍生物3-L-鼠李糖-6-去氧红霉素B (3-L-rhamnosyl-6-deoxyerythromycin B)(图 3).
图 3
2.2.3 烯二炔类抗生素合成相关鼠李糖基转移酶研究
烯二炔类抗生素被认为是迄今为止抗肿瘤活性最强的一类抗生素, 如来自放线菌小单孢菌(Micromonospora echinospora ssp calichensis)的卡利奇霉素(calicheamicins, CLM), 其对淋巴细胞白血病P388和L1210细胞以及实体瘤如结肠癌26和黑色素瘤B-16细胞均有极强的杀伤作用. CLM分子结构包含4个单糖取代, 通过与肿瘤细胞DNA结合转变为活性中间体, 使DNA脱氧核糖脱氢, 引起DNA裂解, 进一步诱导肿瘤细胞凋亡. CLM分子中的低聚糖片段作为卡利奇霉素的识别体和传递体, 在药物分子与DNA识别连接中发挥重要作用[48]. Zhang等[49]从放线菌小单孢菌中克隆了CalG1基因, 在大肠杆菌中进行了外源表达, 酶功能鉴定结果表明CalG1以TDP-β-L-Rha为供体时, 可催化无鼠李糖基取代的卡利奇霉素苷元生成相应的产物, 具有鼠李糖基转移酶的作用, 在卡利奇霉素的生物合成途径中发挥重要作用.而以TDP-α-L-Rha为供体时, 反应不能发生, 表明CalG1是一种具有立体选择性的糖基转移酶.
2.2.4 农用杀虫/杀菌素合成相关鼠李糖基转移酶研究
微生物来源的鼠李糖基转移酶除参与医疗用抗生素生物合成外, 还参与农业用杀虫、杀菌素的合成.多杀菌素(spinosad)是分离自放线菌刺糖多孢菌(Saccharopolyspora spinosa)的一种聚酮糖苷类化合物, 商业上主要作为杀虫剂的有效成分, 通过摧毁昆虫的神经系统来发挥杀虫作用.
发生在苷元spinosyn aglycone (AGL) 9-OH位的鼠李糖基修饰是多杀菌素生物合成途径中的关键步骤, 且对其活性的发挥起到至关重要的作用. Chen等[50]从刺糖多孢菌中克隆了鼠李糖基转移酶SpnG编码基因, 并在大肠杆菌中进行了异源表达.酶功能鉴定结果表明SpnG能够以TDP-Rha为供体, 催化AGL在9-OH处发生鼠李糖基取代反应, 生成spinosyn rhamnosyl pseudoaglycone (SRPG, 图 4).根据立体化学和氨基酸序列相似性, 将SpnG归类为CAZy (Carbohydrate-Active EnZYme)中的GT-1家族.此外, SpnG还表现出对NDP-糖基供体明显的选择宽泛性, 能够催化苷元产生相应的糖基化产物, 是一个潜在的用于生产活性更高/结构多样性多杀菌素类衍生物的生物催化剂.
图 4
来源于放线菌阿维链霉菌Streptomyces avermectinius的阿维菌素(avermectin)是一种有效的抗寄生虫药物, 能够通过激活神经递质γ-氨基丁酸来阻断寄生虫神经信号传递, 使其麻痹致死.阿维菌素结构中含有16元大环内酯母核骨架、多个碳碳双键与羟基及2个糖基(图 5).其糖基取代形式为齐墩果糖, 从广义上讲也属于鼠李糖基衍生物.阿维菌素对多种动物寄生虫及昆虫类、蛛形类生物均表现出很强的活性, 对全世界的农牧业生产起到了巨大的促进作用. 2003年, 大村智团队[51, 52]完成了S. avermectinius 全基因组序列的测定, 揭示了阿维菌素生物合成的关键基因.其生物合成大致分为4个过程:起始单元的合成; 在聚酮体合酶作用下合成起始糖苷配基; 聚酮体后修饰, 包括氧化、环化、还原、甲基化, 形成阿维菌素糖苷配基; 脱氧胸苷二磷酸-L-齐墩果糖(dTDP-L-oleandrose)与阿维菌素糖苷配基的连接.参与糖链合成的基因为aveB, 它与齐墩果糖(oleandrose)合成有关, 并通过糖基化作用使齐墩果糖结合到阿维菌素糖苷配基上最终成为阿维菌素.
图 5
2.2.5 与微生物胞外多糖合成相关鼠李糖基转移酶研究
细胞表面多糖广泛存在于细菌中, 它们或者与细胞膜相连形成脂多糖(lipopolysaccharides, LPSs), 或者与细胞壁共价结合形成荚膜多糖(capsular polysaccharides, CPSs), 或者直接分泌到胞外环境中形成胞外多糖(exopolysaccharides, EPS), 作为微生物适应环境的产物. EPS 139A是一种新型的胞外多糖, 产生自链霉菌Streptomyces sp.139, 在体内具有显著的抗风湿性关节炎活性, 其结构由低聚糖重复单位(含有8个糖残基包括鼠李糖, 半乳糖, 半乳糖醛酸甘露糖, 葡萄糖, 阿拉伯糖, 岩藻糖, 木糖)组成[53]. Wang等[54]对链霉菌中控制EPS 139A生物合成的基因簇进行了鉴定和表征, 该基因簇由22个ORF组成, 命名为ste1-ste22.根据与数据库中其他氨基酸序列比对发现ste22与糖基转移酶显示出高度同源性.随后Li等[55]克隆获得了ste22基因, 以pBV220为表达载体, 在E. coli中进行外源表达.酶功能鉴定表明重组蛋白能够特异性转移TDP-Rha到胞外多糖前体, 起到鼠李糖基转移酶的作用, 在EPS 139A的生物合成中起到关键作用, 也是目前分离鉴定的第一个与EPS合成相关的鼠李糖基转移酶.
2.2.6 与鼠李糖脂生物表面活性剂合成相关鼠李糖基转移酶研究
在种类多样的鼠李糖苷类化合物中, 鼠李糖脂生物表面活性剂必须占有重要的一席地位.生物表面活性剂是微生物在一定条件下培养时, 在其代谢过程中分泌出的具有一定表面活性的代谢产物, 如糖脂、多糖脂、脂肽或中性类脂衍生物等.其中, 由铜绿假单胞菌(Pseudomonaeruginosa)产生的鼠李糖脂是研究最广泛的生物表面活性剂, 不仅具有乳化、增溶、降低表/界面张力等功能, 而且毒性小, 易于生物降解, 因而在石油开采、医药、食品、日化及环境保护等许多领域具有极大的应用潜力[56].
鼠李糖脂的结构具有以下特征:其亲水基团一般由1~2分子的鼠李糖构成, 疏水基团则由1~2分子具有不同碳链长度的饱和或不饱和脂肪酸构成(图 6).研究表明, 鼠李糖基转移酶RhlB催化TDP-Rha和β-羟基脂肪酸生成单鼠李糖脂[57], 在此基础上又有一分子的TDP-Rha在鼠李糖基转移酶RhlC的催化下合成含两分子L-鼠李糖基的双鼠李糖脂[58].关于鼠李糖脂生物表面活性剂的研究国内外已有许多专门的文献进行综述[59], 在此文中不再详述.
图 6
2.2.7 与维持微生物细胞结构相关鼠李糖基转移酶研究
与植物类似, 微生物来源的鼠李糖基转移酶除参与微生物代谢产物的生物合成外, 也在维持微生物细胞的结构组成方面发挥作用.如肽聚糖是细菌细胞壁的重要组成部分, 由肽和聚糖两部分组成, 属于聚合物, 其肽聚糖单体的合成过程需要涉及到糖基转移酶催化的反应.以分枝杆菌为例, 细胞壁中的阿拉伯半乳聚糖负责连接肽聚糖与分枝菌酸层, 该聚糖单元的生物合成发生在10-异戊烯磷酸脂质中, 鼠李糖基转移酶WbbL负责催化鼠李糖基结合到10-异戊烯二磷酸连接的N-乙酰葡萄糖单元[60].突变实验证实, 肽聚糖的存在对细菌细胞壁发挥生理作用起到关键的作用, WbbL蛋白失活后, 分枝杆菌细胞不能再生存[61].
3. 鼠李糖基转移酶的蛋白三维结构研究
X射线三维结构分析能够提供准确的蛋白三维结构, 借助于“蛋白-底物”复合体的分析, 还能进一步揭示酶催化反应的机理及细节, 从而为目的蛋白在酶工程、基因工程等方面的应用奠定基础.鼠李糖基转移酶从大类上讲属于糖基转移酶的一种, 关于糖基转移酶的蛋白三维结构, 目前已有较深入的研究.虽然糖基转移酶家族成员众多, 但其空间结构类型主要包括两种形式, 从而形成两种超家族, 分别命名为GT-A超家族和GT-B超家族. GT-A超家族由一个类似Rossmann折叠的“α/β/α”结构域组成, 该结构域包含6个平行的β折叠[62], 其中C-末端结构域负责结合糖基受体, N-末端结构域负责结合NDP-糖基供体.具体的说, GT-A超家族在N-端有一个保守的“DXD (Asp-X-Asp)”模体, 该模体能够结合二价金属离子, 从而识别NDP-糖基供体的磷酸基团, 进而将供体锚定在蛋白结合域中.也因于此, GT-A超家族催化的糖基化反应多需要二价金属离子的参与.
与GT-A不同, GT-B超家族三维结构中含有两个独立存在的Rossmann结构域, 每个结构域均由“α/β/α”折叠组成, 两个结构域各自紧密堆积, C-末端结合供体底物, N-末端结合受体底物, 并在相连处形成一个较深的缝隙, 作为蛋白的主要活性区域. GT-B超家族催化糖基化反应不需要金属离子的参与.大部分来自细菌、植物的与次生代谢产物生物合成相关的糖基转移酶都属于GT-B超家族, 多利用尿苷二磷酸(Uridine diphosphate, UDP)活化的糖作为糖基供体, 属于UGTs (UDP-dependent Glycosyltransferases).这类蛋白最重要的结构特征是在C-端具有一个高度保守的PSPG (Plant Secondary Product Glycosyltransferase motif)序列.具体到鼠李糖基转移酶, 目前有明确蛋白晶体三维结构报道的有两个, 分别是分离自细菌的WsaF[63]和分离自放线菌的SpnG[64].
WsaF为β-1, 2-鼠李糖基转移酶, 参与革兰氏阳性菌嗜热脂肪芽孢杆菌Geobacillus stearothermophilus细胞表面S-layer糖蛋白聚合物的合成, 该聚合物中含有由三个鼠李糖相连组成的重复单元, 连接方式包括α-1, 3连接, α-1, 2连接和β-1, 2连接, WsaF催化其中β-1, 2-糖苷键的形成, dTDP-β-L-Rha为其活性糖基供体.在CAZy数据库中, WsaF注释到GT4家族.晶体结构测定表明, WsaF空间结构属于GT-B超家族, N端结构域由26~222位氨基酸组成, C端结构域由228~381位氨基酸组成, N端与C端之间的loop区由223~227位氨基酸组成.赖氨酸302和亮氨酸303能与鼠李糖基供体中胸腺嘧啶核苷的O(2)、N(3)和O(4)原子相互作用, 63位谷氨酸能够通过氢键与焦磷酸基团相互作用, 是糖基供体结合中的关键位点; N端为糖基受体结合腔, 通过分子对接分析发现, 254位精氨酸、64位甘氨酸和88位的天冬氨酸能够与受体形成氢键连接, 171位天冬氨酸和176位苯丙氨酸是受体结合腔中的活性位点, 这些位点突变后蛋白活性明显下降.此外, 值得一提的是, 结构分析显示, WsaF蛋白鼠李糖基供体结合区域325位脯氨酸处含有一个较少见的富含脯氨酸的“PHPSYPPLE”模体, 而这一模体在识别其他类型糖基供体的糖基转移酶中没有发现, 提示这一特殊的序列可能与鼠李糖基供体的识别密切相关.在WsaF的结构中, 没有发现与糖基供体接近的亲核氨基酸, 显示它的催化机制可能遵循SNi反应机制[63].
鼠李糖糖基转移酶SpnG在多杀菌素合成过程中负责将鼠李糖基连接到大环内酯母核上, 在其合成过程中是一个很重要的步骤, TDP-Rha为其特异的活性糖基供体, 且当TDP-糖基供体更换为UDP-糖基供体时, 蛋白催化活性显著下降[64, 65]. Isiorho等[64]对SpnG的蛋白三维结构进行了深入研究, 发现其蛋白空间结构也属于典型的GT-B超家族(图 7), 通过与其它糖基转移酶一级序列的比对, 进一步揭示了其特异性识别TDP-糖基供体的原因.
图 7
与TDP-糖基供体相比, UDP-糖基供体在核糖基的2'-位和3'-位均含有羟基取代.序列比对结果显示, 利用UDP-糖基供体的糖基转移酶序列中会含有谷氨酸残基, 它会与UDP核糖的2'-OH和3'-OH形成氢键从而与供体结合, 然而这一位置的谷氨酸残基在SpnG蛋白中被更小的亲脂性的苏氨酸(T300, 图 7箭头处)取代, T300会与202位天冬酰胺(N202)的NH2基团形成氢键, 空间上使其靠近供体结合区域, SpnG-TDP共结晶结构显示N202侧链会直接与脱氧核糖的3'-OH基团形成氢键.而当以UDP代替TDP时, UDP的2'-OH基团会与N202的NH2基团在空间上发生碰撞, 显示N202位氨基酸的空间位阻是SpnG不能接受UDP-Rha作为糖基供体的主要原因, N202也是蛋白区分识别TDP-Rha和UDP-Rha的关键位点. SpnG-AGL共结晶结果显示, SpnG酶与苷元底物AGL的结合是通过疏水相互作用介导的, 并且13位组氨酸(H13)在空间上与鼠李糖基化位点(AGL的9位羟基)非常接近, 推测H13为酶催化的关键位点(图 7*处).此外, SpnG蛋白中G293~G296处的焦磷酸结合域和D/E-Q模体(D316, Q317)对NDP-sugars的识别也具有重要作用(图 7中PPi-binding loop及D/E-Q motif).
Michaelis复合体模型的构建揭示SpnG可以接受结构多样的TDP-糖苷作为糖基供体, 在糖基转移反应过程中鼠李糖基基团处于扭船式(“skew-boat”)构象, 其可能的催化机制包括: H13激活苷元AGL的9-OH基团, 然后攻击TDP-L-鼠李糖的异头碳.晶体结构的获得将为研究功能未知的鼠李糖基转移酶并预测其催化功能成为可能, 并为新型鼠李糖基化天然产物的组合生物合成提供有价值的指导.
4. 鼠李糖基供体的合成研究
如上所述, 无论是体内或体外的鼠李糖基化反应, 都需要有鼠李糖基供体的参与.核苷二磷酸鼠李糖(NDP-Rha)为生物体能够识别的活性鼠李糖供体形式, 其中最为常见的是TDP-Rha和UDP-Rha, 但由于其合成路线复杂, 加之产物的不稳定, NDP-Rha并没有实现大规模商业化, 其来源也在很大程度上限制了鼠李糖基转移酶的研究和实际应用.酶法合成可为鼠李糖基供体的来源提供新方法, 因此本文对鼠李糖基供体的合成方法也进行了简要综述.
4.1 化学合成NDP-Rhamnose
目前NDP-Rha的化学合成方法主要有两种: (1) 1-磷酸-鼠李糖与活化的核苷5'-单磷酸(NMP)偶联.利用该方法, 已成功地合成了UDP-Rha和TDP-Rha.例如, Zhao等[66]将TMP-morpholidate与1-磷酸-鼠李糖反应, 并利用1H-四唑(1H-tetrazole)促进磷酸化(反应条件如Scheme 4A所示), 反应48 h TDP-Rha的产率达到74.7%, 此外, 还以1, 1'-羰基二咪唑(CDI)作为活化剂, 利用TMP制备了TMP-imidazolide, 然后与1-磷酸-鼠李糖反应(反应条件如Scheme 4B所示), 反应48 h TDP-Rha的产率达到75.5%; Sun等[67]将nucleoside 5'-phosphoropiperidates与1-磷酸-鼠李糖反应, 并利用4, 5-二氰基咪唑(DCI)促进磷酸化(反应条件如Scheme 4C所示), 反应6 h UDP-Rha和dTDP-Rha的产率可达70%~75%.与传统的1H-四唑促进磷酸化法相比, 该方法显著缩短了反应时间. (2)核苷二磷酸(NDP)与亲电子糖基供体(如糖基卤化物和1, 2-脱水糖)反应, 在其末端磷酸上发生糖基化.然而, 由于NDPs和糖供体很难获得, 并且它们的偶联反应效率和立体选择性通常较低, 所以这种方法实际应用价值有限[67].
图式 4
4.2 酶法合成NDP-Rhamnose
利用化学法合成鼠李糖基供体, 反应条件比较苛刻, 此外还涉及到立体选择性等问题, 反应过程中需要用到较多有机试剂, 环境不友好, 而且伴随副产物产生, 产率较低.因此酶法合成鼠李糖基供体成为一个理想的可替代的途径, 且相关功能蛋白的获得还能为“一步催化”工程菌的构建提供基因元件.近年来, 活性鼠李糖基供体在生物体内的合成途径及关键蛋白已逐渐被揭示.
dTDP-鼠李糖(dTDP-Rhamnose, dTDP-Rha)为细菌中的活性鼠李糖基供体形式, 由dTDP-葡萄糖(dTDP-glucose, dTDP-Glc)经过3步酶反应合成(Scheme 5A)[68~70]:首先, dTDP-Glc在dTDP-葡萄糖-4, 6-脱水酶(rmlB)的催化下生成dTDP-4-酮-6-去氧葡萄糖(dTDP-4- keto-6-deoxy-D-glucose, dTDP-4K6DG), 在此基础上, 经过dTDP-4K6DG-3, 5-差向异构酶(rmlC)的催化生成dTDP-4-酮-鼠李糖(dTDP-4-keto-L-Rhamnose, dTDP- 4KR), 进一步在dTDP-4KR-4-酮-还原酶(rmlD)的作用下生成终产物dTDP-Rha. Graninger等[71]利用从Salmonella enterica serovar Typhimurium LT2中获得的rmlB, rmlC和rmlD酶, 在体外酶促反应中成功催化dTDP-Glc生成了dTDP-Rha, 转化率达到80%.
图式 5
与细菌不同, 植物和真菌中鼠李糖基供体的活性形式为UDP-Rha.在植物中, UDP-Rha由UDP-Glc在UDP-葡萄糖-4, 6-脱水酶, UDP-4K6DG-3, 5-差向异构酶和UDP-4KR-4-酮-还原酶的催化作用下生成[72, 73] (Scheme 5B).与细菌中不同的是, 植物中催化这一系列反应的酶是一个单一的多功能的UDP-Rha合成酶(RHM), 其N端编码蛋白催化第一步反应, 起到UDP-葡萄糖-4, 6-脱水酶的作用, C端编码蛋白催化后两步反应, 同时起到UDP-4K6DG-3, 5-差向异构酶和UDP-4KR-4-酮-还原酶的作用. Oka等[73]从拟南芥中克隆了RHM2/MUM4基因, 并在酵母中进行了外源表达, 利用获得的重组酶, 以UDP-Glc为受体, 在NAD+ (Nicotinamide Adenine Dinucleotide)和NADPH (Nicotinamide Adenine Dinucleotide Phosphate)的辅助下催化反应发生, 产物经核磁鉴定为UDP-Rha, 这是利用酶催化法以UDP-Glc为底物从头合成UDP-Rha的首次报道.在此基础上, 又从杨树[74]、玉米[28]、虎眼万年青[75]、淫羊霍[29]等中克隆获得了多个UDP-Rha合成酶, 并成功地催化UDP-Glc合成了UDP-Rha.此外, 在真菌中, UDP-Rha由两各单独的酶催化UDP-Glc生成, 其催化过程与植物类似(Scheme 5C)[76].
除了以NDP-葡萄糖为底物经一系列酶促催化反应合成外, NDP-鼠李糖还可利用糖基转移酶催化芳香糖苷合成: Thorson课题组[77]通过易错PCR的方法, 从Streptomyces antibioticus中筛选获得了一个竹桃霉素生物合成途径中的糖基转移酶OleD的突变体(P67T/ S132F/A242L/Q268V), 当供体NDP和底物2-氯-4-硝基苯基糖苷化合物的物质的量比为1:1时, 该突变体能够催化2-氯-4硝基苯基糖苷化合物生成NDP-鼠李糖.
5. 鼠李糖基转移酶的底物杂泛性研究
多年来, 高效的催化效率和严格的底物专一性一直被认为是酶催化的基本特征, 一种广泛接受的假说是特定的氨基酸序列决定了特定的蛋白质结构, 而后者又决定了蛋白的特殊功能.然而, 近年来这种假说受到了明显的挑战, 越来越多的实验证据表明酶识别底物的杂泛性在蛋白质世界中并不罕见, 相反, 它是分子识别的普遍性质, 并且在蛋白质-蛋白质、蛋白质-DNA、抗体-抗原和蛋白质-小分子化合物的相互作用中得到广泛证实[78, 79].作为参与结构多样性天然产物结构修饰的糖基转移酶, 其催化的底物杂泛性也有大量报道, 本文着重列举具有催化杂泛性的鼠李糖基转移酶.
5.1 植物来源杂泛性鼠李糖基转移酶举例
AtUGT78D1为从拟南芥中克隆获得的位置特异性催化黄酮醇3-OH位发生鼠李糖/葡萄糖苷化的糖基转移酶, UDP-Rha为其最适糖基供体. Mo等[80]对其催化的底物选择性进行了广泛深入的分析, 发现AtUGT78D1可接受包括黄酮醇在内的一系列结构类型多样的黄酮类、黄酮苷类、二苯乙基色酮类、苯甲酮类、香豆素类、木脂素类及蒽醌类化合物发生鼠李糖基化反应, 生成一个或多个糖基化产物, 且其催化鼠李糖基化反应的效率远高于催化葡萄糖基化反应的效率, 相应糖基化的位点也不仅发生在黄酮醇的3-OH位, 如以黄酮类化合物黄芩素为底物时, 其糖基化反应的位置发生在7-OH位.该研究进一步构建了酶与底物的“一锅式”反应体系, 为具杂泛性酶在催化领域中的广泛应用提供了启示.
另一分离自拟南芥的鼠李糖基转移酶AtUGT89C1也表现出了类似的底物杂泛性, 当其以内源性的TDP-Rha代替UDP-Rha作为糖基供体时, 能同时接受黄酮类、黄酮醇类、二氢黄酮类、查尔酮类和二苯乙烯类化合物为糖基受体, 在7-OH位催化位置特异性的鼠李糖基取代[81].此外, AtUGT89C1还能同时接受5种不同类型糖基供体(如UDP-α-D-glucose, UDP-α-D-galactose, dTDP-β-L-rhamnose, GDP-β-L-fucose和dTDP-α-2-deoxy-D-glucose), 催化染料木素在其7-OH位发生相应的糖苷化反应[82].上述研究结果显示AtUGT89C1为兼具催化底物杂泛性及催化位置特异性的鼠李糖基转移酶.同样来自植物且具有催化杂泛性的鼠李糖基转移酶还包括Cm1, 2RhaT和Cs1, 6RhaT, 如上文所述, 它们分别克隆自苦柚和甜橙, 前者除UDP-Rha外, 还能接受UDP-木糖作为糖基供体, 表现出供体选择杂泛性, 后者只能识别鼠李糖基供体, 但除了柚皮素-7-O-葡萄糖苷外, 还显示出对槲皮素-3-O-葡萄糖苷的鼠李糖转移活性, 表现出糖基受体选择杂泛性[83].
5.2 微生物来源杂泛性鼠李糖基转移酶举例
与上述植物来源的杂泛性鼠李糖基转移酶略有不同, 已报道的微生物来源鼠李糖基转移酶.其杂泛性通常表现在对糖基供体的选择上.例如:除了天然的糖基供体dTDP-L-Rha外, AraGT还可接受dTDP-L-rhodinose, dTDP-L-anexose, dTDP-D-amicetose等稀有糖基供体, 生成含不同糖基取代的蒽环霉素类似物[41]; ElmGT的天然糖基供体为dTDP-L-Rha, 其同时也可接受dTDP-L-olivose, dTDP-L-rhodinose, dTDP-D-olivose, dTDP-D-mycarose以及dTDP-D-diolivosyl作为糖基供体, 以8-去甲基四环霉素C (8-DMTC)为苷元发生相应的糖基化反应[46]; CalG1除能接受天然糖基供体TDP-L-Rha外, 还能接受9种不同的TDP-D-/TDP-L-糖基供体, 生成结构多样的卡利奇霉素结构类似物[49]; SpnG也表现出了显著的供体选择宽泛性, 能催化包括dTDP-Rha, dTDP-L-olivose, dTDP-xylose, dTDP-6-deoxy-D-xylo-4-hexulose和dTDP-6-deoxy-D-glucose供体发生相应的糖基化反应[50].
此外, 值得一提的是, 分离自地衣芽孢杆菌Bacillus licheniformis中的糖基转移酶YjiC可接受五种NDP-葡萄糖(A/T/G/C/UDP-glucose)、五种稀有糖基供体(UDP-galactose, dTDP-2-deoxyglucose, dTDP-D-viosamine, dTDP-L-rhamnose, GDP-L-fucose), 同时还能接受不同类型的黄酮类化合物、大环内脂类化合物、埃博霉素A、格尔德霉素类似物作为糖基受体, 催化结构多样性糖基化产物的生成, 为兼具糖基供体、受体及催化行为杂泛性的微生物来源糖基转移酶[84].
酶工程学研究表明, 酶的底物杂泛性表现出高度的“可塑性”, 即酶对底物的选择性是可以通过对关键位点的改变而改造的, 少数突变就可以大幅度改变酶催化杂泛性(提高或降低)[85].酶的杂泛性特性使其在目前炙手可热的天然产物合成生物学研究领域受到众多关注, 具有底物杂泛性的酶可以应用于“从头合成代谢途径”的研究中, 作为一种通用的功能元件应用于次生代谢途径的构造, 具有巨大的应用潜力[41].
6. 鼠李糖基转移酶的催化合成应用
鼠李糖苷类化合物具有显著而广泛的药理学活性, 然而, 化学法鼠李糖基化困难, 鼠李糖基转移酶在化合物分子的鼠李糖基合成中发挥着越来越重要的作用.如前所述, 受鼠李糖基活性供体来源的限制, 鼠李糖基转移酶的合成应用多整合了UDP-Rha为供体的酶法合成, 采用代谢工程的方法或体外酶催化的方式进行化合物分子中鼠李糖基的合成; 此外, 鼠李糖基转移酶还可作为基本的合成元件, 参与到结构多样性鼠李糖苷类化合物生物合成工程菌的构建中.
Feng等[29]从拟巫山淫羊藿中克隆获得了催化异戊烯基取代的黄酮醇类化合物在其3-OH位特异性地引入鼠李糖基取代的鼠李糖基转移酶EpPF3RT, 并将该基因与UDP-鼠李糖供体合成酶EpRhS基因在大肠杆菌中进行了共表达, 以8-异戊烯基山萘酚为底物时, 工程菌能将其转化生成产物宝霍苷Ⅱ (图 2).共培养48 h后, 宝霍苷Ⅱ的产量可以达到96.7 μg/mL(转化率为100%).
Kim等[86]将拟南芥中的黄酮醇3-OH鼠李糖基转移酶UGT78D1和UDP-Rha合成酶RHM2在大肠杆菌中进行了共表达, 通过外源添加黄酮醇底物槲皮素或山奈酚, 成功转化获得了槲皮素3-O-鼠李糖苷(4)和山奈酚3-O-鼠李糖苷(5), 共培养48 h后, 两个目的产物的产率可分别达到200和150 mg/L; Yang等[87]在大肠杆菌中共表达了5个与黄酮类化合物生物合成相关的基因, 分别为酪氨酸脱氨酶基因(TAL)、4-香豆酰CoA连接酶基因(4CL)、查尔酮合成酶基因(CHS)、黄酮醇合酶基因(FLS)和黄酮醇3-O-鼠李糖基转移酶基因(UGT78D1), 所获得的工程菌能够以葡萄糖为原料从头合成化合物5, 产量为57 mg/L.虽然与之前的方法[86]相比, 产量有所降低, 但由于山奈酚的价格远高于葡萄糖, 所以这种一步合成的方法相比生物转化更具有应用优势. Roepke等[88]在大肠杆菌中共表达了黄酮醇-7-O-鼠李糖基转移酶基因UGT89C1和UDP-Rha合酶基因AtRHM1, 以槲皮素-3-O葡萄糖苷(12)为底物, 利用工程菌转化成功合成了具有抗氧化及抗自由基活性的槲皮素-3-O-葡萄糖-7-O-鼠李糖苷(14), 24 h内其转化率可超过50%, 该方法产物单一, 相比植物提取分离大大节约了成本, 后处理简单且环境友好; Kim等[89]在大肠杆菌中共表达了克隆自拟南芥的UGT78D2基因(该基因催化黄酮3-OH葡萄糖苷化, Scheme 2)和UGT89C1基因, 通过外源添加槲皮素, 转化获得了化合物14, 产率为67 mg/L.用同样的方法将UGT78D1基因和UGT89C1基因及鼠李糖基供体合成酶基因RHM2三者在大肠杆菌中共表达, 以槲皮素为底物成功合成了槲皮素-3-O-鼠李糖-7-O-鼠李糖苷(16), 产率为67.4 mg/L.
为了让碳源更多地流向鼠李糖供体合成的方向, Thuan等[90]将大肠杆菌中的葡萄糖磷酸异构酶和葡萄糖6-磷酸脱氢酶基因进行了敲除, 并在此基础上过表达了鼠李糖基转移酶基因ArGT3, 所获得的工程菌能高效地转化花旗松素在3-OH位发生鼠李糖苷化反应生成落新妇苷, 后者具有较好的抗肿瘤活性; Parajuli等[91]将糖基供体生物合成关键基因在同一载体上进行了整合, 并与ArGt3基因在大肠杆菌中进行共表达, 利用工程菌对包括漆黄素、山奈酚、槲皮素、杨梅素、桑色素在内的一系列黄酮底物进行了转化, 结果显示工程菌能高效地转化这些底物生成3-OH鼠李糖苷化产物, 且转化效率超过95%, 显示该工程菌有望作为一个模式菌应用于多结构类型活性黄酮苷类化合物的合成.
新橙皮苷是一种安全、健康的甜味剂, 在食品工业中有重要应用价值, 但其在植物中的含量较低, 而其同分异构体橙皮苷大量存在于果汁生产的废料果皮中. Frydman等[92]提出了通过代谢工程和生物转化将橙皮苷转化为新橙皮苷的方法, 即从果皮中提取橙皮苷, 将橙皮苷水解为橙皮素-7-O-葡糖苷, 利用过表达了Cm1, 2RhaT基因的转基因烟草/胡萝卜悬浮培养体系对水解后的底物进行生物转化, 成功在7位取代葡萄糖的2-OH位引入了鼠李糖基取代, 合成了新橙皮苷.
目前鼠李糖脂生物表面活性剂主要由条件致病的铜绿假单胞菌生产获得, 在一定程度上影响了工业应用.为了开发一种相对安全的鼠李糖脂生产方式, 巩志金等[93]将鼠李糖脂合成的关键基因rhlAB在E. coli ATCC8739中进行了表达优化, 利用合成启动子与rhaBDAC基因簇进行组合调控, 得到鼠李糖脂工程菌E. coli TIB-RAB226.进一步结合对发酵温度的优化和分批补料发酵, 工程菌生产鼠李糖脂的产量可达到209.2 mg/L; Du等[94]在大肠杆菌中构建了异源生产双鼠李糖脂生物表面活性剂的生物合成途径, 并将在大肠杆菌活性鼠李糖供体合成途径中催化dTDP-4-酮-鼠李糖转化成终产物dTDP-L-Rha的rfbD基因与鼠李糖脂合成的关键基因rhlAB-rhlC进行了共表达, 与仅表达rhlAB-rhlC [(0.45±0.01) g/L]相比, rfbD的共表达明显增强了鼠李糖脂的产量[(0.64±0.02) g/L], 且产物主要为双鼠李糖脂类.
7. 小结与展望
鼠李糖基取代是生物体中普遍存在的一类反应, 含鼠李糖基取代的化合物结构多样, 药理活性广泛, 是天然产物结构多样性和活性药物先导物的重要来源, 也能作为植物体的防御物质在植物生理功能中发挥重要作用.鼠李糖基修饰往往能够提高化合物的水溶性, 改善药代动力学特性, 是有机化学常见的一类结构修饰反应.此外, 鼠李糖取代的多糖类化合物还是植物及细菌细胞壁的重要组成部分, 在维持细胞结构中发挥重要作用.因此对这一反应进行研究是具有重要意义的.生物体内的鼠李糖苷化反应由鼠李糖基转移酶在活性糖基供体存在的条件下催化发生的, 对于很多化学催化难于完成的反应, 酶法催化是有力的补充手段.本文对不同来源的鼠李糖基转移酶从酶催化功能、蛋白三维结构、鼠李糖基供体合成、酶催化底物杂泛性以及其在代谢工程中的应用等方面进行了综述, 以期对这类酶的研究和更深入的酶催化应用提供有益启示.
相比生物体中大量存在并被广泛鉴定的葡萄糖基转移酶来说, 目前已鉴定的鼠李糖基转移酶的数量相对较少, 如何有针对性地去寻找这类酶仍是一个难题, 也是制约其发展的瓶颈所在.随着转录组测序技术的不断发展, 越来越多的糖基转移酶基因不断被注释, 伴随差异基因的寻找, 可以为鼠李糖基转移酶基因的寻找提供新的方法.
此外, 关于鼠李糖基转移酶晶体结构的报道较少, 其催化的反应机理及供体识别机制仍有待进一步阐明.如多个糖基供体取代时其反应发生的顺序是依次还是同时发生?以常见的芸香苷取代为例, 其生物合成机制是先在苷元结构上引入一个葡萄糖, 再进一步发生鼠李糖基化反应, 还是生物体内先合成芸香糖基供体, 直接一步取代到苷元上等都是未来值得研究的问题.更有趣的是, 许多天然产物的糖基化取代都表现出了显著的位置特异性, 如结构多样的苯乙醇苷类化合物, 其分子中的鼠李糖基取代均位置特异性地发生在葡萄糖3-OH位, 提示必定有一个高度位置特异性的鼠李糖基转移酶催化此类反应, 对这类酶进行寻找并结合蛋白晶体三维结构解析, 对其酶催化关键位点进行揭示, 对阐明这类化合物的生物合成机制, 实现酶活性的人工操控和多样性催化应用都具有重要意义.而解决这些问题都需要分子生物学家和结构生物学家的大量努力.相信随着生物技术的不断发展, 会有越来越多的鼠李糖基转移酶基因得到鉴定, 伴随结构与功能的研究, 这类蛋白必定会在化合物结构修饰中发挥越来越大的作用, 并朝着“结构指导下酶功能的人为操控”方向不断发展, 成为天然/非天然鼠李糖苷类化合物研究中的有力工具.