胍基乙酸最早是从人和狗的尿液中分离出来的,是一种天然存在于动物体内的氨基酸衍生物。工业合成的胍基乙酸为白色无味粉末,溶于水,摩尔质量为117.11 g·mol-1,结构稳定,室温下可稳定保存2年[1]。目前,胍基乙酸作为一种优质的食品补充剂或饲料添加剂,广泛地应用于人类保健及动物生产环节。胍基乙酸在酶的催化作用下能够内源性地合成肌酸(creatine, Cr),肌酸是一种含氮氨基酸,被认为是一种能量缓冲剂,主要作用是在肌酸激酶(creatine kinase, CK)的作用下形成磷酸化肌酸(P-Creatine,PCr),参与三磷酸腺苷(adenosine triphosphate, ATP)循环。当ATP供能不足的瞬间,磷酸肌酸通过肌酸激酶以非常快的速度将磷酸基团转移到二磷酸腺苷中(adenosine diphosphate,ADP)重新转化为三磷酸腺苷。已知补充肌酸可减少糖尿病患者甲硫氨酸的消耗,同时降低肝中同型半胱氨酸的产生,阻止脂肪的积累,因此对脂肪肝和非酒精性肝病患者有益[2]。动物体内每天约有1.6%(2 g)的肌酸和磷酸肌酸不可逆的转化为肌酐,并由尿液排出体外[3]。由于动物体内源性合成的肌酸仅占机体所需肌酸的50%,因此需外源性添加肌酸。但是肌酸价格偏高,且半衰期较短,故不适合作为饲料添加剂。而胍基乙酸作为肌酸前体,在体内能够合成肌酸,已在畜牧生产中得以普遍应用,其主要作用包括提高生长育肥猪的生长性能和猪肉品质[4],增加肉鸡的胸肌产量,改善肉质和能量代谢[5]。
本文综述了胍基乙酸的生理功能及其代谢产物肌酸对肌肉、脂肪细胞的影响,以期为胍基乙酸进一步的研究提供参考。
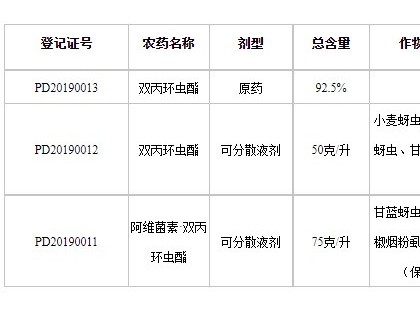
1 胍基乙酸的体内代谢途径胍基乙酸是脊椎动物体内天然的肌酸前体,而肌酸在细胞内能量的转运过程中有着重要的作用[3]。胍基乙酸在体内的代谢是个复杂的过程,首先L-精氨酸在精氨酸-甘氨酸脒基转移酶(L-arginine glycine amidinotransferase, AGAT)的作用下催化形成L-鸟氨酸,而切下的咪基被转移到甘氨酸上形成胍基乙酸,这个过程主要在肾中进行,其次肝和胰中也能形成胍基乙酸[6],其中AGAT是肌酸合成第一步的限速酶,在翻译过程中受到肌酸的负反馈调节[7]。其次胍基乙酸通过血液运输到肝中,在胍基乙酸N-甲基转移酶(guanidinoacetate methltransferase, GAMT)的作用下将S-腺苷甲硫氨酸的甲基催化到胍基乙酸中形成肌酸和S-腺苷高半胱氨酸,这个过程主要在肝中进行。此外,GAMT同样在小鼠的肾、心和骨骼肌中被发现,也存在于人胎儿期的肺成纤维细胞,但这些组织中的GAMT活性较低[3]。肝中的肌酸通过血液循环运输到存在肌酸转运受体蛋白(creatine transporter, CreaT)的组织中,例如骨骼肌和心[8-9]。肌酸转运受体在脑部的表达量较低,这似乎说明脑部有一套自己的肌酸合成机制。相对于肌酸,胍基乙酸在体内的吸收利用的报道并不多,但与肌酸对比,胍基乙酸的添加能更有效地增加体内总肌酸(肌酸与磷酸肌酸)的含量[10-11],造成这样的结果可能是由于有更多的胍基乙酸转运进细胞。胍基乙酸除了能通过肌酸转运受体蛋白转运到细胞内,还能通过牛磺酸转运体和γ-氨基丁酸转运体转运到胞浆内[12](图 1)。Fagerberg等[13]使用RNA测序技术,对人27个组织进行转录组测序,结果发现,GAMT表达量最高的组织为肝,其次是胰、肾;而AGAT表达量最高的组织为肾,其次为肝和胰腺。GAMT在各个组织都有表达,而AGAT似乎只在特定组织表达。然而,各种器官组织对胍基乙酸吸收的研究不多,胍基乙酸和组织间肌酸运输的相关性尚不清楚。
 L-Arg.左旋精氨酸;Gly.甘氨酸;AGAT.精氨酸-甘氨酸脒基转移酶;L-ornithine.左旋鸟氨酸;GAA.胍基乙酸;GAMT.胍基乙酸甲基转移酶;γ-GABAT.伽马氨基丁酸转运体;TaurineT.牛磺酸转运体;CreaT.肌酸转运膜蛋白;Cr.肌酸;CK.肌酸激酶;P-Cr.磷酸肌酸;ADP.二磷酸腺苷;ATP.三磷酸腺苷L-Arg. L-arginine; Gly. Glycine; AGAT. L-arginine glycine amidinotransferase; L-ornithine. L-ornithine; GAA. Guanidinoacetic acid; GAMT. Guanidinoacetate methltransferase; γ-GABAT. Gamma-aminobutyric acid transporter; TaurineT. Taurine transporter; CreaT.Creatine transporter; Cr. Creatine; CK. Creatine kinase; P-Cr. Phosphorylated creatine; ADP. Adenosine diphosphate; ATP. Adenosine triphosphate图 1 胍基乙酸体内代谢途径Figure 1 Guanidinoacetic acid metabolism in vivo |
内源性合成肌酸需要3种氨基酸:甘氨酸、甲硫氨酸和精氨酸,以及两种酶:AGAT和GAMT。由于甘氨酸易于合成,因此肌酸合成几乎不会对机体中甘氨酸代谢带来负担。然而甲硫氨酸和精氨酸作为人体必需氨基酸和条件性必需氨基酸,在人体内不能自主合成或合成量不足以满足人体正常需求,因此整个肌酸合成将对机体甲硫氨酸和精氨酸的代谢产生明显的负担,但外源补充胍基乙酸将只消耗甲硫氨酸。
2 胍基乙酸的主要生理功能早在20世纪50年代就有报道称,外源性添加胍基乙酸能够提高心代偿失调病人的生理机能,并且提出胍基乙酸提高生理机能可能是基于肌酸的生物合成。但除了作为肌酸的前体,胍基乙酸还具有许多生理功能,包括促进胰岛素的分泌[14],影响神经调节[15-16],改变精氨酸的代谢[17-18]以及影响机体氧化和抗氧化系统[19]。
2.1 胍基乙酸促进胰岛素的分泌胍基乙酸能够促进胰岛素分泌,最早在动物试验中被发现。体外注射胍基乙酸及胍基衍生物,能够刺激啮齿动物的胰腺分泌胰岛素,并且胍基团可能是刺激胰岛素分泌的一个重要原因[14]。胍基乙酸刺激胰岛素分泌的具体机制可能是由于胍基乙酸分子的极性能影响胰岛细胞膜去极化,并通过蛋白激酶A和C增强靶细胞膜表面胰岛素受体的活性,从而激活胰岛素信号通路[20]。胰岛素的生理功能主要表现为降低血糖,因此,外源性添加胍基乙酸能够降低血浆中的葡萄糖水平。由于胍基乙酸的促胰岛素分泌作用,似乎说明胍基乙酸可以通过影响胰岛素的体内平衡,作为一个抗糖尿病合成代谢剂,从而维持血糖稳态。
2.2 胍基乙酸改变机体精氨酸代谢精氨酸对于禽类为必须氨基酸,有研究表明,胍基乙酸能有效地代替饲料中的精氨酸[17]。因为精氨酸作为胍基乙酸的前体,在禽类体内一部分精氨酸用于合成胍基乙酸,因此在肉鸡日粮中添加胍基乙酸能够节约出更多的日粮精氨酸并参与精氨酸的其他生理学功能,例如蛋白质的合成、激素的释放(如生长激素)、提高胸肌产量[5, 18]。其次,精氨酸也可以作为一氧化氮(NO)的前体,因此外源性添加胍基乙酸也能够影响一氧化氮介导的促生长的生理功能[21]。
2.3 胍基乙酸的神经调节胍基乙酸可以激活脑和外周组织中的γ氨基丁酸(γ-aminobutyric acid, GABA)受体。这是由于胍基乙酸与γ氨基丁酸的结构非常相似(图 2),因此,在GAMT缺乏症患者(一种常染色体隐性遗传疾病)体内内源性的胍基乙酸不能及时合成肌酸导致血清或者脑部中累积高浓度(10~30 μmol·L-1)的胍基乙酸,并激活神经细胞电压门控或配体门控的氯离子通道,导致自发性的神经元损伤[15]。也就是说,胍基乙酸能够作为一种γ氨基丁酸竞争性抑制剂,激活影响神经系统的兴奋性。研究表明,给健康人每天补充3 g的胍基乙酸,3周之后发现,血浆中γ氨基丁酸水平显著下降[16],这似乎说明胍基乙酸的添加能够负向调节γ氨基丁酸的血浆水平。然而,胍基乙酸的添加是否能够激活γ氨基丁酸介导的神经元或肌肉兴奋性还需进一步研究。
 GABA. γ氨基丁酸,一种重要的抑制性神经递质;GAA.胍基乙酸GABA. Gamma-aminobutyric acid, an important inhibitory neurotransmitter; GAA. Guanidinoacetic acid图 2 胍基乙酸与γ氨基丁酸结构式Figure 2 The structural formula of guanidinoacetic acid and gamma-aminobutyric acid |
目前,在动物体水平上的一些研究表明,胍基乙酸可能影响氧化-抗氧化系统,它能同时作为一种超氧化物和抗氧化化合物。小鼠在注射胍基乙酸后诱导了氧应激,并且在病理状态下累积过量的氧自由基[22]。当胍基乙酸的浓度在脑部提高(大约100 μmol·L-1)并累积后,胍基乙酸表现出明显的超氧化作用,简单的说,胍基乙酸作为一个纯净的超氧化剂能够从它的共轭碱提供一个电子生成超氧阴离子—氧自由基,从而产生活性氧[19]。然而另有研究表明,饲粮中添加胍基乙酸可以通过提高总抗氧化能力和活化抗氧化酶活性的方式提高机体抗氧化形态[4],在摄取胍基乙酸后血清胍基乙酸浓度(大约5 μmol·L-1)较低时才体现出抗氧化作用。这是由于胍基乙酸的摄取能淬灭其相关代谢物(肌酸和精氨酸)的氧自由基[5],因此,胍基乙酸有着间接的抗氧化作用。也就是说,如果胍基乙酸代谢保持原状或提供了低浓度的外源性胍基乙酸,就体现出了抗氧化的作用,而当体内产生了过多的胍基乙酸,其可作为一种强氧化剂,并诱导氧应激。
3 胍基乙酸安全性的研究膳食胍基乙酸的添加最初应用于人研究中。早期研究发现,胍基乙酸能够对心代谢失调和抑郁焦虑的患者有良好的作用,且没有明显的副作用。代重山等[23]对胍基乙酸的致突变性进行研究,发现胍基乙酸的添加不会致诱变或基因毒性,也不会对环境造成危害。因此,胍基乙酸能够普遍地应用于人类保健和动物生产环节。胍基乙酸的服用对人肝和肌肉的酶表达谱没有明显影响,且服用带来的副作用也是可接受的,例如体重增加、恶心、腹胀、肌肉痉挛、腹痛。但值得注意的是,服用胍基乙酸除了会增加血清肌酐含量和肌肉中肌酸的含量外,还能够提高血清中同型半胱氨酸的含量[24-25]。这是由于胍基乙酸被甲基化形成肌酸的同时还能够形成S-腺苷高半胱氨酸,然后在体内被水解成半胱氨酸和腺苷。由于血清中同型半胱氨酸是临床上动脉粥样硬化和心血管疾病的重要指标[26],因而胍基乙酸的摄入提高了血浆中同型半胱氨酸的含量,可以考虑作为胍基乙酸的一种副作用。因胍基乙酸合成肌酸所需的甲基基团由S-腺苷甲硫氨酸提供,当胍基乙酸与甲基供体(如甜菜碱、胆碱、维生素B)一起作为添加剂添加时,能够抑制因胍基乙酸摄入后血清同型半胱氨酸的升高[27]。此外,欧洲食品安全局指出,饲喂高剂量的胍基乙酸不会导致猪和鸡的肉制品中胍基乙酸、肌酸和同型半胱氨酸对消费者带来影响[28-29]。由于胍基乙酸的摄取能够增加血清中同型半胱氨酸的含量,因此胍基乙酸作为一种运动保健药品或动物饲料添加剂时,需密切关注血清中同型半胱氨酸的浓度。
4 肌酸肌酸最先在骨骼肌中被发现。直到20世纪70年代,在培养的骨骼肌细胞和心肌细胞中添加肌酸,能增加肌特异蛋白的合成。目前有大量试验证明,外源性添加胍基乙酸能够提高机体肌酸或磷酸化肌酸的含量[10, 24-25]。并且肌酸能增加肌肉细胞成肌相关基因的mRNA表达和蛋白质合成,并促进肌肉细胞和成骨细胞的分化[30-31],抑制脂肪细胞的分化[32]。
4.1 肌酸对肌肉细胞的影响近年来,肌酸对肌肉细胞的影响引起了越来越多研究者的关注,Willoughby和Rosene[33-34]研究发现,肌酸的补充与物理训练的共同作用可以增加成年人肌肉的强度和肌纤维长度,并且调节肌球蛋白重链的合成,促进Myog、MYF6的mRNA和蛋白的表达水平。2003年,Vierck等[35]研究发现,在肌卫星细胞分化期,添加肌酸能显著地促进肌卫星细胞的分化。几年后,Louis等[36]和Sestili等[37]研究进一步确定,在C2C12细胞分化期添加肌酸,除了能调节成肌调控因子家族(MRFs)的基因表达外,还能够上调IGF-1基因的表达。由于IGF-1介导的骨骼肌细胞肥大的典型信号通路有PI3K-Akt/PKB-mTOR、MAPK/ERK和钙调磷酸酶信号通路[36],这些研究对将来研究肌酸介导骨骼肌细胞肥大提供了指导性方向。随后Deldicque等[38]的研究进一步确定肌酸的添加确实能够使Akt/PKB、p53-MAPK的mRNA和蛋白表达上调,并提出p38-MAPK和Akt/PKB通路可能是肌酸发挥作用的中间介质。
对于人体骨骼肌,肌酸的添加确实增加了MRFs家族基因和IGF-1基因表达量,并且提高了4E-BP1的磷酸化水平,其中4E-BP1是PI3K-Akt/PKB-mTOR信号通路下游的效应物,该信号通路受到IGF-1的激活[39]。Safdar等[40]研究报道,短期补充肌酸能增加青年人骨骼肌中SPK1、PKB-α、p38、MAPK表达水平,这些蛋白因子的共同作用促使成肌细胞分化。在有素食习惯的青年人膳食中添加肌酸能在其物理训练中进一步增加肌内IGF-1含量[41]。
此外,肌酸还有抗氧化应激的作用。氧化应激对成肌细胞的增殖和分化有极大的影响,并伴随着肌纤维的大量损失[37, 42-43]。H2O2诱导的氧化应激能够阻碍C2C12细胞的成肌能力,包括显著减少MyoD、Myog、MYF6和IGF-1基因的转录,抑制成肌细胞的分化[44-45],而外源性添加肌酸能显著减少氧化应激的作用,并恢复C2C12成肌细胞的分化能力[46]。
4.2 肌酸对脂肪细胞的影响随着人们生活水平的提高和饮食结构的改变,肥胖的发病率也急剧上升,从而引起了一系列代谢疾病,如Ⅱ型糖尿病和心血管疾病。肥胖的根本原因是由于脂肪细胞数目和体积的增加[47]。脂肪作为一种储能器官,当食物摄入体内,转换成的大部分能量以产热的方式散发到外界环境中。若持续过多的能量摄入,多余的能量将以三酰甘油的形式储存于脂肪细胞中。因此,肥胖可以由食物摄入的增加和能量消耗(散热)的减少所引起[48]。
相对于肌肉细胞来说,肌酸对脂肪细胞影响的研究较少。肌酸的功能是通过从ATP或ADP接收或转移高能磷酸盐来调节能量水平[3]。研究表明,肌酸能通过下调胰岛素诱导的PI3K信号通路的方式抑制前体脂肪细胞(3T3-L1)和间充质干细胞(MSCs)的细胞质积累三酰甘油,并呈现出剂量效应[32]。但肌酸只能抑制前体脂肪细胞的早期分化,一旦脂肪生成被激发,肌酸就不能阻止脂肪细胞的成熟。但有研究提出,肌酸抑制脂肪细胞的形成是不依赖肌酸的磷酸化水平,这意味着肌酸抑制脂肪形成不是由细胞内能量供应变化所引起的[32]。Kazak等[49]研究再次证实了以上发现,该试验构建了GAMT脂肪细胞特异性敲除小鼠,并发现与对照组相比,高脂日粮能够诱导GAMT敲除鼠累积更多的脂肪,但在摄取和排出的能量、粪能、沉积能等表型中并没有显著差异,而GAMT基因敲除小鼠在耗氧量上显著低于对照组。这是由于脂肪细胞能通过一种非颤抖的方式散热,也就是说由于基因敲除小鼠降低了肌酸的生成,抑制了因采食而诱导的产热,从而促进了脂肪细胞的肥大。
5 小结胍基乙酸是天然的肌酸前体,外源性添加胍基乙酸能够提高机体总肌酸水平,并且胍基乙酸的摄入不会带来明显的副作用。除了作为肌酸前体,胍基乙酸的一些生理功能可能会与其作为运动员保健药或饲料添加剂密切相关,其中包括促进胰岛素的分泌,参与神经调节,改变精氨酸的代谢,参与氧化和抗氧化形态的转换。但是胍基乙酸促进胰岛细胞分泌胰岛素的具体分子机制、激活γ-氨基丁酸的机理、代替精氨酸的效率和明确的调节氧化-抗氧化系统的机制还需进一步研究。正是因为胍基乙酸影响生理功能的具体机制还不清楚,所以人们将目光转向胍基乙酸的代谢产物肌酸。由于人体内每天约有1.6%(2 g)的肌酸和磷酸肌酸不可逆的转化为肌酐,故需通过从头合成或从动物性蛋白中摄取肌酸以补充机体肌酸的消耗。肌酸在肌酸激酶的作用下形成磷酸化肌酸,参与能量代谢。肌酸与磷酸化肌酸系统不会存在于所有细胞中,相反它仅存在于能量需求高的组织中,特别是骨骼肌中。外源性添加肌酸能够通过调控PI3K-Akt/PKB-mTOR、MAPK/ERK信号通路促进肌分化和骨骼肌肥大,但肌酸是如何引起一系列信号通路的激活还有待进一步探究。此外,肌酸还能促进成骨细胞的分化,抑制成脂细胞的分化,并参与调控因饮食诱导的产热。肌酸在能量供应中起到关键作用,但在缺乏GAMT的情况下(图 3),GAA可能使肌酸激酶饱和,产生磷酸胍基乙酸(P-GAA)从而代替磷酸肌酸[50]。GAMT敲除小鼠确实能够通过磷酸化胍基乙酸,从而积极应对肌酸的缺乏[51-52]。
 GAA.胍基乙酸;GAMT.胍基乙酸甲基转移酶,肌酸合成第一限速酶;Cr.肌酸;CK.肌酸激酶;P-Cr.磷酸肌酸;ADP.二磷酸腺苷;ATP.三磷酸腺苷;P-GAA.磷酸化胍基乙酸GAA. Guanidinoacetic acid; GAMT. Guanidinoacetate methltransferase; Cr. Creatine; CK. Creatine kinase; P-Cr. Phosphorylated creatine; ADP. Adenosine diphosphate; ATP. Adenosine triphosphate; P-GAA. Phosphorylated guanidinoacetic acid图 3 胍基乙酸的代替机制Figure 3 The substitution mechanism of guanidinoacetic acid |
在动物生产环节,胍基乙酸的添加除了能提高猪的屠宰性能,增加肉鸡的胸肌产量之外,还能够改善宰后pH、滴水损失、蒸煮损失、硬度和剪切力等肉质指标[53]。究其原因是动物在屠宰后,血液循环停止,无氧酵解增多,从而产生乳酸,而在日粮中添加胍基乙酸能够提高机体能源物质(磷酸化肌酸)的储备,增加ATP的含量,从而延缓糖酵解的进程。同样地,直接添加肌酸也能延缓因屠宰后糖酵解带来的pH降低[54]。与肌酸相比,胍基乙酸作为饲料添加剂更稳定且更便宜,因此更适合用于动物营养。尽管如此,胍基乙酸形成肌酸的甲基化消耗比所有其他甲基化反应需要更多的S-腺苷甲硫氨酸[55]。外源性补充胍基乙酸极大程度地增加了甲基基团需求[56],这同时也引起了血液中同型半胱氨酸的积累[57-58]或导致蛋氨酸的缺乏。研究者发现胍基乙酸与甲基供体如甜菜碱、胆碱、叶酸或维生素B12组合添加时能降低单一补充胍基乙酸导致的同型半胱氨酸提高,且不会影响肌肉肌酸含量和机体能代谢系统[53]。
| [1] | OSTOJIC S M. Guanidinoacetic acid as a performance-enhancing agent[J]. Amino Acids, 2016, 48(8): 1867–1875. DOI: 10.1007/s00726-015-2106-y |
| [2] | BARCELOS R P, STEFANELLO S T, MAURIZ J L, et al. Creatine and the liver:metabolism and possible interactions[J]. Mini Rev Med Chem, 2016, 16(1): 12–18. |
| [3] | WYSS M, KADDURAH-DAOUK R. Creatine and creatinine metabolism[J]. Physio Rev, 2000, 80(3): 1107–1213. DOI: 10.1152/physrev.2000.80.3.1107 |
| [4] | WANG L S, SHI B M, SHAN A S, et al. Effects of guanidinoacetic acid on growth performance, meat quality and antioxidation in growing-finishing pigs[J]. J Anim Vet Adv, 2012, 11(5): 631–636. DOI: 10.3923/javaa.2012.631.636 |
| [5] | MICHIELS J, MAERTENS L, BUYSE J, et al. Supplementation of guanidinoacetic acid to broiler diets:Effects on performance, carcass characteristics, meat quality, and energy metabolism[J]. Poult Sci, 2012, 91(2): 402–412. DOI: 10.3382/ps.2011-01585 |
| [6] | EDISON E E, BROSNAN M E, MEYER C, et al. Creatine synthesis:Production of guanidinoacetate by the rat and human kidney in vivo[J]. Am J Physiol Renal Physiol, 2007, 293(6): F1799–F1804. DOI: 10.1152/ajprenal.00356.2007 |
| [7] | MCGUIRE D M, GROSS M D, VAN PILSUM J F, et al. Repression of rat kidney L-arginine:Glycine amidinotransferase synthesis by creatine at a pretranslational level[J]. J Biol Chem, 1984, 259(19): 12034–12038. |
| [8] | SNOW R J, MURPHY R M. Creatine and the creatine transporter:A review[J]. Mol Cell Biochem, 2001, 224(1-2): 169–181. |
| [9] | CURT M J C, VOICU P M, FonTAINE M, et al. Creatine biosynthesis and transport in health and disease[J]. Biochimie, 2015, 119(5): 146–165. |
| [10] | OSTOJIC S M, DRID P, OSTOJIC J. Guanidinoacetic acid increases skeletal muscle creatine stores in healthy men[J]. Nutrition, 2016, 32(6): 723–724. DOI: 10.1016/j.nut.2015.11.006 |
| [11] | MCBREAIRTY L E, ROBINSON J L, FURLONG K R, et al. Guanidinoacetate is more effective than creatine at enhancing tissue creatine stores while consequently limiting methionine availability in Yucatan miniature pigs[J]. PLoS One, 2015, 10(6): 1–11. |
| [12] | TACHIKAWA M, KASAI Y, YOKOYAMA R, et al. The blood-brain barrier transport and cerebral distribution of guanidinoacetate in rats:Involvement of creatine and taurine transporters[J]. J Neurochem, 2009, 111(2): 499–509. DOI: 10.1111/jnc.2009.111.issue-2 |
| [13] | FAGERBERG L, HALLSTR M B M, OKSVOLD P, et al. Analysis of the human tissue-specific expression by genome-wide integration of transcriptomics and antibody-based proteomics[J]. Mol Cell Proteomics, 2014, 13(2): 397–406. DOI: 10.1074/mcp.M113.035600 |
| [14] | MARCO J, CALLE C, HEDO J A, et al. Glucagon-releasing activity of guanidine compounds in mouse pancreatic islets[J]. FEBS Lett, 1976, 64(1): 52–54. DOI: 10.1016/0014-5793(76)80246-3 |
| [15] | NEU A, NEUHOFF H, TRUBE G, et al. Activation of GABAA receptors by guanidinoacetate:A novel pathophysiological mechanism[J]. Neurobiol Dis, 2002, 11(2): 298–307. DOI: 10.1006/nbdi.2002.0547 |
| [16] | OSTOJIC S M, STOJANOVIC M. Guanidinoacetic acid loading affects plasma γ-aminobutyric acid in healthy men[J]. Eur J Nutr, 2015, 54(5): 855–858. DOI: 10.1007/s00394-015-0858-5 |
| [17] | DILGER R N, BRYANT-ANGELONI K, PAYNE R L, et al. Dietary guanidino acetic acid is an efficacious replacement for arginine for young chicks[J]. Poult Sci, 2013, 92(1): 171–177. DOI: 10.3382/ps.2012-02425 |
| [18] | YAZDI F T, GOLIAN A, ZARGHI H, et al. Effect of wheat-soy diet nutrient density and guanidine acetic acid supplementation on performance and energy metabolism in broiler chickens[J]. Ital J Anim Sci, 2017, 16(4): 593–600. DOI: 10.1080/1828051X.2017.1305260 |
| [19] | HIRAMATSU M. A role for guanidino compounds in the brain[J]. Mol Cell Biochem, 2003, 244(1-2): 57–62. |
| [20] | OSTOJIC S M. Advanced physiological roles of guanidinoacetic acid[J]. Eur J Nutr, 2015, 54(8): 1211–1215. DOI: 10.1007/s00394-015-1050-7 |
| [21] | TONG B C, BARBUL A. Cellular and physiological effects of arginine[J]. Mini Rev Med Chem, 2004, 4(8): 823–832. DOI: 10.2174/1389557043403305 |
| [22] | MORI A, KOHNO M, MASUMIZU T, et al. Guanidino compounds generate reactive oxygen species[J]. IUBMB Life, 1996, 40(1): 135–143. DOI: 10.1080/15216549600201622 |
| [23] | 代重山, 马佳, 王泽明, 等. 胍基乙酸的致突变性研究[J]. 中国饲料, 2017(3): 16–19. DAI Z S, MA J, WANG Z M, et al. The study on mutagenicity of Guanidinoacetic acid[J]. China Feed, 2017(3): 16–19. (in Chinese) |
| [24] | OSTOJIC S M, NIESS B, STOJANOVIC M, et al. Creatine metabolism and safety profiles after six-week oral guanidinoacetic acid administration in healthy humans[J]. Int J Med Sci, 2013, 10(2): 141–147. DOI: 10.7150/ijms.5125 |
| [25] | OSTOJIC S M, STOJANOVIC M, DRID P, et al. Dose-response effects of oral guanidinoacetic acid on serum creatine, homocysteine and B vitamins levels[J]. Eur J Nutr, 2014, 53(8): 1637–1643. DOI: 10.1007/s00394-014-0669-0 |
| [26] | MCCULLY K S. Homocysteine and the pathogenesis of atherosclerosis[J]. Expert Rev Clin Pharmacol, 2015, 8(2): 211–219. DOI: 10.1586/17512433.2015.1010516 |
| [27] | OSTOJIC S M, NIESS B, STOJANOVIC M, et al. Co-administration of methyl donors along with guanidinoacetic acid reduces the incidence of hyperhomocysteinaemia compared with guanidinoacetic acid administration alone[J]. Brit J Nutr, 2013, 110(5): 865–870. DOI: 10.1017/S0007114512005879 |
| [28] | European Food Safety Authority. Safety and efficacy of guanidinoacetic acid as feed additive for chickens for fattening[J]. EFSA J, 2009, 7(3): 1–30. |
| [29] | European Food Safety Authority. Safety and efficacy of guanidinoacetic acid for chickens for fattening, breeder hens and roosters, and pigs[J]. EFSA J, 2016, 14(2): 1–39. |
| [30] | SESTILI P, BARBIERI E, STOCCHI V. Effects of creatine in skeletal muscle cells and in myoblasts differentiating under normal or oxidatively stressing conditions[J]. Mini Rev Med Chem, 2015, 16(1): 4–11. DOI: 10.2174/1389557515666150722102342 |
| [31] | GERBER I, GWYNN I, ALINI M, et al. Stimulatory effects of creatine on metabolic activity, differentiation and mineralization of primary osteoblast-like cells in monolayer and micromass cell cultures[J]. Eur Cells Mater, 2005, 10: 8–22. DOI: 10.22203/eCM |
| [32] | NAYEONL, INHEE K, SOOJEONG P, et al. Creatine inhibits adipogenesis by downregulating insulin-induced activation of the phosphatidylinositol 3-kinase signaling pathway[J]. Stem Cells Dev, 2015, 24(8): 983–994. DOI: 10.1089/scd.2014.0130 |
| [33] | WILLOUGHBY D S, ROSENE J. Effects of oral creatine and resistance training on myosin heavy chain expression[J]. Med Sci Sports Exerc, 2001, 33(10): 1674–1681. DOI: 10.1097/00005768-200110000-00010 |
| [34] | WILLOUGHBY D S, ROSENE J R. Effects of oral creatine and heavy resistance training on myogenic regulatory factor and creatine kinase expression[J]. Med Sci Sports Exerc, 2003, 35(6): 923–929. DOI: 10.1249/01.MSS.0000069746.05241.F0 |
| [35] | VIERCK J L, ICENOGGLE D L, BUCCI L, et al. The effects of ergogenic compounds on myogenic satellite cells[J]. Med Sci Sports Exerc, 2003, 35(5): 769–776. DOI: 10.1249/01.MSS.0000065005.96298.01 |
| [36] | LOUIS M, VAN BENEDEN R, DEHOUX M, et al. Creatine increases IGF-Ⅰ and myogenic regulatory factor mRNA in C2C12 cells[J]. FEBS Lett, 2004, 557(1-3): 243–247. DOI: 10.1016/S0014-5793(03)01504-7 |
| [37] | SESTILI P, BARBIERI E, MARTINELLI C, et al. Creatine supplementation prevents the inhibition of myogenic differentiation in oxidatively injured C2C12 murine myoblasts[J]. Mol Nutr Food Res, 2009, 53(9): 1187–1204. DOI: 10.1002/mnfr.v53:9 |
| [38] | DELDICQUE L, THEISEN D, BERTRAND L, et al. Creatine enhances differentiation of myogenic C2C12 cells by activating both p38 and Akt/PKB pathways[J]. Am J Physiol Cell Physiol, 2007, 293(4): C1263–C1271. DOI: 10.1152/ajpcell.00162.2007 |
| [39] | DELDICQUE L, LOUIS M, NIELENS H, et al. Increased IGF mRNA in human skeletal muscle after creatine supplementation[J]. Med Sci Sports Exerc, 2005, 37(5): 731–736. DOI: 10.1249/01.MSS.0000162690.39830.27 |
| [40] | SAFDAR A, YARDLEY N J, SNOW R, et al. Global and targeted gene expression and protein content in skeletal muscle of young men following short-term creatine monohydrate supplementation[J]. Physiol Genomics, 2008, 32(2): 219–228. DOI: 10.1152/physiolgenomics.00157.2007 |
| [41] | BURKE D G, CANDOW D G, CHILIBECK P D, et al. Effect of creatine supplementation and resistance-exercise training on muscle insulin-like growth factor in young adults[J]. Int J Sports Nutr Exerc metab, 2008, 18(4): 389–398. DOI: 10.1123/ijsnem.18.4.389 |
| [42] | HANSEN J M, KLASS M, HARRIS C, et al. A reducing redox environment promotes C2C12 myogenesis:Implications for regeneration in aged muscle[J]. Cell Biol Int, 2007, 31(6): 546–553. DOI: 10.1016/j.cellbi.2006.11.027 |
| [43] | ZACCAGNINI G, MARTELLI F, MAGENTA A, et al. p66ShcA and oxidative stress modulate myogenic differentiation and skeletal muscle regeneration after hind limb ischemia[J]. J Biol Chem, 2007, 282(43): 31453–31459. DOI: 10.1074/jbc.M702511200 |
| [44] | ARDITE E, BARBERA J A, ROCA J, et al. Glutathione depletion impairs myogenic differentiation of murine skeletal muscle C2C12 cells through sustained NF-κB activation[J]. Am J Pathol, 2004, 165(3): 719–728. DOI: 10.1016/S0002-9440(10)63335-4 |
| [45] | LANGEN R C J, SCHOLS A M W J, KELDERS M C J M, et al. Tumor necrosis factor-αinhibits myogenesis through redox-dependent and -independent pathways[J]. Am J Physiol Cell Physiol, 2002, 283(3): C714–C721. DOI: 10.1152/ajpcell.00418.2001 |
| [46] | BARBIERI E, GUESCINI M, CALCABRINI C, et al. Creatine prevents the structural and functional damage to mitochondria in myogenic, oxidatively stressed C2C12 cells and restores their differentiation capacity[J]. Oxid Med Cell Longev, 2016, 2016: 1–12. |
| [47] | MORENO-NAVARRETE J M, FERNÁNDEZ-REAL J M. Adipocyte Differentiation[M]. New York, NY: Springer, 2012: 17-38. |
| [48] | HALL K D, HEYMSFIELD S B, KEMNITZ J W, et al. Energy balance and its components:Implications for body weight regulation[J]. Am J Clin Nutr, 2012, 95(4): 989–994. DOI: 10.3945/ajcn.112.036350 |
| [49] | KAZAK L, CHOUCHANI E T, LU G Z, et al. Genetic depletion of adipocyte creatine metabolism inhibits diet-induced thermogenesis and drives obesity[J]. Cell metab, 2017, 26(4): 600–671. |
| [50] | LIM K, PULLALAREVU S, SURABIAN K T, et al. Structural basis for the mechanism and substrate specificity of glycocyamine kinase, a phosphagen kinase family member[J]. Biochemistry, 2010, 49(9): 2031–2041. DOI: 10.1021/bi9020988 |
| [51] | KAN H E, JAN RENEMA W K, ISBRANDT D, et al. Phosphorylated guanidinoacetate partly compensates for the lack of phosphocreatine in skeletal muscle of mice lacking guanidinoacetate methyltransferase[J]. J Physiol, 2004, 560(1): 219–229. DOI: 10.1113/jphysiol.2004.067926 |
| [52] | LYGATE C A, AKSENTIJEVIC D, DAWSON D, et al. Living without creatine:Unchanged exercise capacity and response to chronic myocardial infarction in creatine-deficient mice[J]. Circ Res, 2013, 112(6): 945–955. DOI: 10.1161/CIRCRESAHA.112.300725 |
| [53] | 刘洋, 李蛟龙, 张林, 等. 胍基乙酸和甜菜碱对育肥猪肌肉能量代谢和肉品质的影响[J]. 畜牧兽医学报, 2015, 49(9): 1557–1563. LIU Y, LI J L, ZHANG L, et al. Effects of dietary supplementation of guanidinoacetic acid and combination of guanidinoacetic acid and betaine on muscle energy metabolism, meat quality in finishing pigs[J]. Acta Veterinaria et Zootechnica Sinica, 2015, 49(9): 1557–1563. (in Chinese) |
| [54] | 韩剑众, 顾振宇, 吴劲松, 等. 一水肌酸对肥育猪胴体组成和肉质的影响及机理研究[J]. 中国粮油学报, 2007, 22(3): 101–106. HAN J Z, GU Z Y, WU J S, et al. Effects and mechanism:Creatine monohydrate on carcass characteristics and meat quality of finishing swine[J]. Journal of the Chinese Cereals and Oils Association, 2007, 22(3): 101–106. (in Chinese) |
| [55] | STEAD L M, AU K P, JACOBS R L, et al. Methylation demand and homocysteine metabolism:Effects of dietary provision of creatine and guanidinoacetate[J]. Am J Physiol Endocrinol metab, 2001, 281(5): E1095–E1100. DOI: 10.1152/ajpendo.2001.281.5.E1095 |
| [56] | STEAD L M, BROSNAN J T, BROSNAN M E, et al. Is it time to reevaluate methyl balance in humans?[J]. Am J Clin Nutr, 2006, 83(1): 5–10. DOI: 10.1093/ajcn/83.1.5 |
| [57] | OHUCHI S, MATSUMOTO Y, MORITA T, et al. High-casein diet suppresses guanidinoacetic acid-induced hyperhomocysteinemia and potentiates the hypohomocysteinemic effect of serine in rats[J]. Biosci Biotechnol Biochem, 2008, 72(12): 3258–3264. DOI: 10.1271/bbb.80543 |
| [58] | SETOUE M, OHUCHI S, MORITA T, et al. Hyperhomocysteinemia induced by guanidinoacetic acid is effectively suppressed by choline and betaine in rats[J]. Biosci Biotechnol Biochem, 2008, 72(7): 1696–1703. DOI: 10.1271/bbb.70791 |