(湖北工业大学 发酵工程教育部重点实验室,工业发酵湖北省协同创新中心,湖北 武汉 430068)
摘 要:虾青素(astaxanthin)是一种类胡萝卜素,具有很强的抗氧化活性,抗癌功能,显著的着色能力以及增强免疫力等功能。本文介绍 了虾青素的生物活性及其在食品、化妆品、保健品、水产养殖和医药等领域的应用,并着重对虾青素的发酵法生产研究现状进行了综述,提出了虾青素未来的主要研究方向,以期为虾青素的研究开发和综合利用提供理论依据。
关键词:虾青素;生物活性;发酵

虾青素(astaxanthin)是一种类胡萝卜素,分子式C 40H 52O 4,摩尔质量596.86 g/mol,全称3,3'-二羟基-β,β'-胡萝卜素-4,4'-二酮(图1a),有(3R, 3'R)、(3R,3'S)、(3S, 3'S)3 种旋光异构体(图1b~1d),化学结构见图1。Andrewes等 [1-2]研究发现红球藻和磷虾卵中虾青素的构象为(3S, 3'S),1975年又分析了红法夫酵母中虾青素的构象,发现92%的异构体是(3R, 3'R)。虾青素具有很强的抗氧化活性,抗癌功能,显著的着色能力以及增强免疫力等功能,在水产养殖、食品、化妆品、医药和保健品等领域均被利用 [3-10]。

图1 虾青素的化学结构式(a)和3 种旋光异构体(b~d) [11--22]
Fig.1 Chemical structure (a) and three stereoisomers (b-d) of astaxanthin [1-2]
目前,虾青素的生产主要有3 种方法:化学合成法、提取法和微生物发酵法(表1)。化学合成法具有生产成本较低,产量高等优点,但是合成的虾青素多为顺式结构,而动物机体只对反式虾青素有较高的吸收利用率;提取法主要从水产品加工的废弃物中提取虾青素,提取前必须除去废弃物中的石灰质成分,提取费用高且容易污染;微生物发酵法主要有两种方式:一是利用藻类生产;二是利用酵母发酵生产,发酵法生产的虾青素天然无污染,但受到成本高、培养条件苛刻、产量低等因素的制约 [11-12]。笔者参考近年来国内外有关文献对虾青素的生物活性及应用进行了概述,并着重综述了虾青素的发酵法生产研究现状,提出了虾青素未来的主要研究方向,以期为虾青素的研究开发和综合利用提供理论依据。
表1 虾青素的生产方法
Table 1 Comparison of production methods for astaxanthin

方法 来源 优点 缺点 主要结构 参考文献化学合成法 多步化学和生物催化反应虾青素含量高,在水产养殖中具有一定的竞争优势化学合成困难,成本高,产品中含有催化副产物,可能对安全造成隐患。合成的虾青素为游离态,易被氧化,一般为顺式构型,不利于 人和动物的吸收(3R, 3'R)、(3R,3'S)和(3S, 3'S)3 种异构体以1∶2∶1的比例存在[13-14]提取法虾、蟹等甲壳类,鱼类水产品加工废弃物沿海水产资源丰富,甲壳类动物年产量大,水产加工废弃物中含有大量的虾青素水产品废弃物中虾青素含量低,甲壳中灰分、几丁质的含量高,限制了虾青素的提取和利用,提取成本高,易被破坏,污染环境(3R, 3'R) [15-16]藻类 雨生红球藻、衣藻、 裸藻雨生红球藻是自然界中虾青素含量最高的生物,是最具商业开发潜力的微藻培养周期长,生长条件苛刻,需要光照,生产场所受到限制,虾青素存在于厚壁孢子中的提取率低、连续性差,不利于大规模培养(3S, 3'S) [17-19]微生物发酵法 真菌红法夫酵母、深红酵母、粘红酵母红法夫酵母被认为是除雨生红球藻外最适合生产虾青素的微生物天然的红法夫酵母中虾青素含量低,生长易受温度、溶氧、碳氮源、pH值等发酵条件的影响,技术要求高,生产工艺复杂(3R, 3'R) [2,16,20]细菌 土壤杆菌、分支杆菌色素提取容易,可作为基因工程宿主菌细菌生长慢,生物量小,虾青素含量很低,无工业应用前景 [21-22]
1 虾青素的生物活性及应用现状
虾青素具有抗氧化、抗癌、增强免疫力、预防神经系统及心血管疾病、提高动物繁殖能力和存活率、着色等功能,已被广泛接受和应用。
1.1 虾青素的生物活性
1.1.1 抗氧化
虾青素是一种非VA原的类胡萝卜素,其独特共轭双烯以及不饱和羰基的化学结构赋予了它超 强的抗氧化活性,其淬灭活性氧和捕捉自由基的能力是其他类胡萝卜素的10 倍以上,是VE的80~550 倍 [23],所以有“超级VE”之称。Kiyotaka等 [24]通过随机、双盲人体实验证明了虾青素有助于改善红细胞抗氧化性能,降低磷脂氢过氧化物水平;Lee等 [25]比较了番茄红素、玉米黄素、叶黄素、异玉米黄素和虾青素5 种类胡萝卜素在豆油光氧化作用中活性氧能力,发现虾青素淬灭活性氧能力最强。
1.1.2 抗癌
研究发现, 虾青素具有比β-胡萝卜素等类胡萝卜素更强的抑制癌变的能力。Kim等 [26]通过对被注入易引起胃溃疡性病变的萘普生小鼠的研究发现,随着饲喂虾青素,小鼠体内的胃溃疡不断减少甚至消失,防止了胃癌的发生。另外许多相关研究表明虾青素对由黄曲霉毒素诱发的肝癌、口腔癌、膀胱癌、结肠癌、皮肤癌和乳腺癌等癌症都有着一定的预防和治疗作用 [27-31]。
1.1.3 增强免疫力
虾青素具有很强的诱导细胞分裂活性,在机体内能起免疫调节作用 [32]。Park等 [33]研究发现虾青素能增强猫体内外周血单个核细胞增殖和细胞毒活性能力,并可以提高血浆免疫球蛋白和抗体的浓度。Boon等 [34]研究表明虾青素能增强狗机体的免疫力。
1.1.4 预防神经系统及心血管疾病
虾青素可以有效治疗脊髓损伤、Parkinson综合征、Alzheimer综合征等中枢神经系统疾病 [35-36]。研究发现虾青素能明显降低血液中低密度脂蛋白胆固醇(low density lipoprotein-cholesterin,LDL-C)的水平,防止心血管疾病的发生,而其他类胡萝卜素如β-胡萝卜素对LDL-C没有明显的影响 [37]。
1.1.5 提高动物繁殖能力和存活率
虾青素在动物生殖过程中的作用类似于激素 [38],虾青素可作为受精卵激素改善卵质,保护受精卵抵御恶劣的环境,促进卵的成熟,减少胚胎死亡,提高生殖能力。Torrissen等 [39]发现成年鲑、鳟鱼类在某些特定水域中不能繁衍后代,原因是它们产的卵子中和鱼苗体内缺乏虾青素,所以虾青素及其他类胡萝卜素可能是通过提高动物免疫力来提高存活率的。
1.1.6 着色
虾青素是一种脂溶性色素,能够不经修饰、转换直接存储在组织中 [40],所以能使一些鸟类的羽毛及水生动物肌肉皮肤呈红色或金色。Johnson等 [41]在鲑鱼等饲料中加入破碎的红法夫酵母,发现鱼体皮 肤和肌肉中都积累了大量的虾青素,颜色亮丽,味道鲜美。虾青素作为一种着色剂加到畜、禽饲料中,可使禽蛋的蛋黄颜色加深,更有营养价值,增强着色的效果,从而提高市场竞争力。
1.2 虾青素的应用现状
目前虾青素主要作为一种功能性色素广泛应用于水产养殖、食品、化妆品等领域,主要用作鱼类、虾蟹等甲壳类动物以及家禽的饲料添加剂,提高畜禽、鱼类的繁殖能力和成活率,改善健康状况,优化体色肉质。天然虾青素已被作为食品添加剂用于食品的着色、保鲜及增强营养。Bjerkeng等 [42]研究表明虾青素有助于鳟鱼片的保鲜。近年随着虾青素生物功能研究和药理药效实验的不断深入,虾青素因其在心血管疾病、癌症、代谢综合征、糖尿病、神经退行性疾病、眼科疾病、皮肤病等疾病的预防和治疗中具有突出的效果而受到了科学界极大的关注,表明虾青素在医药、保健品等领域中具有巨大的潜在应用价值和广阔开发前景 [43-45]。
2 发酵法生产虾青素的研究进展
当前利用发酵法生产虾青素主要有两种方式:一是利用藻类生产;二是利用酵母发酵生产虾青素。
2.1 利用藻类生产虾青素
自然界中一些藻类如衣藻(Chlamydomonas)、伞藻(Acetabularia)、裸藻(Euglena)中含有虾青素。雨生红球藻(Haematococcus pluvialis)是天然虾青素含量最高的生物,达10~40 mg/g,因而是目前生产虾青素的主要藻类。在胁迫条件下,雨生红球藻能诱导积累虾青素,积累量可达藻细胞干质量的1.0%~5.0%,且所含虾青素的结构多为反式结构,被公认为天然虾青素的最佳生物来源 [46-47]。
2.1.1 雨生红球藻的生物特性 [48-49]
雨生红球藻是一种淡水单细胞绿藻,属于绿藻门,团藻目,红球藻科,红球藻属,能够进行光合自养和化能异养,且两种营 养方式可同时进行,藻细胞在适宜的生长条件下为运动细胞,在胁迫条件下,如受到强光照射,缺氮、磷等因素的刺激,由运动细胞变为不动细胞,此时开始大量积累虾青素。虾青素在叶绿体内合成,然后转运、贮存到细胞质内的脂质液泡中。
2.1.2 雨生红球藻培养技术生产虾青素的研究现状
雨生红球藻培养技术的研究从20世纪90年代初就开始了,国外研究比较多,国内相对较少。目前雨生红球藻培养技术的研究主要集中在两个方面:一是提高生物量,包括培养基、培养方法的优化和确定最佳的培养条件等基础性研究;二是诱导虾青素的合成,即在较高生物量的基础上,改善营养和环境条件,诱导细胞大量合成虾青素 [50]。雨生红球藻的培养方法主要包括分批培养、补料培养、两步培养和半连续培养,在实际的操作过程中有时混合使用各种培养方法以提高虾青素产量 [51]。
2.1.3 雨生红球藻培养技术生产虾青素的展望
侯冬梅 [52]对雨生红球藻产虾青素的光诱导工艺的基本条件及营养成分对 诱导积累虾青素的效果进行了研究和户外验证,初步确定了户外雨生红球藻光诱导的基本工艺,并发现雨生红球藻固定化吸附诱导需水量少,难受到原生动物的污染,具有成本低、节省水资源、环保等优点。
尽管利用雨生红球藻生产虾青素已经成为国内外虾青素研究的热点,但依然有许多不足。雨生红球藻中虾青素的合成、积累和藻的生长呈相反的趋势:即当藻细胞生长条件适宜时,虾青素的合成速率却较低;当虾青素快速积累时,环境条件却不利于藻细胞的生长,导致诱导虾青素积累的逆境胁迫与藻细胞生物量的增加互成矛盾。而且雨生红球藻培养周期长,需要光照,生产 场所受到限制,藻类破壁释放虾青素产率低,雨生红球藻诱导积累虾青素的具体机制又尚不清楚,从而限制了大规模化培养雨生红球藻生产虾青素 [50-52]。
总之,雨生红球藻的培养技术虽已经应用于商业化生产,但技术还不成熟,仍需要深入细致的研究,可以通过探索雨生红球藻诱导积累虾青素的具体机制,从代谢工程和系统生物学的角度进行发酵菌种育种和发酵优化,也可以通过筛选或基因工程技术构建出生长周期短且薄壁的雨生红球藻细胞来提高虾青素的产量。
2.2 利用酵母发酵生产虾青素
自然界中含有虾青素的酵母主要有红法夫酵母(Phaffia rhodozyma/Xanthophyllomyces dendrorhous)、深红酵母(Rhodotorula rubra)和粘红酵母(Rhodotrula glutinis)等。红法夫酵母中虾青素含量最多,野生株系中虾青素达细胞干质量的0.05%,一些突变株系中达0.3%。红法夫酵母是真菌界、真菌门、半知菌亚门、隐球酵母科、红法夫酵母属的唯一种,繁殖方式为无性繁殖中的芽殖,于1970年在美国的阿拉斯加的高山和日本北海道一带山区落叶松的渗出液中分离得到,可利用有氧呼吸和发酵两种方式代谢,是目前国内外微生物发酵生产虾青素普遍采用的真菌 [53-55]。
红法夫酵母可利用多种糖作为碳源发酵生产虾青素,细胞代谢繁殖快,可实现高密度培养;生产周期短,成本低,天然无污染;细胞壁容易破碎,生产的虾青素为反式结构,破壁后可直接作为饲料添加剂;被认为是除雨生红球藻外最为适合生产虾青素的微生物。然而红法夫酵母的虾青素含量远不如雨生红球藻,易受温度、溶氧、碳氮源、pH值等发酵条件的影响。且红法夫酵母中虾青素的积累与酵母细胞的生长速率也是一对矛盾,往往在改变发酵条件增加虾青素的合成、积累量时,菌体量却相应降低。因此,未来的研究可以通过探究细胞生理功能,选育虾青素高产菌株,开发廉价发酵培养基,优化发酵工艺来实现红法夫酵母工业化生产虾青素。目前国内外许多研究主要集中在虾青素的生物合成途径、高产菌株的选育、发酵过程的控制与优化以及虾青素的提取与检测等方面。
2.2.1 虾青素的生物合成途径
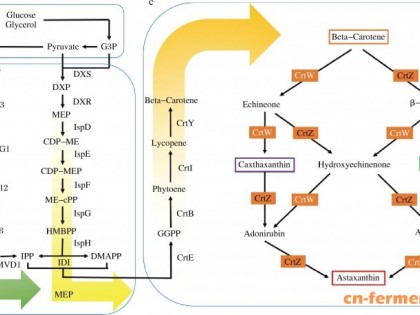
红法夫酵母生物合成虾青素的途径分为两个阶段:第一阶段为β-胡萝卜素的合成;第二阶段为β-胡萝卜素通过氧化 及羟基化生成虾青素 [56-57]。比较系统全面的虾青素生物合成途径如图2所示。
异戊烯焦磷酸异构酶(isop entenyl pyrophosphate isomerase)由idi基因编码,催化烯焦磷酸(IPP)异构化为二甲基烯丙基焦磷酸酯(DMAPP) [59]。从类异戊二烯前体物质到β-胡萝卜素的过程需要4 种酶:1)四异戊二烯焦磷酸(GGPP合成酶,由crtE基因编码,能催化3 分子IPP与DMAPP缩合成前体物质C 20GGPP [60];2)八氢番茄红素合成酶(phytoene synthase),由crtYB基因编码,催化两分子GGPP缩合形成番茄红素(lycopene) [61];3)八氢番茄红素脱氢酶(phytoene desaturase),由crtI基因编码,主要催化八氢番茄红素通过一系列脱氢反应生成为番茄红素 [62];4)番茄红素环化酶(lycopene cyclase),由crtYB基因编码,催化番茄红素分子两端发生两次环化,依次生成γ-胡萝卜素和β-胡萝卜素 [61]。最后β-胡萝卜素经过两步酶促反应最终生成虾青素,其中酮化酶(ketolase)催化β-胡萝卜素分子上引入2 个4位的酮基,羟化酶(hydroxylase)催化引入2 个3位的羟基。在红法夫酵母细胞中,这两步反应则通过由crtS基因编码的虾青素合成酶来实现,它先对β-胡萝卜素进行4位的酮化,然后进行3位的羟化 [63]。此外,.lvarez等 [64]发现细胞色素P450还原酶(由crtR基因编码)对红法夫酵母中的crtS基因起辅助作用,可为底物的氧化提供电子。Ukibe等 [65]表明在产β-胡萝卜素的酿酒酵母中单独表达crtR基因并没有虾青素生成,而crtS和crtR基因协同表达时,则有少量的虾青素累积。红法夫酵母虾青素生物合成途径中部分相关酶及其基因如表2所示。

图2 红法夫酵母中虾青素的生物合成途径 [22,5588]
Fig.2 Biosynthetic pathway leading to astaxanthin formation in Phaffi a rhodozyma [2,58]
Opp.邻苯基苯酚(o-phenyl phenol);DMAPP.二甲基烯丙基焦磷酸酯(dimethyl allyl pyrophosphate);GGPP.四异戊二烯焦磷酸(geranylgeranylpyrophosphate);IPP.烯焦磷酸(isopentenyl pyrophosphate);HDCO.金盏花红素;H. β-胡萝卜素羟化酶;K. β-胡萝卜素酮化酶。
表2 红法夫酵母虾青素生物合成途径中部分相关酶及其基因
Table 2 Enzymes and their encoding genes related to the biosynthetic pathway of astaxanthin in Phaffifi a rhodozyma

酶名称 编码基因 功能 申请号 参考文献异戊烯焦磷酸异构酶 idi IPP→DMAPP Y15811 AB019035.1 DQ235686.1[59,61]四异戊二烯焦磷酸合成酶 crtE 3IPP, DMAPP→GGPP A63889 DQ012943 DQ016502.1[60]八氢番茄红素合成酶 crtYB GGPP→八氢番茄红素 AJ133646 AY177204.1 [61]八氢番茄红素脱氢酶 crtI 八氢番茄红素→番茄红素 AY177424.1 Y15007 [62]番茄红素环化酶 crtYB 番茄红素→β-胡萝卜素 AY177204.1 AJ133646 [61]虾青素合成酶 crtS β-胡萝卜素→虾青素AX034666 HM204708.1 AY946023.1 DQ202402.1[63,66-67]细胞色素P450还原酶 crtR β-胡萝卜素→虾青素 EU884134.1 EU884133.1 [64-65,67]
2.2.2 虾青素高产菌株的选育
红法夫酵母野生菌株产虾青素仅350 .g/g左右,发酵温度低,一般为18~22 ℃,易于退化,而且当葡萄糖的质量浓度超过2 g/100 mL时,虾青素产量会急剧的下降,这些性质使其工业化生产受到制约 [68]。因此需要通过选育获得高产虾青素、耐高温、发酵温度高、不易退化的优良菌种,再通过对发酵条件的优化可使虾青素的产量达到最大。红法夫酵母高产菌株的选育主要有诱变育种、原生体融合和基因工程育种3 种方式。
徐彩荣 [57]采用超声波、超声波-氯化锂及亚硝基胍对红发夫酵母进行诱变处理,用二苯胺及2-D-脱氧葡萄糖筛选虾青素高产菌株进行,最终得到一株虾青素含量高,遗传性能稳定的突变菌株N-22,其虾青素含量为949.19 μg/g,比出发菌株提高了4.37 倍。Sun等 [69]用小于10 kGy的γ射线重复诱变,选育得到一株虾青素高产菌株,产量为3.3 mg/g,较野生菌株提高了50%。韩伟 [51]经过多次紫外诱变、微波诱变处理,二苯胺推理筛选,最终获得一株遗传稳定性良好,虾青素产量高的突变菌株TY-I-8,其虾青素产量达到了12.92 mg/L。Schmidt等 [20]利用原生质体融合技术,将亲本细胞F406和F307原生质体融合得到了一株虾青素高产菌株。Verdoes等 [61]首次研究了红法夫酵母番茄红素脱氢酶基因,并将idi基因成功导入大肠杆菌中,得到虾青素高产菌株,为红法夫酵母虾青素合成的基因工程育种研究奠定了基础。目前,诱变育种仍然是对高产菌株进行选育的主要途径。因此,应该寻找新型的诱变育种技术运用到红法夫酵母的菌种改良中,以提高虾青素的产量。
2.2.3 发酵过程的控制与优化
发酵过程的控制与优化主要集中于培养基和发酵条件、前体物质和增强剂、发酵方法等因素对虾青素产量的影响。获得虾青素高产菌株后,通过优化培养基和发酵条件,可进一步提高虾青素的产量,同时研制廉价的培养基和优化发酵工艺来降低成本,为红法夫酵母工业化生产虾青素提供理论依据。
朱明军等 [70]通过实验获得了适合红法夫酵母生长的“糖蜜+硫酸铵+尿素”的简单培养基配方,何璞等 [71]利用响应面法优化得到了蔗糖和酵母粉的最佳培养基,菌株产虾青素含量是优化前的近2 倍。郑蕾 [72]研究发现蔗糖是红法夫酵母生长的最佳碳源,葡萄糖是虾青素在细胞内积累的最佳碳源;最佳的氮源组成为(NH 4) 2SO 44.9 g/L、蛋白胨6.2 g/L、酵母膏1 g/L,虾青素的产量达6.78 mg/L,发酵产率提高了1.8 倍左右。Fang等 [73]研究表明蛋白胨是最好的单一氮源,而酵母膏-牛肉膏-硝酸钾质量比为1∶1∶1.5的混合氮源更有利于虾青素的积累。有研究提出以甘蔗糖蜜为主要碳源,蛋白胨为主要氮源,硝酸钾为无机盐,再配以生长因子的培养基是适合红法夫酵母生长的最佳培养基,通过对发酵条件的优化,能有效提高虾青素的产量 [43]。Johnson等 [74]探究了红法夫酵母的基本生长条件:最适培养温度及色素积累温度为20~22 ℃,适合生长的最佳pH值为5.8,而虾青素产率最大时的最佳pH值为5.0。杜似鹃等 [75]研究表明发酵液pH 8.0、接种量20%、振荡速率160 r/min、发酵时间168 h条件下,虾青素产量最大。王立梅等 [76]对发酵条件进行优化后,虾青素产量从5.89 mg/L提高到10.9 mg/L。刘滢等 [77]将发酵分成两个阶段,不同的阶段选择不同的发酵培养基和发酵条件,有效提高了菌株的生物量、生长速率及虾青素产量。对培养基中的营养组分进行选择和优化是对虾青素进行工业化生产的主要前提,也是降低虾青素生产成本的重要途径之一(表3)。
研究表明,在酵母发酵过程中,向已经确定了营养组分及其配比的发酵培养基中添加某些前体物质或色素合成的增强剂如菠萝汁、西红柿汁、甲羟戊醛、柠檬酸、乙酸、乙醇、豆油等均可有效提高虾青素的产量 [51]。Johnson等 [74]在红法夫酵母的培养基中添加含有大量前体物质(番茄红素)的番茄汁,红法夫酵母虾青素产量达到了814 μg/L。柠檬酸是三羧酸循环中的重要物质,有利于提高体系中的乙酰CoA,而乙酰CoA是虾青素生物合成的起始,因而被视为虾青素生物合成的一种前体物质。研究发现通过向发酵培养基中添加柠檬酸盐,可提高虾青素的产量 [78](表3)。
目前,红法夫酵母的发酵方法主要有分批发酵、连续补料发酵、间歇补料发酵和两步补料发酵等。分批发酵操作简单,常用于工业生产中。汪洪涛等 [79]用甘油做碳源,以蛋白胨和酵母膏为混合氮源一次投料发酵168 h,虾青素产量为33.7 mg/L。通过补料发酵可以实现酵母的高密度培养,高密度培养基本思想在于对胞内次生代谢产物,在保证比生产率的前提下尽可能提高细胞密度,使体积生产率大幅提高,提高色素和菌体的生产效率。Vázquez等 [80]在2 L发酵罐中用主要是木糖的木材水解液做碳源,在装液量1 L,温度22 ℃的条件下,对连续补料发酵和间歇补料发酵进行了比较,实验结果表明间歇补料发酵的生物量和虾青素产量都高于连续补料发酵。间歇补料发酵和连续补料的生物量分别为30.6 g/L和10.3 g/L,虾青素产量分别为30.5 mg/L和7.19 mg/L。两步补料发酵是一种特殊间歇补料发酵。Yamane等 [81]研究发现,在供氧量充足、含氮量固定的前提下,培养基中高C/N可提高虾青素的合成速率,但低C/N却有利于菌体的生长。根据这一特点进行两步流加法发酵:第一步控制低C/N促进菌体细胞的生长;第二步流加糖提高C/N增加虾青素的产量。结果生物量30 g/L,虾青素含量0.72 mg/g,虾青素产量21.6 mg/L。目前认为通过高密度培养技术更有利于虾青素的积累,因此是实现红法夫酵母工业化生产虾青素最理想的发酵方法。高密度培养技术可以延长微生物的对数生长期和稳定期的持续时间,有效增加菌体生物量和代谢产物的积累。既避免了分批发酵因为一次投料过多造成的底物抑制,葡萄糖的阻遏效应以及因菌体生长过旺而导致的供氧不足,又比连续发酵更易操作,更为精确,应用于实际生产中可以避免原料的浪费,缩短生产周期,提高产物的浓度,对于降低生产成本,提高生产效率有着深远的意义 [22,44](表3)。
表3 红法夫酵母菌株的选育及其发酵过程的控制与优化对虾青素产量的影响
Table 3 Astaxanthin productivity obtained with different strains of Xanthophyllomyces dendrorhous using low-cost raw materials, inducers,and optimal fermentation parameters

注:*.文献中没有提出具体数据。
菌株 方法 生物量/(g/L)虾青素含量/(mg/g)虾青素产量/(mg/L) 规模 参考文献菌株的选育E5042 低能量粒子束 30.7 2.5 * 50 L发酵罐 [82]3A-4-8 γ射线 4.0 3.3 * 摇瓶 [69]VKPM Y2476 紫外灯 53.0 4.4 235.0 摇瓶 [83]培养基和发酵条件ATCC 24202甘蔗汁和尿素 19.3 0.4 7.4 2 L发酵罐 [84]N9 葡萄汁 * 1.3 9.8 2 L发酵罐 [85]R1 椰子汁 6.2 1.8 * 摇瓶 [86]UCD-67-210 糖蜜 14.1 1.1 15.3 摇瓶 [87]25-2 枣子汁 39.0 * 23.8 3 L发酵罐 [88]TISTR 5730 芥末废液 19.6 * 25.8 摇瓶 [89]NRRL Y-17268桉树叶水解物 30.6 1.0 30.5 2 L发酵罐 [80]2A2N 甜菜糖蜜 36.0 1.1 40.0 100 L发酵罐 [90]CTD004 培养基优化 * * 149.4 摇瓶 [91]X. dendrorhous 供氧 19.4 0.8 14.5 发酵罐 [92]JH1 补葡萄糖 23.8 1.2 29.0 发酵罐 [93]VKPM Y2476 白光灯 55.0 4.0 221.0 摇瓶 [83]VKPM Y2476 白光灯 88.0 4.7 420.0 10 L发酵罐 [83]VKPM Y2476 白光灯 86.0 4.1 350.0 800 L发酵罐 [83]CHU-R 工艺优化 26.0 23.0 * 摇瓶 [22]前体物质和增强剂NRRL Y-1092 柠檬酸 盐 * 0.2 2.4 摇瓶 [78]ENM 5 H 2O 2 * 1.3 10.4 摇瓶 [94]G276 植物提取物 19.8 * 26.2 7 L发酵罐 [95]发酵方法ATCC 24202两步补料发酵 33.6 0.5 16.0 5 L发酵罐 [96]ZJUT46 补料发酵 17.4 * 39.0 2 000 L发酵罐 [81]ZJUT003 分批发酵 20.6 2.6 52.3 发酵罐 [97]ENM 5 灌注培养 54.8 * 58.3 摇瓶 [98]
2.2.4 虾青素的提取与检测 [99-101]
虾青素是胞内产物,而酵母菌的细胞壁厚而坚韧,给其提取造成很大障碍。因此虾青素的提取重点在于酵母的破壁。破壁的方法主要有机械法、物理法、化学法和酶法4 种。
机械法是利用机械设备将细胞壁撕裂,靠胞内渗透压使内含物释放出来。目前主要有高压均浆法、喷雾撞击破碎法、珠磨法及超声波破碎法。机械法操作简便而被广泛使用,但易引起局部高温而导致虾青素氧化损失。
物理法有温差法和压力差法等,目前较为常用的是温差法。物理法没有其他物质掺杂,不会导致辐射能源污染,避免了高温和化学物质对虾青素的破坏。
化学法主要有酸碱加热法、有机溶剂渗透和二甲基亚砜法等。碱提法和酸溶法需要消耗大量碱和有机酸,导致污水排放增加,对环境中水源污染严重,近几年已逐渐退出历史舞台。研究发现酸热法破壁所得提取液中总类胡萝卜素浓度最高,有机溶剂渗透破壁次之,二甲基亚砜法破壁所得提取液中虾青素浓度最高 [51]。
酶法能水解细胞壁骨架成分β-葡聚糖,所以相对于其他方法能更加有效地破壁,且不使虾青素溢出菌体避免损失。同时酶法处理条件温和,提取的虾青素比其他方法破壁提取所得虾青素稳定,其对设备也无需像酸法一样有耐酸、耐高温的特殊要求,处理过程对环境造成的污染也较小,因此是实现工业化最为理想的方法。用于提取的一些新兴的方法如负压空化法、超临界流体萃取法、微波处理提取法,目前也逐步开始应用于工业生产。
在检测方面,层析法应用最为广泛,主要用到薄层层析法(thin-layer chromatography,TLC)和柱层析法,薄层层析法的分离度不高,结果受外界干扰因素大,重现性差,不便于实验操作,所以对操作过程要求极高。柱层析法是最常用的纯化方法之一,与其他色谱方法相比,柱层析设备低廉,更换固定相和流动相方便;虽然柱效不是特别高,但是利用不同固定相和流动相的组合能够实现一些相对简单样品的分离与纯化,应用范围很广。高效液相色谱(high performance liquid chromatography,HPLC)法分离效果更好,但成本较高。与薄层层析和柱层析相比,高效液相色谱的仪器价格高昂,需要定时维修检查,使用时对仪器的磨损度大,无法在工业中大规模普及。
3 结 语
目前,红法夫酵母发酵生产虾青素的生物合成途径及代谢调控机理被逐渐阐明,在高产菌株的选育、培养基和发酵条件的优化方面取得了较大的进展。但是依然存在着虾青素产量低,生产成本高等问题,制约了虾青素的大规模工业化生产。要突破此瓶颈除了选育高产菌株,优化发酵工艺,还应从以下四方面进行更为深入的研究:1)不断完善虾青素的生物合成途径及代谢调控机理,特别是雨生红球藻诱导积累虾青素的具体机制,从代谢工程和系统生物学的角度进行发酵菌种育种和发酵优化;2)以现代分子生物学知识为理论,利用基因工程技术将虾青素合成关键酶基因通过基因重组定向构建出高产菌株。其载体可以是红法夫酵母和雨生红球藻,也可以选择大肠杆菌和乳酸菌等细菌;3)研发新型的生物反应器,解决高密度培养存在的高浓度基质对生长的抑制,高的氧需求,培养基的黏度不断增加,红法夫酵母与雨生红球藻共有的虾青素的积累和菌体的生产量呈相反趋势等问题;4)寻找合适的酶,使其不但能最大程度的破壁,而且可以保证虾青素的稳定性不被破坏,利用先进的分离纯化技术提高产量。
虾青素因其独特的生物学功能,在医药、高级保健品等领域必将有着巨大的应用价值和广阔的开发前景,所以实现虾青素的工业化生产尤为重要,相信这四方面的研究是虾青素未来的主要研究方向,特别是后两方面可能成为未来解决虾青素产量低,生产成本高等问题的关键技术。
参考文献:
[1] ANDREWES A G, BORCH G, LIAAEN-JENSEN S, et al. On the absolute configuration of astaxanthin and actinoerythrin[J]. Acta Chimica Stand, 1974, 28(1): 730-736.
[2] ANDREWES A G, PHAFF H J, STARR M P. Carotenoids of Phaffi a rhodozyma a red pigmented fermenting yeast[J]. Phytochemistry,1976, 15(2): 1009-1011.
[3] PU J, DAVID B J, SATHIVEL S. Developing microencapsulated flaxseed oil containing shrimp (Litopenaeus setiferus) astaxanthin using a pilot scale spray dryer[J]. Biosystems Engineering, 2011,108(2): 121-132.
[4] KATSUMATA T, ISHIBASHI T, KYLE D. A sub-chronic toxicity evaluation of a naturalastaxanthin-rich carotenoid extract of Paracoccus carotinifaciens in rats[J]. Toxicology Reports, 2014, 1(2):582-588.
[5] SOWMYA R, SACHINDRA N M. evaluation of antioxidant activity of carotenoid extract from shrimp processing byproducts by in vitro assays and in membrane model system[J]. Food Chemistry, 2012,134(1): 308-314.
[6] MonROY R J, SEVILLA M, CARRON R, et al. Astaxanthinenricheddiet reduces blood pressure and improves cardiovascular parameters in spontaneously hypertensive rats[J]. Pharmacological Research, 2011,63(1): 44-50.
[7] REVES F A, MENDIOLA J A, IBANEZ E, et al. Astaxanthin extraction from Haematococcus pluvialis using CO 2-expanded ethanol[J]. The Journal of Supercritical Fluids, 2014, 92(1):75-83.
[8] TEIERA N, CEJAS J R, RODRIGUEZ C, et al. Pigmentation,carotenoids, lipid peroxides and lipid composition of skin of red porgy(Pagrus pagrus) fed diets supplemented with different astaxanthin sources[J]. Aquaculture, 2007, 270(1/4): 218-230.
[9] GUERIN M, HUNTLEY M E, OLAIZOLA M. Haematococcus astaxanthin: applications for human health and nutrition[J]. Trends in Biotechnology, 2003, 21(5): 210-216.
[10] BIRKELAND S, BIERKENG B. Extractabilities of astaxanthin and protein from muscle tissue of Atlantic salmon (Salmo salar) as affected by brine concentration and pH[J]. Food Chemi stry, 2004, 85(4):559-568.
[11] 董玉华, 赵元凤. 虾青素生物学来源和功能的研究进展[J]. 水产科学, 2005, 24(10): 50-52.
[12] AMAKASU K, ONO A, HIRANO D, et al. Distribution and density of Antarctic krill (Euphausia superba) and ice krill (E. crystallorophias)off Adélie Land in austral summer 2008 estimated by acoustical methods[J]. Polar Science, 2011, 5(2): 187-194.
[13] 滕长英, 张立, 秦松, 等. 虾青素的应用及生产来源[J]. 安徽农业科学, 2007, 35(8): 2298-2299.
[14] EMST H. Recent advances in industria lcarotenoid synthesis[J]. Pure and Applied Chemistry, 200 2, 74(8): 1369-1382.
[15] BON J A, LEATHERS T D, JAVASWAL R K. Isolation of astaxanthin over-producing mutants of Phaffia rhodozyma[J]. Biotechnology Letters, 1997, 19(2): 109-112.
[16] 高桂玲, 成家杨, 马炯. 雨生红球藻和虾青素的研究[J]. 水产学报,2014, 38(2): 297-304.
[17] KATSUDA T, SHIRAISHI H, ISHIZU N, et al. Effect of light intensity and frequency of flashing light from blue light emitting diodes on astaxanthin production by Haematococcus pluvialis[J]. Journal of Bioscience and Bioengineering, 2008, 105(3): 216-220.
[18] KIM Z, KIM S, LEE H, et al. Enhanced production of astaxanthin by flashing light using Haematococcus pluvialis[J]. Enzyme and Microbial Technology, 2006, 39(3): 414-419.
[19] IP P, WONG K, CHEN F. Enhanced production of astaxanthin by the green microalga Chlorella zofi ngiensis in mixotrophic culture[J]. Process Biochemistry, 2004, 9(11): 1761-1766.
[20] SCHMIDT I, SCHEWE H, GASSEL S, et al. Biotechnological production of astaxanthin with Phaffi a rhodozyma/Xanthophyllomyces dendrorhous[J]. Applied Microbiology and Biotechnology, 2011,89(3): 555-571.
[21] YUAN Jianping, CHEN Feng. Purification of trans-astaxanthin from a high-yielding astaxanthin ester-producing strain of the microalga Haematococcus pluvialis[J]. Food Chemistry, 2000, 68(4): 443-448.
[22] 谭颖嫦, 廖美德, 秦鹏, 等. CHU-R菌株产虾青素的发酵工艺研究[J].现代食品科技, 2012, 28(3): 289-296.
[23] MAOKA T, ETOH T, OSAWA A, et al. Characterization and singlet oxygen quenching activity of (3R)-3-hydroxy-4-ketotorulene and(3R)-3-hydroxy-4-keto-γ-carotene from the yeast Xanthophyllomyces dendrorhrous[J]. Journal of Oleo Science, 2012, 61(7): 401-406.
[24] KIYOTAKA N, TAKEHIRO K, TAIKI M, et al. Antioxid effect of astaxanthin on phospholipid peroxidation in human erythrocytes[J]. British Journal of Nutrition, 2011, 105(11): 1563-1571.
[25] LEE S H, MIN D B. Effects, quenching mechanisms, and kinetics of carotenoids in chlorophyll-sensitized photooxidation of soyean oil[J]. Journal of Agricultural and Food Chemistry, 1990, 35(38): 630-634.
[26] KIM J H, KIM Y S. Protective effect of astaxanthin on naproxeninduced gastric antral ulceration in rats[J]. European Journal of Pharmacology, 2005, 514(1): 53-59.
[27] 张晓丽, 刘建国. 虾青素的抗氧化性及其在营养和医药应用方面的研究[J]. 食品科学, 2006, 27(1): 258-262.
[28] LEE S H, CHERL W P, WONG S P, et al. Inhibition of benzo pyrene-indu ced mouse for estomach neoplasia by astaxanthin containing egg yolks[J]. Agricultural Chemistry and Biotechnology,1997, 40(6): 490-494.
[29] 项荣, 丁栋博, 李杰. 虾青素抑癌作用机制研究进展[J]. 天然产物研究与开发, 2013, 25(7): 1011-1015.
[30] GRADELET S, BON A, BERGES R, et al. Dietary carotenoids inhibit aflatoxin B 1-induced liver preneoplastic foci and DNA damage in the rat: role of the modulation of aflatoxin B 1metabolism[J]. Carcinogenesis, 1998, 19(3): 403-411.
[31] CHEW B P, PARK J S, WO NG M W, et al. A comparison of the anticancer activities of dietary betacarotene, canthaxanthin and astaxanthin in mice in vivo[J]. Anticancer Research, 1999, 19(3):1849-1853.
[32] 付佳. 天然虾青素的生物保健功能及安全性概述[J]. 国外医学: 卫生学分册, 2007, 34(6): 382-386.
[33] PARK J S, MATHISON B D, HAYEK M G, et al. Astaxanthin stimulates cell-mediated and humoral immune responses in cats[J]. Veterinary Immunology and Immunopathology, 2011, 144(3/4): 455-461.
[34] CHEW B P, MATHISON B D, HAYEK M G, et al. Dietary astaxanthin enhances immune response in dogs[J]. Veterinary Immunology and Immunopathology, 2011, 140(3/4): 199-206.
[35] TSO M O, LAM T T. Method of retarding and ameliorating central nervous system and eye damage: US Patent, 5527533[P]. 1996-06-18.
[36] SNODDE RLY D M. Ev idence for protection against agerelated macular degeneration by carotenoids and antioxidant vitamins[J]. The American Journal of Clinical Nutrition, 1995, 62(Suppl 1): 1448-1461.
[37] MIKI W, HOSODA K, Kondo K, et al. Astaxanthin-containing drink:JP, 10155459[P]. 1998-06-16.
[38] HIGUERA-C IAPARA I, F.LIX-VALENZUELA L, GOYCOOLEA F M. Astaxanthin: a review of its chemistry and applications[J]. Food Science and Nutrition, 2006, 46(2): 185-196.
[39] TORRISSEN O J, CHR ISTIANSEN R. Requirements for carotenoids in fish diets[J]. Journal of Applied Ichthyology, 1995, 11(3/4): 225-230.
[40] BJORNDAHL T. The economics of salmon aquaculture[M]. Oxford:Blackwell Scientific, 1990: 179-191.
[41] JOHNSON E A, VILLA T G, LEWIS M J. Phaffia rhodozyma as an 1astaxanthin source in salmonid diets[J]. Aquaculture, 1980, 20(2):123-134.
[42] BJERKENG B, JOHNSEN G. Frozen storage quality of rainbow trout(oncorhynchus mykiss) as affected by oxygen, illumination, and fillet pigment[J]. Journal of Food Science, 1995, 60(2): 284-288.
[43] DASILVA F O, TRAMonTE V L C G, PARISENTI J, et al. Litopenaeus vannamei muscle carotenoids ve rsus astaxanthin:acomparison of antioxidant activity and in vitro protective effectsagainst lipid peroxidation[J]. Food Bioscience, 2015, 9: 12-19.
[44] YANG Y, KIM B, PARK Y K, et al. Astaxanthin prevents TGF-β1-induced pro-fibrogenic gene expression by inhibiting Smad3 activation in hepatic stellate cells[J]. Biochimica et Biophysica Acta, 2015,1850(1): 178-185.
[45] SILA A, KAMOUN Z, GHLISSI Z, et al. Ability of natural astaxanthin from shrimp by-products to attenuate liver oxidative stress in diabetic rats[J]. Pharmacological Reports, 2015, 67(2): 310-316.
[46] SANDESH K B, VIDHYAVATHI R, SARADA R, et al. Enhancement of carotenoids by mutation and stress induced carotenogenic genes in Haematococcus pluvialis mutants[J]. Bioresource Technology, 2008,99(18): 8667-8673.
[47] HE P, DUNCAN J, BARBER J. Astaxanthin accumulation in the green alga Haematococcus pluvialis: effects of cultivation parameters[J]. Journal of Integrative Plant Biology, 2007, 49(4): 447-451.
[48] GR.NEWALD K, ECKERT M, HIRSCHBERG J, et al. Phytoene desaturase is localized exclusively in the chloroplast and up-regulated at the mRNA level during accumulation of secondary carotenoids in Haematococcus pluvialis (Volvocales Chlorophyceae)[J]. Plant Physiology, 2000, 122(4): 1261-1268.
[49] BOUSSIBA S. Carotenogenesis in the green alga Hae matococcus pluvialis: celluar physiology and stress response[J]. Physiologia Plantarum, 2000, 108(2): 111-117.
[50] 赵晓燕, 朱海涛, 陈军, 等. 响应曲面法优化有机溶剂萃取雨生红球藻中虾青素[J]. 食品工业, 2014, 35(10): 124-127.
[51] 韩伟. 虾青素高产菌株的推理筛选与发酵条件优化[D]. 泰安: 山东农业大学, 2010.
[52] 侯冬梅. 雨生红球藻高产虾青素的光诱导工艺研究[D]. 上海: 华东理工大学, 2014.
[53] WANG J, HAN D, SOMMERFELD M R, et al. Effect of initial biomass density on growth and astaxanthin production of Haematococcus pluvialis in an outdoor photobiore actor[J]. Journal of Applied Phycology, 2013, 25(1): 253-260.
[54] Y UAN Chao, DUA Lei, JIN Zhengyu, et al. Storage stability and antioxidant activity of complex of astaxanthin with hydroxypropyl-βcy clodextrin[J]. Carbohydrate Polymers, 2013, 91(1): 385-389.
[55] ANARJAN N, TAN C P. Developing a three component stabilizer system for producing astaxanthin nanodispersions[J]. Food Hydrocolloids, 2013, 30(1): 437-447.
[56] 高新征, 黄东爱, 邬强, 等. 虾青素生产及其生物合成途径的研究进展[J]. 海南医学院学报, 2013, 19(1): 141-144.
[57] 徐彩荣. 高产虾青素措施的研究[D]. 泰安: 山东农业大学, 2013.
[58] RODRÍGUEZ-S.IZ M, de la FUENTE J L, BARREDO J L. Xanthophyllomyces dendrorhous for the industrial production of astaxanthin[J]. Applied Microbiology Biotechnology, 2010, 88(3):645-658.
[59] KAJIWARA S, FRASER P D, KonDO K, et al. expression of an exogenous isopentenyl diphosphate isomerase gene enhances isoprenoid biosynthesis in Escherichia coli[J]. Biochemical Journal,1997, 324(2): 421-426.
[60] NIKLITSCHEK M, ALCAINO J, BARAHONA S, et al. Genomic organization of the structural genes controlling the astaxanthin biosynthesis pathway of Xanthophyllomyces dendrorhous[J]. Biological Research, 2008, 41(2): 93-108.
[61] VERDOSE J C, KRUBASIK P, SANDMANN G, et al. Isolation and functional characterisation of a novel type of carotenoid biosynthetic gene from Xanthophyllomyces dendrorhous[J]. Molecular & General Genetics, 1999, 262(3): 453-461.
[62] VERDOS J C, MISAWA N, VANOOYEN A J J. Cloning and characterization of the astaxanthin biosynthetic gene encoding phytoene desaturase of Xanthophyllomyces dendrorhous[J]. Biotechnology and Bioengineering, 1999, 63(5): 750-755.
[63] OJIMA K, BREITENBACH J, VISSER H, et al. Cloning of the astaxanthin synthase gene from Xanthophyllomyces dendrorhous and its assignment as a beta-carotene-3-hydroxylase/4-ketolase[J]. Molecular Genetics and Genomics, 2006, 275(2):148-158.
[64] .LVAREZ V, RODRÍGUEZ-S.IZ M, de la FUENTE J L, et al. The crtS gene of Xanthophyllomyces dendrorhous encodes a novel cytochrome-P450 hydroxylase involved in the conversion of β-carotene into astaxanthin and other xanthophylls[J]. Fungal Genetics and Biology, 2006, 43(4): 261-272.
[65] UKIBE K, HASHIDA K, YOSHIDA N, et al. metabolic engineering of Saccharomyces cerevisiae for astaxanthin production and oxidative stress tolerance[J]. Applied and Environmental Microbiology, 2009,75(1): 7205-7211.
[66] ALCAÍNO J, BARAHONA S, CARMONA M, et al. Cloning of the cytochrome p450 reductase (crtR) gene and its involvement in the astaxanthin biosynthesis of Xanthophyllomyces dendrorhous[J]. BMC Microbiology, 2008, 8(1): 169-181.
[67] 李天丽, 蔡慧农, 李利君, 等. 红法夫酵母虾青素合成途径相关基因的研究进展[J]. 微生物学通报, 2013, 40(9): 1673-1685.
[68] 田小群. 红法夫酵母(Phaffia rhodozyma)的诱变和原生质体融合及发酵优化研究[D]. 广州: 华南理工大学, 2003.
[69] SUN N, LEE S, SONG K B. Characterization of a carotenoid hyperproducing yeast mutant isolated by low-dose gamma irradiation[J]. International Journal of Food Microbiology, 2004,94(3): 263-267.
[70] 朱明军, 杜顺堂, 梁世中. 红法夫酵母以糖蜜为原料的培养基优化[J].河南工业大学学报, 2005, 26(1): 32-35.
[71] 何璞, 余龙江, 周蓬蓬, 等. 响应面法对红法夫酵母合成虾青素主要影响因素的优化[J]. 工业微生物, 2007, 37(1): 63-66.
[72] 郑蕾. 红法夫酵母产虾青素发酵培养基的优化[J]. 宿州学院学报,2012, 27(8): 60-62.
[73] FANG T J, CHENG Y. Improvement of astaxanthin production by Phaffi a rhodozyma through mutantion and optimization of culture conditions[J]. Journal of Fermental Bioengineering, 1993, 75(6): 466-469.
[74] JOHNSON E A, LEWIS M J. Astaxanthin formation by the yeast Phaffi a rhodozyma[J]. Journal of General and Applied Microbiology,1979, 115(1): 173-183.
[75] 杜似鹃, 梅艳珍, 胡耀辉, 等. 红法夫酵母生产虾青素的培养条件研究[J]. 食品科学, 2008, 29(8): 441-444.
[76] 王立梅, 杜似娟, 郑丽雪, 等. 响应面法优化高产虾青素菌株的发酵条件[J]. 食品科学, 2009, 30(21): 312-315.
[77] 刘滢, 叶淑红, 王际辉. 摇瓶培养条件对红法夫酵母突变菌株UV-801e-S015产虾青素的影响[J]. 食品工业科技, 2009, 30(3): 159-161.
[78] FLORES-COTERA L B, MARTIN R, SANCHEZ S. Citrate, a possible precursor of astaxanthin in Phaffi a rhodozyma: influence of varying levels of ammonium, phosphate and citrate in a chemically defined medium[J]. Applied Microbiology and Biotechnology, 2001,55(3): 341-347.
[79] 汪洪涛, 徐学明, 金征宇. 不同补料发酵方式对法夫酵母产虾青素的影响[J]. 生物技术, 2003, 13(5): 28-30.
[80] V.ZQUEZ M, MARTIN A M. Optimization of Phaffi a rhodozyma continuous culture through response surface methodology[J]. Biotechnology and Bioengineering, 1998, 57(3): 314-320.
[81] YAMANE Y I, HIGASHIIDA K, NAKASHIMADA Y, et al. Influence of oxygen and glucose on primary metabolism and astaxanthin production by P haffia rhodozyma in batch andfed-batch cultures: kinetic and stoichiometric analysis[J]. Applied and Environmental Microbiology ,1997, 63(11): 4471-4478.
[82] LIU Z Q, ZHANG J F, ZHENG Y G, et al. Improvement of astaxanthin p roduction by a newly isolated Phaffi a rhodozyma mutant with low-energy ion beam implantation[J]. Journal of Applied Microbiology, 2008, 104(3): 861-872.
[83] de la FUENTE J L, RODRIGUZE-SAIZ M, SCHLEISSNER C,et al. High-titer production of astaxanthin by the semi-industrial fermentation of Xanthophyllomyces dendrorhous[J]. Journal of Biotechnology, 2010, 148(2/3): 144-146.
[84] MORIEL D G, CHOCIAI M B, PEREIRA MACHADO I M, et al. Effect of feeding methods on the astaxanthin production by Phaffi a rhodozyma in fed-batch process[J]. Brazilian Archives of Biology and Technology, 2005, 48(3): 397-401.
[85] MEYER P S, du PREEZ J C. Astaxanthin production by a Phaffi a rhodozyma mutant on grape juice[J]. World Journal of Microbiology & Biotechnology, 1994, 10(2): 178-183.
[86] DOMINGUEZ-BOCANEGRA A R, TORRES-MUNOZ J A. Astaxanthin hyperproduction by Phaffia rhodozyma with raw coconut milk as sole source of energy[J]. Applied Microbiology and Biotechnology, 2004, 66(2): 249-252.
[87] HAARD N F. Astaxanthin formation by the yeast Phaffi a rhodozyma on molasses[J]. Biotechnology Letters, 1988, 10(2): 609-614.
[88] RAMIREZ J, OBLEDO N, ARELLANO M, et al. Astaxanthin production by Phaffi a rhodozyma in a fed-batch culture using a low cost medium feeding[J]. e-Gnosis Num, 2006, 4(1): 1-9.
[89] TINOI J, RAKARIVATHAM N, DEMING R L. Utilization of mustard waste isolates for improved production of astaxanthin by Xanthophyllomyces dendrorhous[J]. Journal of Industrial Microbiology & Biotechnology, 2006, 33(2): 309-314.
[90] AN G H, JANG B G, CHO M H. Cultivation of the carotenoidhyperproducing mutant 2A2N of the red yeast Xanthophyllomyces dendrorhous (Phaffia rhodozyma) with molasses[J]. Journal of Bioscience and Bioengineering, 2001, 92: 121-125.
[91] 刘艳, 冯印, 莫言, 等. 响应面法优化产虾青素假单胞菌的发酵培养基[J]. 食品工业科技, 2014, 35(20): 186-190.
[92] WANG Wenjun, YU Longjiang. Effects of oxygen supply on growth and carotenoids accumulationby Xanthophyllomyces dendrorhous[J]. Meitschrift fur Naturforschung Section B: a Journal of Chemical Sciences, 2009, 64(4): 853-858.
[93] KIM J H, KANG S W, KIM S W, et al. High-level production of astaxanthin by Xanthophyllomyces dendrorhous mutant JH1 using statistical experimental designs[J]. Bioscience, Biotechnology, and Biochemistry, 2005, 69(1): 1743-1748.
[94] LIU Yuanshuang, WU Jianyong. Hydrogen peroxide-induced astaxanthin biosynthesis and catalase activity in Xanthophyllomyces dendrorhous[J]. Applied Microbiology an d Biotechnology, 2006,73(3): 663-668.
[95] KIM S K, LEE J H, LEE C H, et al. Increased carotenoid production in Xanthophyllomyces dendrorhous G276 using plant extracts[J]. The Journal of Microbiology, 2007, 45(2): 128-132.
[96] HU Zhongce, ZHENG Yuguo, WANG Zhao, et al. Production of astaxanthin by Xanthophyllomyces dendrorhous ZJUT46 with fedbatch fermentation in 2.0 m 3fermentor[J]. Food Technology and Biotechnology, 2007, 45(2): 209-212.
[97] ZHENG Y G, HU Z C, WANG Z, et al. Large-scale production of astaxanthin by Xanthophyllomyces dendrorhous[J]. Food and Bioproducts Processing, 2006, 84(1): 164-166.
[98] LIU Yuanshuai, WU Jianyong. Perfusion culture process plus H 2O 2stimulation for efficient astaxanthin production by Xanthophyllomyces dendrorhous[J]. Biotechnology and Bioengineering, 2007, 97(2): 568-573.
[99] 武一琛, 杨慧茹, 方园, 等. 天然虾青素提取及分离纯化研究进展[J].食品研究与开发, 2014, 35(12): 117-120.
[100] 宋素梅. 南极磷虾壳中虾青素的提取与分离纯化[D]. 无锡: 江南大学, 2013.
[101] 姜启兴, 宋素梅, 夏文水, 等. 大孔树脂分离纯化南极磷虾壳中的虾青素[J]. 食品科学, 2014, 35(16): 1-5. doi:10.7506/spkx1002-6630-201416001.
Current Status of Fermentative Production of Astaxanthin
CAI Jun, YOU Zhineng
(Key Laboratory of Fermentation Engineering, Ministry of Education, Hubei Collaborative Innovation Center for Industrial Fermentation, Hubei University of Technology, Wuhan 430068, China)
Abstract:Astaxanthin is a carotenoid that has very strong antioxidant activity, anticancer function, significant coloring capacity and immunoenhancing activity. The biological activities of astaxanthin and its applications in food, cosmetics,health products, aquaculture, medicine and other fields are summarized in this review, with focus on the current status of fermentative production of astaxanthin. Moreover, the future directions of astaxanthin research are proposed. It is expe cted that this review can provide a theoretical basis for in-depth exploration and comprehensive utilization of astaxanthin.
Key words:astaxanthin; biological activity; fermentation
中图分类号:TS209
文献标志码:A
文章编号:1002-6630(2015)23-0358-09
doi:10.7506/spkx1002-6630-201523064
收稿日期:2015-01-15
基金项目:湖北省自然科学基金重点项目(2009CDA059)
作者简介:蔡俊(1968—),男,教授,博士,研究方向为发酵工程。E-mail:caijun@mail.hbut.edu.cn