1(集美大学 食品与生物工程学院,福建 厦门,361021)2(福建省食品微生物与酶工程重点实验室,福建 厦门,361021)
3(福建省海洋功能食品工程技术研究中心,福建 厦门,361021)4(厦门市海洋功能食品重点实验室,福建 厦门,361021)
摘 要 利用摇瓶培养法夫酵母JMU-MVP14菌株,通过乙醇传感器检测乙醇含量,研究乙醇对法夫酵母细胞生长及虾青素合成的影响。结果表明,在10 g/L和20 g/L葡萄糖初始培养基中分别添加1~2 g/L乙醇时,均可提高虾青素的产量;而添加高浓度乙醇,则会抑制细胞生长和虾青素的合成。以10 g/L葡萄糖为初始培养基,控制发酵中恒定乙醇浓度为2 g/L,虾青素质量浓度可达到50.1 mg/L,比只添加2 g/L乙醇提高了20.3%,且虾青素细胞产率达到13.1 mg/g,葡萄糖的利用率能达到77.2%以上,说明恒定乙醇控制策略更有利于法夫酵母虾青素的合成。在10 g/L初始葡萄糖浓度,恒定乙醇浓度2 g/L,并每24 h补加5 g/L葡萄糖的优化条件下,虾青素产量最大值达到55.3 mg/L,虾青素细胞产率为19.7 mg/g,比对照组(14.1 mg/g)提高了39.7%。
关键词 法夫酵母;虾青素;乙醇;摇瓶培养
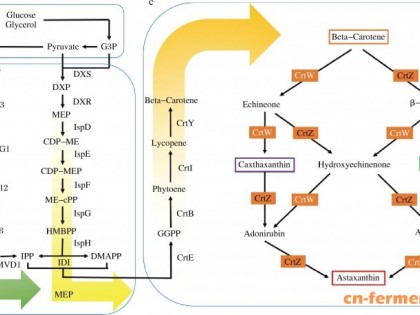
法夫酵母(Phaffiarhodozyma)中主要的类胡萝卜素是胞内虾青素,含量可达到40%~95%,且法夫酵母具有生长周期短,培养条件简单,能代谢多种碳源等优势,成为了天然虾青素生产的主要研究对象[14,16]。法夫酵母可以利用乙醇作为碳源进行生长。YAMANE等[17]在细胞生长的稳定期添加0.3%的乙醇。GU等[18]在延迟期后期或对数生长期添加0.2%的乙醇,均使色素产量提高了近1倍左右。汪洪涛等[19]针对不同的法夫酵母菌株,在培养基中添加乙醇,均能提高法夫酵母中虾青素的含量。
在摇瓶条件下,易于考察各种营养因子对发酵过程的影响,从而筛选出适宜虾青素生产的发酵条件。本试验对法夫酵母JMU-MVP14进行了摇瓶培养,对比研究不同初始糖浓度与乙醇添加浓度对法夫酵母细胞生长及虾青素合成的影响,筛选出最利于虾青素合成的乙醇浓度;然后,利用乙醇传感器控制整个发酵过程维持在不同恒定乙醇浓度下,考察乙醇浓度对虾青素合成的影响;并在此基础上同时补加乙醇与葡萄糖,以虾青素产量为指标,得到最佳的乙醇补料方式。
1 材料与方法 1. 1材料与试剂
1.1.1 菌种
法夫酵母PhaffiarhodozymaJMU-MVP14 菌株:用甲基磺酸乙酯对法夫酵母JMU-VDL668 菌株诱变,经0.5%的双氧水和紫外照射来淘汰低产的菌株选育得到[20]。
1.1.2 培养基
种子培养基:4°Bx 麦汁,pH 6.0。
无碳源培养基(g/L):取KH2PO42 g,(NH4)2SO45 g,CaCl20.2 g,MgSO40.5 g,酵母膏3 g,溶于1 L蒸馏水中,调pH为6.0。
法夫酵母摇瓶发酵培养基中葡萄糖及乙醇的添加量如表1所示,其他成分组成和无碳源培养基相同。
表1培养基中葡萄糖及乙醇的添加量
Table1Glucoseconcentrationandethanoladdition
withinmedium

1.1.3 主要试剂
虾青素(色谱纯),Sigma公司;无水乙醇(分析纯),广东化学试剂;3,5-二硝基水盐酸,国药集团;酵母膏(优级纯),广东环凯;其他试剂均为分析纯,购于西陇化工。
1. 2实验仪器和设备
ZHWY-2102双层全温培养摇床,上海智诚分析仪器制造有限公司;1260高效液相色谱仪,安捷伦(中国)科技有限公司;SW-CJ-ZFD单面净化工作台,苏州净化设备有限公司;S20K pH酸度计,梅特勒-托利多仪器有限公司;BS223S电子天平,赛多利斯科学仪器(北京)有限公司;101-3B电热鼓风干热箱,上海市实验仪器总厂;TD5M-WS台式离心机,湖南湘仪实验室仪器开发有限公司;LDZX-40KAS立式高压蒸汽灭菌锅,上海申安医疗器械厂;2600A紫外可见分光光度计,尤尼柯(上海)仪器有限公司;乙醇感受器,参考相关专利[21],在某些结构上进行改良,自制了乙醇传感器。
1. 3实验方法
1.3.1 培养方法
将PDA斜面活化的菌种接入种子培养基中,22 ℃培养2~3 d得1代种子,转接1代种子到新配制的种子培养基为2代种子,转接2代种子到摇瓶中,于22 ℃连续培养120 h,每24 h取样检测生物量、虾青素产量及残糖含量,用乙醇传感器检测乙醇质量浓度。
1.3.2 生物量的测定
干重法[22]:将于105 ℃干燥箱烘至恒重的空离心管,称重记为m1;取发酵液(体积V)于恒重后的空离心管中,离心2次后去上清液得到菌体,于105 ℃干燥箱中烘干至恒重,称重记为m2;得到菌体干重,计算为
![]()
1.3.3 虾青素含量的测定
二甲基亚砜(DMSO)法破壁[23-24]:取5 mL发酵液离心2次后去上清液得到菌体。将菌体于55 ℃下预热5 min后,加入2 mL已预热至75 ℃的二甲基亚砜,充分振荡后加入5 mL乙醇提取色素,离心得到色素提取液,乙醇定容至10 mL。
紫外分光光度计法检测[25]:配制不同浓度梯度的虾青素标准品,在紫外光波长为474 nm下检测,绘制出虾青素标准曲线。相同条件下,测定发酵样品吸光度,根据标准曲线求样品中的虾青素含量。
1.3.4 发酵液中残糖的测定
3,5-二硝基水杨酸法(DNS)[26]:1 mL的发酵上清液稀释至适宜浓度,加入0.6 mL的DNS,沸水浴10 min后立即冷却,用蒸馏水定容至5 mL,使用紫外分光光度计在波长为520 nm下测定。
1.3.5 发酵液中乙醇质量浓度的测定
将配制好的2 g/L的乙醇标准溶液,稀释后分装于相同规格的50 mL离心管中,每管5 mL,用于测定乙醇标准曲线。于室温22 ℃下,乙醇传感器1提前预热30 min,待读数为0,将传感器感应端置于离心管样品液面上0.5 cm处,秒表计时50 s后读数。取出传感器感应端置于空气中,待读数为0后测定下一个样品。
1.3.6 二次参数的计算
虾青素细胞产率
![]()
葡萄糖利用率
![]()
乙醇利用率
![]()
2 结果与讨论 2. 1不同初始糖浓度时添加乙醇对发酵的影响
分别在10 g/L和20 g/L两种葡萄糖浓度发酵培养基中添加不同浓度乙醇,考察乙醇对摇瓶培养法夫酵母JMU-MVP14的细胞生长和虾青素合成的影响。乙醇会对法夫酵母和虾青素合成产生影响。
2.1.1 初始葡萄糖质量浓度为10 g/L时添加乙醇对发酵的影响
以无碳源培养基为基础,添加10 g/L的葡萄糖,乙醇的添加浓度如表1所示。考察在较低糖浓度下,不同乙醇浓度对法夫酵母整个发酵过程中葡萄糖的消耗、细胞生长、虾青素的积累及乙醇浓度的变化情况如图1所示。

图1 初始葡萄糖质量浓度为10 g/L时添加乙醇对法夫酵母JMU-MVP14发酵的影响
Fig. 1 The effect of ethanol addtion on astaxanthin production by P. rhodozyma JMU-MVP14 at the initial concentration of
10 g/L glucose
由图1-a可知,添加0~5 g/L的乙醇培养条件下,生物量曲线变化趋势基本一致,发酵至48 h达到稳定期,48 h以后基本不变,且与对照组(不添加乙醇)相比,添加0~5 g/L的乙醇对法夫酵母JMU-MVP14生物量影响差别不显著。从图1-b可看出,对照组虾青素产量在72 h达到最大,72 h后虾青素产量保持稳定,但添加乙醇后,法夫酵母在72 h后虾青素产量进一步提高。当添加乙醇的质量浓度为2 g/L和5 g/L时,虾青素质量浓度均达到最高水平40.0 mg/L,比对照组显著提高了70%,且此时虾青素细胞产率分别达到了10.0 mg/g和11.3 mg/g,与陈锋等[27]的研究结果一致。
结合图1-c和图1-d,与对照组相比,添加1~2 g/L的乙醇时,酵母消耗葡萄糖的速度加快,且发酵至24 h,酵母不再消耗葡萄糖,开始使用乙醇,葡萄糖最终利用率均能达到78.0%,乙醇最终利用率达到80.0%;而添加5 g/L的乙醇,酵母发酵48 h后,才开始利用乙醇,乙醇最终利用率为93.4%,葡萄糖最终利用率只有68.2%。由此推测,在葡萄糖和乙醇共同存在的情况下,法夫酵母优先利用葡萄糖生长,再利用乙醇,且乙醇能替代葡萄糖作为碳源使酵母产虾青素,与HU等[28]的文献报道一致。而当培养基中乙醇的质量浓度增至20 g/L时,法夫酵母生长至24 h就停止生长,对葡萄糖的利用率降低,发酵结束后,生物量质量浓度和虾青素质量浓度同对照组相比差异显著,分别降低至对照组的27%和14%。说明添加低浓度的乙醇可以促进法夫酵母产虾青素,而添加较高浓度乙醇抑制酵母细胞的生长和虾青素的积累。
2.1.2 初始葡萄糖质量浓度为20 g/L时添加乙醇对发酵的影响
在较低糖浓度时,当添加2 g/L和5 g/L乙醇时,虾青素产量均达到最高,且与对照组相比,添加1~2 g/L质量浓度的乙醇,酵母消耗葡萄糖量的速度加快,因此将培养基中初始葡萄糖质量浓度提高为20 g/L,其他培养条件不变时,进一步考察在较高糖浓度下添加乙醇对法夫酵母JUM-MVP14发酵过程中细胞生长、虾青素合成、乙醇利用等方面的影响。结果如图2所示。
如图2-a所示,添加1~2 g/L的乙醇促进了细胞生长和虾青素的积累。且添加1 g/L的乙醇使得生物量较对照组提高了18%。从虾青素质量浓度曲线图2-b可看出,添加1 g/L的乙醇,发酵至120 h,虾青素质量浓度为42.0 mg/L,比对照组显著提高了26.9%,此时乙醇的最终利用率为84.0%,虾青素细胞产率为10.5 mg/g,比对照组提高了7.1%。本试验结果与肖安风等[29]的研究发现一致,乙醇作为糖代谢途径中的相关产物,可为虾青素合成提供更多的乙酰辅酶A,从而提高了虾青素的产量。

图2 初始葡萄糖质量浓度为20 g/L时添加乙醇对法夫酵母JMU-MVP14发酵的影响
Fig. 2 The effect of ethanol addtion on astaxanthin production by P. rhodozyma JMU-MVP14 at the initial concentration of
20 g/L glucose
从残糖含量的变化情况发现,在发酵进入对数生长期后,细胞代谢旺盛,对碳源的需求增大,从而残糖含量迅速下降;72 h之后,菌体生长趋于稳定,糖含量下降速度明显减缓。其中,添加1 g/L乙醇显著提高了法夫酵母JUM-MVP14对葡萄糖的利用率,可达75.0%(比对照组显著提高了36.4%),加快了其对葡萄糖的代谢,产生更多的乙酰辅酶A[29],为虾青素的合成提供原料,从而进一步阐明低浓度乙醇能促进法夫酵母虾青素合成。但和初始葡萄糖浓度为10 g/L时相比,酵母对葡萄糖的利用率明显降低,且虾青素的产量却无显著提高。
2. 2控制恒定乙醇的浓度及补加葡萄糖对发酵的影响
由2.1的试验结果可知,乙醇能显著促进法夫酵母JMU-MVP14菌株细胞生长及虾青素的合成,为进一步研究乙醇在整个法夫酵母发酵周期中对虾青素合成的影响,采用乙醇传感器实时在线检测乙醇浓度,发酵过程补加乙醇,使整个发酵周期中乙醇能维持在一个恒定的浓度。
2.2.1 控制恒定乙醇的浓度对发酵的影响
在较高葡萄糖浓度环境中,法夫酵母对糖的利用率降低,且虾青素的产量没有明显提高。因此用初始葡萄糖质量浓度为10 g/L的培养基,空白组设为只添加2 g/L的乙醇,实验组用乙醇传感器检测乙醇浓度在整个发酵过程中维持2 g/L。考察恒定乙醇补料策略对法夫酵母整个发酵过程中生物量、残糖、虾青素产量等发酵参数的变化情况。实验结果如图3所示。
由图3-a可知,乙醇持续补加,JMU-MVP14菌株的细胞生长至后期,其生物量提高了,说明此菌株可利用乙醇来合成自身的物质,即达到稳定期后仍可利用乙醇继续生长,与HU等[28]文献报道一致。在酵母培养过程中控制恒定乙醇浓度,从24 h开始虾青素合成量呈对数增长趋势,发酵至120 h虾青素质量浓度为50.1 mg/L,比对照组提高了20.3%。从图3-c可知,实验组和对照组葡萄糖的利用率均能达到77.2%以上。结合图3-d可以看出,乙醇提高了单位细胞内虾青素的产量(13.1 mg/g),比对照组(12.2 mg/g)提高了7.4%,进而从总体上提高了JMU-MVP14菌株的虾青素合成能力。说明恒定乙醇控制策略更有利于法夫酵母虾青素的合成。
2.2.2 控制恒定乙醇浓度并补加葡萄糖对JMU-MVP14发酵的影响
前期的研究结果表明,在较低糖质量浓度(10 g/L)培养基中,添加乙醇,虾青素质量浓度达到最高水平40.0 mg/L,在高糖质量浓度(20 g/L)培养基中,添加乙醇,虾青素质量浓度为42.0 mg/L,后者比前者多了5%,说明乙醇对法夫酵母产虾青素的作用与葡萄糖浓度密切相关。故以无碳源培养基为基础,添加10 g/L的葡萄糖,设置3个实验组,即只补加葡萄糖、只补加乙醇、同时补加葡萄糖和乙醇,空白对照只添加2 g/L的乙醇,同时不补加乙醇也不补加葡萄糖,考察乙醇及葡萄糖的摇瓶补料策略对法夫酵母整个发酵过程中生物量、残糖、虾青素产量等发酵参数的变化情况。试验结果如图4所示。

□-对照组;■-添加乙醇的实验组
图3 控制恒定乙醇浓度对法夫酵母JMU-MVP14发酵的影响
Fig. 3 Fermentation curves of P. rhodozyma JMU-MVP14 at the constant concentration of 2 g/L ethanol

□-对照组;■-只补加乙醇的实验组;△-只补加葡萄糖的实验组;▲-补加乙醇和葡萄糖的实验组
图4 乙醇补料策略对法夫酵母JMU-MVP14发酵的影响
Fig.4 The effect of fermentation parameters in fed-batch process with ethanol by P. rhodozyma JMU-MVP14 in
shaking flask fermentation
在摇瓶发酵的3种补料方式中,将乙醇质量浓度控制在2 g/L左右,对法夫酵母JMU-MVP14细胞生长最有利,生物量质量浓度最大为3.2 g/L。而在只补加葡萄糖的情况下对法夫酵母细胞生长有抑制作用。结合发酵液残糖的变化曲线可知,每24 h补加5 g/L葡萄糖并未被法夫酵母JMU-MVP14菌株所利用,而是在发酵液中累积,从而造成发酵液中葡萄糖的浓度升高。且每24 h补加葡萄糖,较对照组并未使菌体的生物量增加,但促进了虾青素的合成,这与相关文献报道相一致,高C/N导致细胞生长减慢,但有利于虾青素的积累[30]。法夫酵母JMU-MVP14菌株的3种补料方式中,从虾青素质量浓度变化曲线可知,乙醇和葡萄糖的补加能都促进虾青素的合成,以控制恒定2 g/L乙醇质量浓度并每24 h补加5 g/L葡萄糖的培养条件下,虾青素产量达到最大值55.3 mg/L,与对照组比显著提高44.4%,比只补加乙醇显著提高了17.4%。图4-d表明:同时补加乙醇和葡萄糖,法夫酵母在发酵120 h其虾青素细胞产率为19.7 mg/g,比对照组(14.1 mg/g)显著提高,达到39.7%,比只补加葡萄糖(17.7 mg/g)提高了11.3%,比只补加乙醇16.3 mg/g提高了20.9%。由此可知,同时补加葡萄糖和乙醇有利于法夫酵母JMU-MVP14菌株细胞内虾青素的合成。
3 结论
考察乙醇对高产虾青素的法夫酵母菌株JMU-MVP14合成虾青素的影响,在10 g/L和20 g/L两种葡萄糖质量浓度下,向培养基中添加1 g/L和2 g/L的乙醇时,均可提高虾青素的产量;而添加20 g/L的乙醇时,则会抑制法夫酵母的细胞生长和虾青素的产生。在法夫酵母培养基中初始葡萄糖质量浓度10 g/L的条件下,通过补加乙醇控制发酵液中乙醇的质量浓度恒定为2 g/L,虾青素质量浓度为50.1 mg/L,比只在发酵初始阶段添加2 g/L的乙醇,虾青素质量浓度提高了20.3%,虾青素细胞产率提高了7.4%,说明恒定乙醇控制策略更有利于法夫酵母虾青素的合成。在较低糖质量浓度(10 g/L)培养基中,添加乙醇,虾青素质量浓度最高水平达到40.0 mg/L,在高糖质量浓度(20 g/L)培养基中,添加乙醇,虾青素质量浓度达到42.0 mg/L,后者比前者多了5%,说明乙醇对法夫酵母产虾青素的作用与葡萄糖质量浓度密切相关。以10 g/L的葡萄糖质量浓度为初始培养基,补料控制整个发酵过程中乙醇质量浓度为2 g/L,并每24 h补加5 g/L葡萄糖,虾青素产量显著提高,最大值为55.3 mg/L,比对照组提高了44.4%,比只补加乙醇提高了17.4%;并且法夫酵母在发酵120 h其虾青素细胞产率为19.7 mg/g,比对照组(14.1 mg/g)提高了39.7%,比只补加葡萄糖(17.7 mg/g)提高了11.3%,比只补加乙醇16.3 mg/g提高了20.9%。由此可知,同时补加葡萄糖和乙醇有利于法夫酵母JMU-MVP14菌株细胞内虾青素的合成。但是每24 h补加5 g/L葡萄糖并未被法夫酵母JMU-MVP14菌株所利用,而是在发酵液中累积,从而造成葡萄糖最终利用率降低,因此后续试验,继续对法夫酵母产虾青素发酵过程中葡萄糖补加的量和时间进行条件优化。
Effect of ethanol on synthesis of astaxanthin by Phaffiarhodozyma
LIU Chun-li1, SHEN Ning-yan1, NI Hui1,2,3,4, LI Li-jun1,2,3,4,
CHEN Yan-hong1,2,3,4, XIAO An-feng1,2,3,4*
1(College of Food and Biological Engineering, Jimei University, Xiamen 361021, China)
2(Key Laboratory of Food Microbiology and Enzyme Engineering of Fujian Province, Xiamen 361021, China)
3(Fujian Provincial Engineering Technology Research Center of Marine Functional Food, Xiamen 361021, China)
4(Xiamen Key Laboratory of Marine Functional Food, Xiamen 361021, China)
ABSTRACT With the detection of ethanol by ethanol sensor, the effects of ethanol on cell growth and astaxanthin production byPhaffiarhodozymaJMU-MVP14 were investigated in shake flask. The results indicated that 1~2 g/L ethanol was conducive to astaxanthin accumulation in initial medium with 10 g/L or 20 g/L glucose, while high concentration of alcohol inhibited the cell growth and astaxanthin production ofP.rhodozyma. When ethanol concentration was maintained at 2 g/L in initial medium with 10 g/L glucose, astaxanthin production was 50.1 mg/L, which increased by 20.3% compared with the control group. The yield of astaxanthin in a cell was 13.1 mg/g and the utilization rate of glucose was over 77.2%. The results demonstrated that the constant ethanol control strategy was conductive to astaxanthin accumulation in yeast cells. The maximum yield of astaxanthin was 55.3 mg/L under the optimized condition of 10 g/L initial glucose concentration, 2 g/L constant ethanol concentration and 5 g/L glucose supplemented per 24 h during the fermentation. And the yield of astaxanthin in a cell was 19.7 mg/g, which increased by 39.7% compared with the control group (14.1 mg/g).
Key words Phaffiarhodozyma; astaxanthin; ethanol; shake flash culture
DOI:10.13995/j.cnki.11-1802/ts.015189
第一作者:硕士研究生(肖安风教授为通讯作者,E-mail:xxaaffeng@jmu.edu.cn)。
基金项目:国家自然科学基金项目(31501448);福建省科技重点项目(2014Y0081);福建省教育厅项目(JA15266)资助
收稿日期:2017-07-13,改回日期:2017-09-28
虾青素(Astaxanthin,又名3, 3’-二羟基-β, β’-胡萝卜素-4, 4’-二酮),分子式为C40H52O4,分子量为596.85,属于叶黄素族。它是目前已发现的600多种类胡萝卜素中抗氧化性最强的[1, 3],被称为“能吃的钻石”。此外,虾青素还具有抑制肿瘤发生[2, 5]、预防心脑血管疾病[6]、增强机体免疫功能[7]等作用。因此,天然虾青素广泛应用于食品、饲料、保健品、医药等行业[8,13],市场上对虾青素的需求与日俱增。