近二十多年来,多种因素导致临床上侵袭性真菌感染的发病率不断上升,在各种疾病治疗过程中过多使用化学治疗或放射治疗,使机体免疫功能受到损伤或出现缺陷,增加了真菌感染的发病率。侵袭性真菌感染主要是真菌侵入患者的机体,侵袭各个组织、器官和血液系统,导致患者出现严重的炎症反应和组织损伤。而抗侵袭性真菌感染的新药研发远不能满足临床治疗的需要。二十多年来临床上使用的安全有效品种主要是三唑类、多烯类及棘白菌素等3类药物,并且受到耐药性和不良反应等因素的制约,研发新型抗真菌药已迫在眉睫。2002年6月,美国Scynexis制药公司研制的Ibrexafungerp(艾瑞芬净)是具有全新作用机制的新一代三萜类抗真菌新药,靶向β-1,3-葡聚糖合酶,破坏其完整的细胞壁,直接杀灭真菌细胞。该公司最初与美国默克公司签订许可协议,授予默克公司在全球独家开发权;在2013年5月,Scynexis制药公司要求修改合作协议,收回对该产品的开发和商业化权,答应支付默克公司阶段性补偿款和专利权使用费。2013年9月,Scynexis制药公司与俄罗斯制药商R-Pharm公司签订在俄罗斯和土耳其开发艾瑞芬净及其商业化的协议。2021年2月,中国江苏豪森药业公司与Scynexis制药公司签订在大中华区合作开发艾瑞芬净及其商业化的协议。2020年10月14日Scynexis制药公司向美国食品药品管理局(FDA)提出枸橼酸艾瑞芬净片剂上市申请,该品曾获得罕用药、快速通道、合格感染疾病产品(QIDP)和优先审评等资质。2021年6月1日获FDA批准上市,用于成人和月经初潮后女性外阴阴道念珠菌病(VVC)的治疗,商品名为Brexafemme®。这是美国FDA 近二十多年来批准的首款新型抗真菌类药物,也是唯一可口服或注射治疗的非唑类阴道酵母菌感染的首创新药。该文对治疗深部真菌感染新药——艾瑞芬净的非临床和临床药理毒理学、临床研究、不良反应、适应证、剂量与用法、用药注意事项及知识产权状态和国内外研究进展等进行介绍。
作者简介 陈本川( 1936-),男,福建厦门人,研究员,从事药物化学、药物信息调研工作。电话:027-88871838-1101,E-mail:
致病性真菌感染分为4大类:其一,为浅表真菌病感染,仅局限于皮肤角质层最外层;其二,为皮肤真菌病,累及皮肤角质层和皮肤附属器官;其三,为皮下真菌病,感染皮肤、皮下组织,包括肌肉和结缔组织;其四,为侵袭性真菌病,除侵犯皮肤和皮下组织外,还累及全身组织和器官,甚至引起侵袭性真菌感染。前2类属浅层真菌感染,后2类为深部真菌感染。深部真菌感染可深入人体内部,感染肠道、肺部、肾脏等器官,人体会罹患肠炎、肺炎、内脏感染,还引发败血症,摧毁人体免疫系统,夺走生命。近二十多年来,随着高效广谱抗菌药、糖皮质激素、免疫抑制药、抗恶性肿瘤药的广泛应用,器官移植、导管技术以及外科其他介入性治疗的深入开展,特别是艾滋病(AIDS)和多种呼吸道冠状病毒传染病在全球肆虐,条件性致病性真菌感染引起侵袭性真菌病日益增多,新的致病菌也不断出现,病情日趋严重。主要深部真菌有念珠菌(candidiasis)、隐球菌(cryptococcus)、曲霉菌(aspergillus)、毛霉菌(mucor)及其他结合菌,组织胞浆菌(histoplasma)、粗球孢子菌(coccidioides gracilis)、副球孢子菌(paracoccidia)、申克孢子菌(schenckii)、马尔尼菲青霉菌(penicillium marneffei),以及其他各种机会致病的暗色真菌(dark fungus)、卡氏肺孢子虫(pneumocystis carinii)等。侵袭性真菌感染的发病率不断上升。其中,念珠菌的真菌深度感染主要由白念珠菌引发,引起侵袭染性真菌感染,是人体最难治疗的真菌感染性疾病,能够在肾脏中持续存活和富集。感染发病率最高,全球70%~75%育龄女性一生中至少经历一次阴道念珠菌感染,引起外阴阴道念珠菌病(vulvovaginal candidiasis,VVC),典型特征是外阴和阴道出现白色块状分泌物、灼痛、发红和瘙痒及性生活困难等。二十多年来临床上使用的安全有效品种主要是三唑类、多烯类及棘白菌素(echinocandin)等3类药物,受到耐药性和不良反应等因素的制约,研发新型抗真菌药已迫在眉睫。2002年6月,美国Scynexis制药公司研制的Ibrexafungerp是具有全新作用机制的新一代三萜类抗真菌新药,可直接杀灭真菌细胞。Ibrexafungerp暂译名为艾瑞芬净,亦译为伊布昔芬。英文化学名为(1
艾瑞芬净为期2年的致癌性研究尚未开展。艾瑞芬净无基因毒性,体外细菌反向突变实验未检测到诱变或致碎屑效应,体外染色体畸变实验和大鼠体内骨髓微核实验均为阴性[1,2]。
雄大鼠在交配前28 d及整个交配过程,雌大鼠在交配前15 d及交配过程和妊娠第6天,不同剂量组分别喂饲艾瑞芬净10,20,40和80 mg·kg-1·d-1,任何剂量组均不损害雄、雌大鼠的交配和生育能力。最大剂量组80 mg·kg-1·d-1,按血浆药物浓度-时间曲线下面积(AUC)估算,约为推荐人用剂量(recommended human dose,RHD)的10倍。一项大鼠胚胎-胎仔的研究,从妊娠第6~第17天,分别喂饲艾瑞芬净10,20,35和50 mg·kg-1·d-1。大剂量组50 mg·kg-1·d-1,按AUC估算,约为RHD 的5倍,未出现胎仔畸形或胎仔存活率及胎仔体质量变化。对孕兔胚胎-胎仔的研究,从妊娠第7~第19天,分别喂饲艾瑞芬净10,25和50 mg·kg-1·d-1。中剂量组25 mg·kg-1·d-1,约为RHD的5倍,出现胎仔畸形,包括耳廓缺失、颅轴裂、胸腹裂,单个胎仔出现躯干后凸、前肢缺失、前爪缺失和后肢缺失。在大剂量组50 mg·kg-1·d-1,约为RHD的13倍,出现后肢缺失和无脑畸形发生率增加,其他畸形,包括耳廓缺失、胸腹裂、前肢缺失,甲状腺缺失。喂饲艾瑞芬净任何剂量,均未观察到胎仔存活率或体质量变化,10 mg·kg-1·d-1剂量组约为RHD的2倍,未观察到胎仔畸形[1,2]。
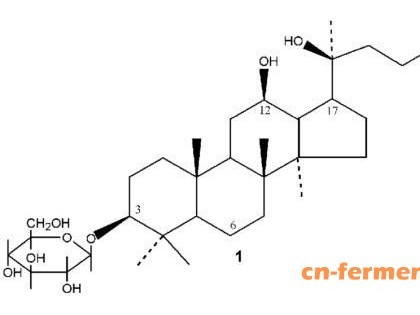
艾瑞芬净是一种三萜类抗真菌药,可抑制β-1,3-葡聚糖合酶,破坏其完整的细胞壁,而葡聚糖合酶由催化亚基FKS1或FKS2和GTP结合调节亚基Rho1组成,是真菌细胞壁的重要成分,与β-1,3-d -葡聚糖形成有关,艾瑞芬净对念珠菌的杀菌活性与浓度呈正相关[1,2,3]。
艾瑞芬净对真菌细胞是接触与灭菌应答关系和药效应答的时间过程尚不清楚。动物研究表明,艾瑞芬净能均匀地分布在阴道组织中,有利于对VVC的治疗。艾瑞芬净对β-1,3-d葡聚糖合成酶的特异性结合位点尚未确定,而棘白菌素类的抗真菌药也是以β-1,3-d葡聚糖合成酶为靶点结合,与艾瑞芬净有交叉耐药性,表明两者之间的结合位点有部分重叠[1,2,3]。
2.2.1 体外抗真菌活性 ①阴道正常pH值为4.5,艾瑞芬净保持抗真菌活性。艾瑞芬净对野生型β-1,3-d葡聚糖合成酶半数抑制浓度(IC50)为13.97~38.44 ng·mL-1,但对FKS1或FKS2双突变合成酶的IC50为13.76~10 000 ng·mL-1或>10 000 ng·mL-1。艾瑞芬净对念珠菌90%最小抑制浓度(MIC90)为0.062~4.000 μg·mL-1,分离株(
2.2.2 动物模型体内抗真菌活性 在小鼠侵袭性念珠菌病模型中证实艾瑞芬净对念珠菌的疗效。一项小鼠实验,喂饲艾瑞芬净5 mg·kg-1,每天1次,用基质辅助激光解吸电离质谱成像技术(matrix-assisted laser desorption ionization-mass spectrometry imaging)及免疫组化法观察肝脏感染性病变的分布,8只小鼠中3只真菌载荷和真菌的清除率均下降。另一项小鼠侵袭性念珠菌感染的实验中,喂饲艾瑞芬净30或40 mg·kg-1,每天2次,但不包括≤20 mg·kg-1,每天2次,小鼠肾脏真菌的载荷显著降低,也包括感染棘白菌素耐药分离株的小鼠。此外,经喂饲艾瑞芬净30 mg·kg-1,每天2次,持续21 d,能显著改善小鼠的存活率。在兔侵袭性肺曲霉菌病模型实验中,喂饲艾瑞芬净2.5或7.5 mg·kg-1·d-1,联用艾沙康唑(isavuconazole)40 mg·kg-1·d-1,存活率和肺部真菌载荷显著降低,与未经治疗的对照组相比,治疗效果更佳。在小鼠肺孢子虫肺炎模型中,喂饲艾瑞芬净30 mg·kg-1,每天2次,对预防性治疗鼠肺孢子虫感染有效。在豚鼠皮肤感染耳念珠菌模型中,艾瑞芬净可降低耳廓真菌的载荷,但疗效与剂量的应答关系尚不明确,可能与真菌感染皮肤的异质性有关[1,2,3]。
2.2.3 心脏电生理学 口服≥5倍艾瑞芬净300 mg,每天2次,所达到的血药浓度,对QTc间期延长,无任何临床相关意义[1,2,3]。
健康受试者单次口服艾瑞芬净10~1600 mg,为批准推荐日剂量的0.02~2.67倍和多次服艾瑞芬净300~800 mg,为批准推荐日剂量的0.50~1.33倍,AUC和最大血浆药物浓度(
2.3.1 吸收 健康志愿者口服枸橼酸艾瑞芬净片后,通常在单次和多次服药后4~6 h达到
2.3.2 分布 艾瑞芬净稳态分布容积(
2.3.3 消除 艾瑞芬净主要通过代谢和胆汁排泄消除,消除半衰期(t1/2)约为20 h。
2.3.4 代谢 体外研究表明,艾瑞芬净通过CYP3A4酶进行羟基化,其后,羟基化非活性代谢物发生葡萄糖醛酸化和硫酸化。
2.3.5 排泄 健康志愿者口服带放射性标记的枸橼酸艾瑞芬净片后,放射性剂量均值的90%从粪便回收,其中51%为原形药,1%放射性剂量从尿液回收。
2.3.6 特殊人群的药动学 老年患者,健康男、女性老年患者,年龄范围为65~76岁,与较年轻健康男性患者,年龄范围为20~45岁比较,AUC0 inf几何均值比(geometric mean ratio,GMR)差为1.39,90%
研发公司计划开展艾瑞芬净治疗真菌感染 16批次临床试验研究,纳入受试者2254例,其中,Ⅰ期临床4批86例;Ⅰ/Ⅱ期临床试验2批352例;Ⅱ期临床试验6批844例;Ⅲ期临床试验4批972例。在美国FDA批准上市之际,所有临床试验已基本完成,少数临床试验正在临床数据处理过程中。研发公司仅公开发表一份Ⅱ期临床试验较详细的数据。2021年7月9日美国Scynexis制药公司在奥地利维也纳召开的2021年第31届欧洲临床微生物学和感染病大会上展示艾瑞芬净对念珠菌属物种的临床和体外活动,包括艾瑞芬净2批关键性的Trial 1 VANISH-303,NCT03734991)和Trial 2(VANISH-306,NCT03987620的Ⅲ期临床试验结果简要临床试验数据,此外,也在公司网站的新闻简讯和向美国FDA提交新药上市的文件提供主要临床试验结果的关键数据。详细的临床试验结果尚未公开在刊物上发表[1-2,4-5]。
3.1.1 临床试验入选标准 ①受试者为≥12岁月经初潮后的女性患者。②受试者在基线时被诊断为有症状的急性外阴阴道念珠菌病(acute vulvovaginal candidiasis,AVVC),包括在阴道样本中用10%氢氧化钾溶液进行阳性显微镜检查,显示出酵母形式为菌丝/假菌丝或芽殖酵母,以及阴道的pH值≤4.5[1,2,3]。
3.1.2 临床试验排除标准 ①受试者患有除AVVC以外的任何阴道疾病,可能会干扰对治疗应答的诊断或评估,例如疑似或确诊的外阴阴道炎和(或)宫颈炎混合感染的并发病因。②需要全身和(或)局部(阴道)抗真菌治疗,包括研究期间的处方药或非处方药以及随机分组前 28 d的VVC的治疗。③受试者在基线访问时正处于月经期。④受试者有不受控制的糖尿病。⑤受试者的阴道样本pH值 >4.5。⑥受试者有宫颈癌/阴道癌病史或活动性宫颈癌/阴道癌[1,2,3]。
3.1.3 临床疗效主要观察指标 临床治愈:体征和症状完全缓解,时限为第8~14天,通过在治愈测试(test of cure,TOC) 就诊时临床治愈,体征和症状完全缓解的受试者百分比[1,2,3]。
3.1.4 临床疗效次要观察指标 ①真菌学根除(酵母生长培养为阴性),时限为第8~14天,TOC访视时真菌学根除,念珠菌属生长为阴性的受试者百分比。②临床治愈和真菌学根除的应答结果,时限为第8~14天。③TOC,就诊时临床治愈和真菌学根除的应答结果,受试者的百分比。④随访时体征和症状完全缓解,时限为第25 天。⑤在随访时,访问的症状完全缓解受试者的百分比。⑥发生治疗相关不良事件的受试者数量,时限为最多29 d[1,2,3]。
代号MSG-10,临床试验编号NCT02244606是一项对非中性粒细胞减少症的侵袭性念珠菌病患者进行多国、开放标签Ⅱ期临床试验研究,招募27例侵袭性念珠菌病受试者,经筛查,22例随机分到3个治疗组:A组(
3.2.1 临床疗效评价主要观察指标 治疗结束各组的疗效,可评价的病例数:A组(
3.2.2 临床疗效评价 次要与其他观察指标治疗结束后第2~6周,各组的疗效,依次顺序如下: ①第2周可评价的病例数:A组(
包括试验1(VANISH-303,NCT03734991)和试验 2(VANISH-306,NCT03987620的两项随机、安慰药对照的Ⅲ期临床试验,两项试验设计类似,仅试验病例和地点不同;试验1的病例全部来自美国,试验2的病例来自欧洲和美国。评估每天口服枸橼酸艾瑞芬净片300 mg(每次两片150 mg),一天2次(间隔12 h),评价治疗VVC的安全性和有效性。诊断符合临床试验入选条件的VVC受试者为未怀孕月经初潮后的女性。VVC的诊断定义:①外阴阴道体征和症状(vulvovaginal signs and symptoms,VSS)最小综合评分≥4,至少有两种症状或体征,得分为2分(中等)或更高;②阴道样本经10%氢氧化钾处理后,显微镜检查显示酵母形态(菌丝/假菌丝)或芽胞酵母为阳性,③正常阴道pH值≤4.5。 根据外阴阴道体征为红斑、水肿、脱屑和外阴阴道症状有瘙痒、灼热或刺激,其中,每种症状的得分分别为0=无症状、1=轻度、2=中度或3=重度。综合计算VSS总分。研究访视于治愈试验的第8~14天和第21~29天的随访。修正意向治疗人群(modify the intention to treat the population,MITT)包括基线念珠菌培养阳性的随机受试者,至少服用1剂研究药物[1-2,5]。
3.3.1 试验1 代号VANISH-303,临床试验编号NCT03734991,纳入MITT人群290例,A组(
3.3.2 试验2 代号VANISH-306,NCT03987620,纳入MITT 278例,A组(
研发单位只发表一份Ⅱ期临床研究较详细数据,而2批Ⅲ期临床研究只有会议及网站简讯的简略数据,临床试验所出现的不良事件分述如下[1-2,4-5]。
代号MSG-10,临床试验编号NCT02244606,是一项对侵袭性念珠菌病患者进行多国、开放标签Ⅱ期临床试验研究,纳入22例随机分组,可评价的病例数:A组(
此项临床试验含试验1,代号VANISH-303,临床试验编号NCT03734991和试验2,代号VANISH-306,临床试验编号NCT03987620的2批临床试验,纳入受试者的病情、服药剂量、疗程和试验设计均相似,所出现的不良反应事件合并统计:A组(
枸橼酸艾瑞芬净片是一种三萜类抗真菌药物,用于治疗成年女性患者和月经初潮后患有VVC的儿科女性患者[1,2,3]。
枸橼酸艾瑞芬净片只有薄膜包衣片一种剂型,每片含有效成分艾瑞芬净150 mg,片质量189.5 mg[1,2,3]。
6.2.1 一般患者 成年和月经初潮后的儿科女性患者,推荐剂量为300 mg,一天2次,间隔约12 h(上午和晚上各服一次),每日的总剂量为600 mg。是否与食物同服均可[1,2,3]。
6.2.2 与细胞色素P450(CYP)3A强抑制药联合用药需调整剂量 同时与强效CYP3A抑制药联合用药,每隔约12 h(如早上和晚上)各服150 mg,一天服枸橼酸艾瑞芬净片300 mg。同时与弱效或中度CYP3A抑制药联合用药无需调整剂量。
6.2.3 开始治疗前的妊娠评估 开始服用枸橼酸艾瑞芬净片治疗之前,有生育潜力女性须验证妊娠状态[1,2,3]。
①妊娠妇女;②对艾瑞芬净过敏的患者[1,2,3]。
动物研究的结果表明,妊娠期间禁服枸橼酸艾瑞芬净片,因可能对胎仔造成伤害。在动物繁殖研究,孕兔在器官形成期喂饲艾瑞芬净,与胎仔畸形有关,出现前肢、后肢、耳廓缺失和胸腹裂,接触剂量约≥5倍推荐人用剂量(RHD)的接触量。开始用枸橼酸艾瑞芬净片治疗前,有生育潜力的女性须确认妊娠状态。建议有生育潜力的女性在治疗期间和末次给药后4 d内使用有效的避孕措施[1,2,3]。
尚无关于艾瑞芬净是否存在于人乳或动物乳中、对母乳喂养婴儿的影响或对乳汁分泌量的影响的数据。是否母乳喂养应权衡对婴儿发育和健康的益处,与母亲对枸橼酸艾瑞芬净片临床治疗需要,以及药物或母亲疾病的任何潜在不利影响综合考虑[1,2,3]。
对妊娠动物的研究表明,雌性动物喂饲艾瑞芬净可能造成胎仔伤害。在开始服用枸橼酸艾瑞芬净片治疗前,应验证有生育潜力女性的妊娠状态,建议在治疗期间和服末次剂量后4 d内采用有效的避孕措施[1,2,3]。
枸橼酸艾瑞芬净片治疗VVC的安全性和有效性已在月经初潮后的儿科女性患者中得到证实。在月经初潮后的儿科患者中用药的证据来自对成年人使用枸橼酸艾瑞芬净片的充分,且良好的对照研究,得出非怀孕妇女,有月经初潮后的儿科女性安全性数据。枸橼酸艾瑞芬净片的安全性和有效性尚未在月经初潮前的儿科女性患者中得到证实[1,2,3]。
枸橼酸艾瑞芬净片的临床研究未包括足够数量≥65岁的老年患者,以确定其反应是否与较年轻受试者不同。与年轻人相比,观察到老年患者的艾瑞芬净药动学无临床意义的差异[1,2,3]。
美国FDA给予研发公司枸橼酸艾瑞芬净片及其适应证排他性保护期至2026年6月1日期满,根据美国总统鼓励研发新型抗菌药物所颁布的法令,对研制全新抗真菌药的排他性保护期延长5年,至2031年6月1日期满。研发公司申请枸橼酸艾瑞芬净片新制剂及其适应证的美国专利US8188085,已获授权,专利期至2030年8月28日期满,相应的中国专利CN104877001也已授权,专利期至2029年8月7日期满。研发公司申请3份美国专利:US10174074、US10370406和US10927142,保护艾瑞芬净新晶型,均已授权,专利期至2035年1月19日期满,笔者尚未查阅到在中国申请相应的专利保护,也未查阅到美国研发公司向国家药品监督管理局提出申请进口注册证的信息,尽管美国Scynexis制药公司已经与中国江苏豪森药业公司签订在大中华区合作开发艾瑞芬净及其商业化的协议,开发进展尚未查阅到相关网络报道。