神经保护治疗的现状
大多数被动物实验证实有效的神经保护药在临床试验中都以失败告终。有多种原因,如试验条件的差异、具体临床情况的不同、疗效参数评价以及临床前与临床研究数据之间药代动力学和毒性作用的区别等,可用来解释这种分歧?。随着对神经损伤发病机制了解的深入,神经保护的概念也随之发展。以往,神经保护治疗的目标是挽救神经元,现在看来这种观点是不全面的,因为神经损伤涉及神经胶质、血管以及特定的细胞和组织,也就是所谓的“神经血管单元”。更多的研究结果提示,抑制单一的致病介质似乎收效甚微,特别是这种介质在卒中发病后极早期产生和起作用时。因此,更为合理的思路应该是:同时抑制多种机制或作用于一条共同通路,或者更加特异性地保护一些基本成分,如细胞膜,这样可能更为有效。鉴于神经损伤后神经保护作用的局限性,将来的临床研究应集中在增加神经可塑性以及改善远期临床转归方面。虽然卒中发病后最初数天内的恢复很可能源于水肿的消退和(或)缺血半暗带的再灌注,但此后的恢复很大程度上取决于神经可塑性。因此,与神经保护相比,神经修复策略的治疗时间窗可能更宽。神经损伤后的恢复是一个复杂和动态的过程,突触可塑性与神经损伤后的行为改变和功能恢复改变有关。增加树突分支和棘的密度是脑内神经元环路重组的潜在形态学策略。许多药物,如胞磷胆碱可促进上述变化。胞磷胆碱能增加神经元细胞膜磷脂的合成,在脑缺血时具有抗凋亡和神经可塑性作用。另外,胞磷胆碱是唯一在Ⅲ期临床试验中证实具有神经保护和神经修复作用的药物。较宽的治疗时间窗、充分的生物利用度、良好的血脑屏障穿透性以及优异的安全性,使胞磷胆碱成为一种有前景的神经保护和神经修复药物。
胞磷胆碱的生物学效应、药代动力学和安全性
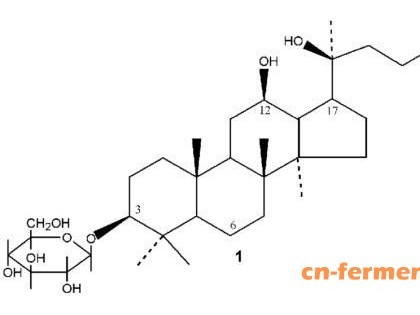
胞磷胆碱也被称为胞苷二磷酸胆碱,是一种由核糖、胞嘧啶、焦磷酸盐和胆碱组成的单核苷酸(图1)。人体内的磷脂主要包括磷脂酰胆碱、磷脂酰乙醇胺、磷脂酰肌醇和鞘磷脂。作为细胞膜结构的组成成分,它们是细胞膜行使功能,在维持内环境稳态、维持膜相关酶活性、耦联受体和细胞内信号以及神经冲动传导等方面必不可少。在中枢神经系统,80%的磷脂合成是由胞磷胆碱浓度改变调控的,而且胞磷胆碱的形成是磷脂酰胆碱通过Kennedy循环合成过程的限速步骤。外源性给予胞磷胆碱可加快磷脂合成,促进受损细胞表面和线粒体膜的迅速修复,维持细胞膜的完整性和细胞能量代谢。胞磷胆碱是一种生物利用度超过90%的水溶性化合物。外源性胞磷胆碱进入体内后,很快分解为胆碱和胞苷,它们穿过血脑屏障,并在中枢神经系统内重新合成胞磷胆碱。在健康志愿者中,胆碱和胞苷水平在注射后30 min达峰值,并且其循环浓度在此后6 h持续增高。放射性示踪剂研究表明,口服的胞磷胆碱能被迅速而完全地吸收,在肠壁内被水解为胆碱和胞苷,它们进入各种利用胞磷胆碱作为介质的生物合成通路,与静脉注射胞磷胆碱具有相同的生物利用度和相似的药代动力学特征。外源性胞磷胆碱广泛分布于皮质、白质和中枢灰质核团内,其消除极为缓慢,每天通过尿液、粪便和呼吸途径排泄少量。
胞磷月日碱的毒性极低。在临床前研究中,致死性口服剂量甚至无法被确定,因为在可能的最大口服剂量下没有出现动物死亡,在啮齿动物和狗中进行的亚急性和慢性毒理实验均未观察到毒性作用。一项大规模药物监督研究在4 191例急性缺血性卒中患者中分析了口服胞磷胆碱(500 4 000 mg/d)的安全性,仅3l例患者观察到37次不良反应,其中以神经系统相关症状最为常见,其次为胃肠道症状,没有患者因为不良反应而停药。
作用机制
众多动物实验和临床研究证实,胞磷胆碱在脑缺血发病最初数小时内具有神经保护作用,而在亚急性期(数天至数周)则具有增强神经可塑性和神经修复作用。这些作用主要是通过下列机制实现的:通过增加磷脂酰胆碱修复神经元细胞膜;通过增加乙酰胆碱、儿茶酚胺的合成稳定神经递质系统;减少缺血脑组织的游离脂肪酸(free fatty acid,FFA)聚积;促进脑组织能量代谢。
3.1 神经元细胞膜修复
脑组织优先利用胆碱合成乙酰胆碱,这会限制用于磷脂酰胆碱合成的胆碱量。当乙酰胆碱的需求增加或者胆碱贮备降低时,神经元细胞膜中的磷脂会被代谢分解以提供必需的胆碱。外源性给予胞磷胆碱能促进受损细胞膜和线粒体膜迅速修复,维持神经元细胞膜结构和功能的完整性,下调磷脂酶防止凋亡性和坏死性细胞死亡。在卒中亚急性期,为了支持神经生成、轴突芽生以及突触生成,对磷脂合成的需求极大。外源性给予胞磷胆碱可加快磷脂合成和神经元修复。卒中亚急性期接受胞磷胆碱处理的动物,运动功能恢复更好。与生理盐水对照组比较,大鼠永久性大脑中动脉闭塞24 h时用胞磷胆碱处理并持续28 d,能改善神经功能并增强树突的复杂性和提高棘的密度,提示胞磷胆碱治疗可改善未受损和功能联系脑区的神经元可塑性,促进功能恢复。
3.2神经递质生成
乙酰胆碱是一种介导学习、记忆和其他多种神经功能的神经递质。胆碱能神经通路损伤和乙酰胆碱释放减少是卒中后认知障碍的一个重要促进因素。胞磷胆碱在乙酰胆碱的生物合成中充当一种胆碱供体。卒中模型动物研究表明,给予胞磷胆碱可增加胆碱能神经末梢乙酰胆碱的释放,并改善动物的注意、学习和记忆功能。多巴胺是一种涉及运动、注意和其他多种功能的神经递质。胞磷胆碱可增加多巴胺合成,并可能通过促进酪氨酸羟化酶活性抑制神经末梢的多巴胺再摄取。另外,动物实验还发现,胞磷胆碱能增加大鼠皮质和下丘脑去甲肾上腺素释放。
3.3减少FFA聚积
在缺血神经元中,细胞能量障碍和ATP耗竭会导致细胞膜磷脂酰胆碱分解为FFA。FFA可介导额外的组织损伤。FFA被代谢为毒性氧化代谢产物和自由基,也能使线粒体氧化磷酸化解耦联。实验研究证实,外源性给予胞磷胆碱可刺激磷脂酰胆碱合成和减少FFA释放。另外,胞磷胆碱还能稳定携带谷氨酸转运体蛋白的脂筏,从而促进兴奋毒性谷氨酸从突触裂隙的清除。
3.4促进脑组织能量代谢
胞磷胆碱对脑细胞膜ATP酶和能量代谢所需酶类,尤其是琥珀酸脱氢酶和柠檬酸合成酶具有保护作用,对蛋白质和核酸代谢也具有保护作用,能增加特定脑区RNA的生物合成。全脑缺血大鼠大脑皮质葡萄糖摄取率显著降低,而胞磷胆碱能显著抑制这种降低,提示其在缺血情况下能改善脑组织的能量代谢。实验性局灶性缺血再灌注研究亦显示,胞磷胆碱能提高缺氧状态下的能量代谢率,大剂量胞磷胆碱可显著改善缺血动物的神经功能,该作用与胞磷胆碱改善脑组织代谢以及参与脑细胞膜磷脂合成有关。
临床应用
4.1缺血性卒中
S孤研和Wilterdink旧驯的汇总分析纳入了10项试验总共2 279例患者,其中8项试验在缺血性卒中患者中进行,另外2项在脑出血患者中进行。汇总分析表明,口服或静脉注射胞磷胆碱组长期随访时的死亡或残疾风险较安慰剂组显著降低(57.0%对67.5%,OR=0.64,95%C/O.54~0.77,P<0.000 01)。其中样本量最大(n>100)的4项缺血性卒中患者试验的结果一致,治疗效果有显著统计学意义:胞磷胆碱574/1 048(54.8%)对安慰剂500/773(44.7%)(OR=0.70,95%C/0.58~0.85,P<0.000 3)。安全性分析表明,以所有试验在随访结束时报告的死亡计算的病死率显示,胞磷胆碱无不良影响。为了最大限度地确定口服胞磷胆碱的益处, 6valos等对4项美国试验中个体患者水平的数据进行了合并分析。仅纳入基线时神经功能缺损显著[国立卫生研究院卒中量表(Nationfl Institutes of Health Stroke Scale,NIHSS)评分≥8分)]以及卒中前功能状态良好[改良№量表(modified RⅢlkiil Score,mRS)评分0~1分)]的患者,主要终点指标为3个月时NIHSS评分0一1分、Barthel指数≥95分以及mRS评分0—1分。结果表明,口服胞磷胆碱组总体恢复率显著高于安慰剂组(25.2%对20.2%,08=1.33,95%们1.10一1.62,P<0.003 4)。胞磷胆碱的总体安全性与安慰剂相似。因此认为,在中到重度卒中发病24 h内口服胞磷胆碱能显著增高患者的完全恢复率。
最近的一项大样本药物监督研究表明,在4 191例接受口服胞磷胆碱治疗的急性缺血性卒中患者中,无论是在早期(发病24 h内)还是晚期(发病24 h后)开始治疗,患者在治疗6周后的所有临床转归指标均得到显著改善(P<0.05);与在6周时结束治疗的患者相比,持续治疗超过12周的患者能进一步获益;另外,大剂量组(≥2 000 mg/d)的临床转归改善更加显著(P<0.001)。这些汇总分析提示,胞磷胆碱对急性和亚急性卒中患者有一定的益处。然而,仍然需要大样本随机试验进行前瞻|生验证。国际胞磷胆碱急性卒中试验(International Citicoline Trial on Acute Stroke,ICIUS)旧。将在中到重度(基线NIHSS评分≥8分)大脑中动脉供血区急性缺血性卒中患者中评价胞磷胆碱的疗效,患者在发病24 h内随机接受胞磷胆碱(前3 d 1∥12 h,静脉注射,然后改为口服,共持续6周)和安慰剂治疗,在90 d时评价对总体恢复(NIHSS评分≤1分,改良P,mlkin量表评分≤1分,Barthel指数I>95分)的影响。
4.2脑出血
动物模型研究已证实了胞磷胆碱对脑出血的治疗益处。为了评价胞磷胆碱治疗脑出血患者的安全性和有效性,Secades等旧纠进行了一项先导性随机双盲安慰剂对照试验。38例发病6 h内的脑出血患者随机分组后接受胞磷胆碱(1 000 mg,口服)或安慰剂治疗,为期2周。两组之间的不良反应发生率无显著差异,安慰剂组有1例、胞磷胆碱组有5例患者在发病3个月时能够生活自理(mRS评分≤2分)(OR=5.38,95%C/0.55~52.4)。这项初步试验表明,胞磷胆碱对于脑出血患者是一种安全的药物,而且有增加患者功能独立的趋势。
4.3认知障碍
阻断磷脂酰胆碱合成本身就足以导致细胞死亡,而阿尔茨海默病(Al eirner。s disease,AD)患者脑组织缺乏磷脂酰胆碱和磷脂酰乙醇胺,胞磷胆碱可纠正这种脑细胞膜损伤。另外,AD患者存在胆碱能神经系统功能异常,胞磷胆碱可通过增加乙酰胆碱合成来提供治疗作用。动物实验证实,胞磷胆碱能对抗海马内注射B.淀粉样蛋白诱导的神经元变性,凋亡细胞数量显著减少,记忆保存能力显著改善。
目前,在胞磷胆碱治疗认知障碍方面已进行过许多研究。Fioravanti和Yanagi进行的Cochrane评价纳入了14项试验总共1 051例患者,认为有证据表明胞磷胆碱对记忆、行为和总体功能(而不是注意)至少有短到中期的益处。
4.4脑外伤
胞磷胆碱能通过恢复损伤部位的血流促进脑外伤患者的记忆恢复。在一项单盲随机试验中,216例脑外伤患者随机分组接受常规治疗或常规治疗+胞磷胆碱,胞磷胆碱组认知和运动功能改善的患者更多,而两组之间的病死率无显著差异协。对包括从创伤性昏迷到脑震荡后综合征患者在内的一系列研究表明,胞磷胆碱对脑外伤治疗有益,其作用包括加快脑水肿消退、提早恢复意识、缩短住院天数、促进运动和记忆功能恢复以及改善生活质量。
4.5帕金森病
帕金森病以纹状体和黑质多巴胺能神经元选择性变性为特征。胞磷胆碱可提高酪氨酸羟化酶活性和增加多巴胺释放,已在多种帕金森病动物模型中证实有益。早期进行的一些小样本开放性和对照试验提示,胞磷胆碱对帕金森病患者有潜在的益处。左旋多巴与胞磷胆碱联合应用可显著减少左旋多巴用量,从而将其不良反应降至最低限度。然而,尚缺乏设计严谨的大样本试验。
4.6青光眼和缺血性视神经病
青光眼是老年人失明的主要原因,它是一种以视网膜神经节细胞凋亡为特征的神经变性疾病,部分可能是由眼压增高导致的视网膜和视网膜后结构缺血性损伤介导的。Parisi对青光眼患者进行为期60 d的口服或肌注胞磷胆碱治疗并应用图形视网膜电图和视觉诱发电位检测发现,患者视网膜功能和视觉神经通路传导功能显著改善,延长胞磷胆碱治疗8年可稳定或改善青光眼患者的视觉功能障碍。非动脉炎缺血性视神经病是一种慢性小动脉病变引起的眼内视神经的缺血性损伤。最近一项在26例患者中进行的随机开放标签试验发现,胞磷胆碱组患者视力改善而且视觉诱发电位增强。另外,胞磷胆碱还能显著改善弱视患者的视力,以及修复各种原因所造成的视神经损伤,对改善患者视神经功能有确切疗效。
展望
胞磷胆碱治疗神经损伤的有效性和安全性已得到大量临床实践和循证医学证据的证实,成为一种有前途的神经保护和神经修复药物。动物实验表明,胞磷胆碱联合溶栓药㈦1或其他神经保护药能显著缩小梗死体积,联合治疗策略应成为将来的研究方向之一。另外,鉴于其良好的安全性,应进行大样本研究来评价胞磷胆碱在院前急救时超早期应用的可行性和有效性,有望为缺血性卒中的急性期治疗带来新的希望。由于口服制剂的生物利用度高,药代动力学特征与静脉给药相似,胞磷胆碱特殊的神经修复作用以及长期用药为患者带来的益处,将使胞磷胆碱口服制剂成为临床应用的主要剂型。
作者:张茁 首都医科大学附属北京安贞医院神经内科