甜味剂是食品添加剂中的一类,按来源可分为人工合成甜味剂和天然甜味剂,天然甜味剂根据化学结构和性质可进一步分为糖类和非糖类甜味剂。最近的研究指出合成甜味剂会导致肠道菌群失调和葡萄糖耐受不良,造成代谢系统紊乱[1],并且成为一种新型的污染物造成环境污染[2];而糖的大量摄入助长了龋齿、肥胖、糖尿病、代谢综合征和心血管疾病的发生[3-5]。植物来源的天然非糖物质因具有高甜度[6]、低热量[7]、安全[8]、不引发龋齿[9]等特点,成为满足甜味需求的新一代甜味剂,受到人们越来越多的关注。
目前,国内外已开发利用的天然非糖甜味剂主要有:竹芋甜素(Thaumatin)、甜菊糖苷(Steviol glycosides)、罗汉果甜苷(Mogrosides)和甘草酸(Glycyrrhizic acid)[6] (表 1),其中最甜的是竹芋甜素,但表现出苦味和甘草的“异味”,且有甜味延迟出现和持续时间过长的缺点[17];其次是罗汉果甜苷,它无不适后味,且是唯一一个能减脂的纯天然甜味剂[14]。罗汉果甜苷V (Mogroside V,M5)是罗汉果甜苷甜度的主要来源[18],在万分之一浓度下的甜度值是5%蔗糖的425倍[19],且具有止咳祛痰[20]、抗癌[21-22]、抗氧化[23]、调节血糖[24]等诸多药理活性,使其成为国内外竞相研发的新一代功能性甜味剂。由于罗汉果的栽培存在许多困难[25],且M5在全果中的含量仅为0.8%–1.3% (W/W)[26],类似物复杂产品纯化难,依赖从罗汉果中提取无法实现大规模生产。
| Natural sweeteners | Sweetness potency* | Compound | Pharmacological functions | References |
| Thaumatin | 1 600–3 000 | Protein | Contraception, anti-bacteria, anti-diabetes, protecting the cardiovascular system | [6, 10] |
| Steviol glycosides | 100–300 | Terpenoid | Anti-diabetes, anti-hypertension, anti-oxidation, Anti-tumor, anti-inflammation, immunomodulation | [11-12] |
| Mogrosides | 68–465 | Terpenoid | Anti-diabetes, anti-cancer, anti-bacteria, anti-oxidation, reducing fat | [13-14] |
| Glycyrrhizic acid | 170 | Terpenoid | Anti-inflammation, hepatoprotectivity, anti-virus, anti-cancer | [15-16] |
| *: relative to sucrose. | ||||
植物细胞培养[27]、代谢工程[28]和合成生物学[29]的发展为植物天然产物的获取提供了可持续的生产思路。由于植物细胞培养成本高、耗时长、产量低,难以产生专门的天然产物;此外,植物细胞的复杂性以及缺乏遗传工具和适当的方法,使得植物细胞的代谢工程对于生产需要多步骤生物合成途径的复杂天然产物M5具有挑战性[30]。因此,植物细胞培养、代谢工程可能不是大规模生产M5的可行方法。合成生物学是近年来兴起的对生命系统和过程进行重新设计和工程化构建与应用的科学[31],与传统方法相比,具有周期短、产量高、安全无污染、提取工艺简单等优势,是一种绿色高效的新型生产模式。随着合成生物学研究的不断开展以及对罗汉果中甜苷分子生物合成机制[32]的深入了解,利用微生物合成M5成为其规模化生产的新途径,在满足消费者对天然甜味剂的需求方面具有重要意义和广阔前景。本文重点综述了M5的生物合成机制及合成生物学研究进展,并探讨了微生物合成所面临的挑战,以期为M5的生物合成研究提供参考。
1 罗汉果甜苷V的结构与药理活性罗汉果是葫芦科植物罗汉果Siraitia grosvenorii的成熟果实,有润肺止咳、凉血、润肠通便的功效,在中国作为常用中药使用[33],甜苷是其主要有效成分[34]。研究者[19, 35-36]在罗汉果中分离并鉴定出了多种甜苷,其基本结构如图 1所示。葡萄糖基数目及连接方式的不同产生了口味上有重大差异的甜苷分子:二糖基化的甜苷IIE味道极苦,而五糖基化的M5味道极甜[37]。M5是罗汉果甜苷中甜度和含量均较高的成分[38],它最早是由日本学者竹本常松等[39-41]分离得到的,并通过光谱学方法鉴定了苷元的结构为葫芦烷四环三萜罗汉果醇,进而构建了M5的完整结构。M5分子式为C60H102O29,是罗汉果醇在C3和C24位添加葡萄糖基而成,其中R2是两个吡喃葡萄糖基通过β-1, 6-糖苷键相连,R1是含分支的3个吡喃葡萄糖基通过β-1, 6-糖苷键和β-1, 2-糖苷键相连。
 |
| 图 1 罗汉果甜苷结构图(R=Glc或H)Fig. 1 Chemical structure of mogrosides (R=Glc or H). |
|
图选项
|
植物来源的天然非糖甜味剂往往表现出多种药理活性(表 1),M5具有止咳祛痰、抗癌、抗氧化、调节血糖等诸多功能。有研究表明罗汉果镇咳的有效部位为体积分数50%醇提部分,其中分离得到的M5能明显减少小鼠咳嗽次数、延长咳嗽潜伏期,并能明显增加气管酚红排泄量,说明有一定的祛痰作用[20]。M5可通过靶向多个生物学靶标来抑制胰腺癌细胞的增殖和存活[21],这在胰腺癌异种移植模型的小鼠体内得到了证实;7, 12-二甲基苯并蒽(DMBA)、12-O-十四烷酰佛波醇-13-醋酸酯(TPA)和过氧亚硝酸盐(ONOO–)作为致癌物质会诱导正常细胞转化为肿瘤细胞,通过小鼠皮肤癌变试验,发现M5通过拮抗致癌物减缓了正常细胞向皮肤癌细胞的转化[22],表明M5具有预防由化学致癌物引起的皮肤癌的作用。M5和11-O-罗汉果甜苷V能显著清除活性氧(O2–·、H2O2和·OH)并抑制DNA氧化损伤,其中11-O-罗汉果甜苷V对O2–·和H2O2的清除作用高于M5,然而对·OH而言,M5的清除效果更好[23]。研究发现M5能诱导胰岛素瘤细胞RIN-5F分泌胰岛素,从而在细胞水平揭示了M5对于糖尿病人具有血糖调节作用,该研究提示罗汉果提取物特别是M5对Ⅱ型糖尿病有防治潜力[24]。
2 罗汉果甜苷V生物合成机制研究合成生物学是通过将现有的生物合成路径在微生物细胞中进行重建[29],获得生产预期产物的微生物细胞工厂,从而实现目标化合物的规模化生产。因此明晰罗汉果中M5合成的分子机制,将为利用合成生物学构建细胞工厂、实现体外合成奠定基础。
2.1 罗汉果甜苷的积累规律了解罗汉果甜苷的积累规律有利于更好地分析M5合成的分子机制。对罗汉果发育过程中甜苷积累规律的研究表明,罗汉果甜苷的净含量守恒,即在整个生长过程中,甜苷的总含量保持不变[42]。在果实发育早期,甜苷主要以罗汉果甜苷IIE的形式存在,其R1和R2都是单糖基,说明甜苷糖基化的早期步骤是两个初级糖基化,之后R1上以β-1, 6-糖苷键连接第2个糖基使得罗汉果甜苷IIIX积累。在后期(开花后77 d)出现了大量的四糖基化产物,主要是赛门苷(Siamenoside),其R1含有β-1, 6-糖苷键和β-1, 2-糖苷键形成的分支。在开花后77 d开始消耗四糖基化产物,积累R2含两个糖基的M5,在成熟的最后阶段急剧增加。开花后103 d的成熟果实中甜苷的主要成分为M5。罗汉果甜苷的积累规律提示M5的生物合成途径为罗汉果醇首先在C3和C24位置上进行初级糖基化,然后在此基础上进行分支糖基化[32]。
2.2 罗汉果甜苷V生物合成途径解析转录组和代谢组学分析是阐明植物天然产物生物合成途经的有效策略[43]。2016年,以色列研究者Itkin等[32]根据罗汉果转录组和基因组数据,实现了M5生物合成途径的完整解析(图 2)。M5生物合成途径可大致分为3个阶段:上游前体物的合成阶段、中游骨架的形成阶段以及下游母核的产生及修饰阶段。
 |
| 图 2 罗汉果甜苷V的生物合成途径[32, 44]Fig. 2 The biosynthetic pathway of mogroside V[32, 44]. The pathway of acetyl-CoA to 2, 3-oxidosqualene is recognized as a common pathway for plant triterpenoid biosynthesis, and the pathway of 2, 3-oxidosqualene to mogroside V was proposed by Itkin et al. Double-arrows represent multi-step reaction. |
|
图选项
|
萜类物质合成的上游前体包括异戊烯焦磷酸(Isopentenyl pyrophosphate,IPP)和二甲基烯丙基焦磷酸(Dimethylallyl pyrophosphate,DMAPP)。植物合成IPP和DMAPP存在两种不同的途径:甲羟戊酸途径(Mevalonic acid pathway,MVA途径)和甲基赤藓糖醇磷酸化途径(Methylerythritol phosphate pathway,MEP途径)。不同途径的选择取决于合成产物的种类及亚细胞空间位置[45],MEP途径主要用于质体中的单萜、二萜和四萜的合成[46],MVA途径主要用于细胞质中的倍半萜、三萜及多萜的合成[47]。但两者并不是完全独立的,共同中间体IPP可通过质体膜互为对方所用[48]。
M5是胞质中的三萜皂苷类产物,其前体IPP和DMAPP是乙酰辅酶A经MVA途径生成的。首先是2分子乙酰辅酶A经乙酰辅酶A硫解酶(ATOT)、3-羟基-3-甲基戊二酰辅酶A合酶(HMGS)形成3-羟基-3-甲基戊二酰辅酶A (HMG-CoA)。随后在羟甲戊二酰辅酶A还原酶(3-hydroxy-3-methyl glutaryl coenzyme A reductase,HMGR)催化下形成甲羟戊酸(MVA),然后再通过甲羟戊酸激酶(MK)、甲羟戊酸磷酸激酶(PMK)和甲羟戊酸焦磷酸脱羧酶(MVD)等酶作用形成IPP。IPP在异戊烯焦磷酸异构酶(Isopentenyl pyrophosphate isomerase,IPI)催化下生成其双键异构体DMAPP。
2.2.2 骨架物24, 25-环氧葫芦二烯醇的形成牻牛儿基焦磷酸合酶(Geranyl pyrophosphate synthase,PS)催化IPP和DMAPP形成牻牛儿基焦磷酸(GPP),接着在法尼基焦磷酸合酶(Farnesyl pyrophosphate synthase,FPPS)催化下与1分子IPP合成法尼基焦磷酸(FPP),FPP在角鲨烯合酶(Squalene synthase,SQS)的催化下形成角鲨烯(SQ)。SQS是一个双功能酶,首先能够催化2分子的FPP缩合生成前角鲨烯二磷酸(PSPP),接着在NADPH和Mg2+存在的情况下将PSPP转化成SQ[44]。
长期以来,科学家们认为角鲨烯环氧酶(Squalene epoxidase,SQE)催化SQ一步反应生成链状的2, 3-环氧角鲨烯,再由环化酶将其环化成骨架物质葫芦二烯醇[49]。然而近期的研究表明,甜苷合成的骨架物质是24, 25-环氧葫芦二烯醇,并非葫芦二烯醇,由此推断其前体是2, 3;22, 23-双环氧角鲨烯而非2, 3-环氧角鲨烯;SQ在SQE的作用下进行两次连续的环氧化反应,依次产生2, 3-环氧角鲨烯、2, 3;22, 23-双环氧角鲨烯,后者在葫芦二烯醇合酶(Cucurbitadienol synthase,CDS)催化下环化为24, 25-环氧葫芦二烯醇[32]。
2.2.3 母核罗汉果醇的产生及修饰葫芦烷四环三萜类化合物中罗汉果甜苷的独特性在于C3、C11、C24和C25位的区域特异性氧合作用(图 2),形成母核罗汉果醇[32]。因此鉴定母核合成步骤的主要挑战是其独特的羟基化,特别是C24、C25位的反式羟基化。Itkin等[32]发现环氧化物水解酶(Epoxide hydrolase,EPH)负责催化24, 25-环氧葫芦二烯醇C24、C25位的羟基化,生成反式-24, 25-二羟基葫芦二烯醇,该化合物C11位再经细胞色素P450酶(CYP450)系中的CYP87家族成员CYP87D18 (CYP102801)[50]羟基化生成罗汉果醇。同时提出了羟基化反应的顺序:EPH蛋白倾向于与环氧葫芦二烯醇结合而不是链状的2, 3;22, 23-双环氧角鲨烯,因此EPH的反应在CDS环化反应之后;C11上的额外亲水性羟基会妨碍在EPH疏水口袋中的对接,所以C11羟基化反应在EPH反应后发生。
M5合成的最后一步是罗汉果醇C3、C24位的糖基化修饰。通过糖基转移酶与底物对接发现C24位的糖基化增加了对C3位糖基化的亲和力,并依据罗汉果甜苷的积累规律得出糖基化的顺序:罗汉果醇首先通过糖基转移酶UGT720-269-1进行C24位的初级糖基化,生成罗汉果甜苷Ⅰ-A1;后者经UGT720-269-1在C3位添加糖基生成罗汉果甜苷ⅡE;随后UGT94-289-3负责进行C3、C24位葡萄糖链的分支糖基化,经四糖基化中间物合成M5[32]。
3 罗汉果甜苷V合成生物学初探天然非糖甜味剂竹芋甜素作为蛋白类甜味剂,微生物生产的研究起步很早,目前已在多种微生物中实现了生产[51-53],但产量较低。甜菊糖苷的生物合成途径在2013年得到完整解析[54]。目前,发酵合成甜菊糖系列产品已有报道,主要是莱鲍迪苷A、莱鲍迪苷D和莱鲍迪苷M[55-56],但其产率较低,原因是构建的合成途径较长。2016年Xu等[57]报道了来源于甘草的UDP-葡萄糖醛酸转移酶GuUGAT (据推测属于UGT73家族),它催化甘草次酸的连续两步葡糖醛酸糖基化反应生成甘草酸,从而揭示了甘草酸生物合成的完整途径。李春教授课题组[58]以生产甘草次酸的工程菌为基础,通过导入人源的糖基转移酶UGT1A3基因,人源的UDP-葡萄糖脱氢酶UGDH (Hs)基因、大肠杆菌Escherichia coli来源的UGDH (Ec)基因得到生产甘草酸的重组菌。由于罗汉果甜苷生物合成途径解析较晚且途径较长,限制了M5合成生物学的研究。
3.1 底盘细胞的选择和优化底盘细胞是天然产物合成的工厂,选择具有成熟操作系统以及遗传稳定的底盘细胞是天然产物高效生产的基础,模式微生物大肠杆菌和酿酒酵母Saccharomyces cerevisiae常被用作底盘细胞。酿酒酵母在M5这种复杂天然产物异源合成的研究中具有独特的优势:内源性的MVA途径和麦角固醇合成途径能够稳定提供前体IPP、DMAPP和2, 3-环氧角鲨烯[59-60],完整的膜系统和翻译后修饰有利于环化酶、CYP450的活性表达。2, 3-环氧角鲨烯是植物三萜和甾醇骨架合成的共同前体物质[61],然而在甜苷的生物合成中,骨架合成的前体为2, 3;22, 23-双环氧角鲨烯。酿酒酵母内源的角鲨烯环氧酶(ERG1)可将2, 3-环氧角鲨烯氧化为2, 3;22, 23-双环氧角鲨烯[32, 62],意味着酿酒酵母ERG1可代替SgSQE行使功能。
酿酒酵母细胞中的大部分2, 3-环氧角鲨烯会经羊毛甾醇合酶(ERG7)进入麦角固醇合成通路[63],竞争向罗汉果甜苷转化的代谢流。酿酒酵母菌株GIL77因缺乏ERG7,积累了高浓度的2, 3-环氧角鲨烯[64],常被用作底盘细胞进行罗汉果甜苷合成相关酶的功能验证。同时随着三萜皂苷合成生物学研究的不断开展,优化酿酒酵母以积累大量2, 3-环氧角鲨烯的策略逐渐完善,主要有以下几种:1)过表达MVA途径的萜类合成相关基因[65-66];2)利用羊毛甾醇合酶抑制剂R0 48-8072或采用CRISPR/dCas9系统抑制ERG7的表达[32, 63],下调麦角固醇合成支路;3)使用全局转录因子UPC2的突变基因upc2-1直接或间接上调MVA途径中相关基因的转录效率[67]。
3.2 关键酶基因的克隆和表达实现M5在微生物细胞中从头合成,需要将关键酶基因进行异源组装。因此酶基因的克隆将为异源组装提供零件,酶的异源表达将为功能研究奠定基础。目前得到克隆和表达的关键酶有SQE、CDS、EPH、CYP450和糖基转移酶。
3.2.1 角鲨烯环氧酶角鲨烯环氧酶进行角鲨烯的双环氧化反应在许多三萜类合酶系统中已有报道[68-70],并且被功能表达的植物角鲨烯环氧酶可同时产生单氧化和双氧化角鲨烯[62, 71]。2018年,赵欢等[72]从罗汉果中克隆到2条注释为SQE基因全长片段,均含1 575 bp的完整开放阅读框,编码524个氨基酸,分别命名为SgSQE1和SgSQE2。由于SgSQEs编码的蛋白序列N端均有跨膜结构域,在原核表达时以无活性的包涵体存在,无法验证酶活。经蛋白底物的分子对接表明SgSQEs能够与配基2, 3-环氧角鲨烯相互作用形成氢键,推测可能具有生成双环氧角鲨烯的功能。之后,Itkin等[32]对SgSQE蛋白建模显示第一个环氧的存在并不妨碍第二个环氧化的对接,表明SgSQE可进行双环氧化反应。
3.2.2 葫芦二烯醇合酶2, 3-环氧角鲨烯在不同种类的氧化鲨烯环化酶(Oxidosqualene cyclase,OSC)的催化下,经过质子化作用、环化、重排和去质子化作用形成植物甾醇和三萜类骨架[73]。因此不同种类的OSC存在竞争,CDS作为OSC家族的一员,是罗汉果甜苷合成的关键环化酶,它的表达量及活性影响2, 3-环氧角鲨烯向罗汉果甜苷转化的代谢流,决定甜苷的产量。Dai等[74]通过罗汉果的RNA测序(RNA-seq)和数字基因表达谱(DGE)分析,鉴定出SgCDS,其cDNA全长2 800 bp,包含一个2 280 bp的ORF,编码具有759个氨基酸的蛋白质,预测分子量为84.4 kDa。之后利用酵母菌株GIL77验证了SgCDS的环化功能,可将2, 3-环氧角鲨烯环化成葫芦二烯醇。这似乎与罗汉果甜苷生物合成途径中SgCDS环化2, 3;22, 23-双环氧角鲨烯生成24, 25-环氧葫芦二烯醇(图 2)不一致。其实,Itkin等[32]使用酿酒酵母和转化的烟草Nicotiana tabacum L对SgCDS进行功能分析发现,SgCDS不仅可环化2, 3;22, 23-双环氧角鲨烯,还可环化2, 3-环氧角鲨烯生成葫芦二烯醇,只是后者未参与罗汉果甜苷的合成。进一步的研究表明,对于2, 3-环氧角鲨烯,SgCDS的环化优先于ERG1的环氧化,使得SgCDS主要表现出对2, 3-环氧角鲨烯的环化功能。
3.2.3 CYP450和糖基转移酶CYP450在植物体中是一个超基因家族,在合成包括萜类、类黄酮、生物碱和木质素等天然产物的氧化反应中起关键作用[75],具有严格的底物特异性和较低的序列相似性;糖基化酶可能为第二大植物酶家族1UGTs的成员,转移不同的糖基或糖基的受体不同,所需的糖基转移酶也不同[76],因此高效发掘并克隆催化特定代谢物生物合成的CYP450和糖基转移酶基因相对困难。Tang等[77]基于RNA-seq和DGE组合应用,并结合M5在开花后50–70 d快速积累规律,鉴定筛选了7个CYP450s和5个UDPGs作为负责M5合成的候选基因,开创了鉴定负责非模式植物中新型次级代谢物的生物合成编码酶的候选基因的有效方法。Zhang等[50]在罗汉果中鉴定出一种多功能细胞色素P450酶(CYP87D18)和一种糖基转移酶(UGT74AC1),通过体外酶活性测定表明,CYP87D18负责催化葫芦二烯醇C11位的氧化,生成11-氧葫芦二烯醇和11-羟基葫芦二烯醇;UGT74AC1可以特异性地将葡萄糖基转移至罗汉果醇的C3位形成罗汉果苷IE。几乎同时,Itkin等[32]在罗汉果中鉴定出191个CYP450s和131个UGTs,初步筛选了在发育的果实中表达的40个CYP450s和100个UGTs,分别在酵母和大肠杆菌中进行了功能验证。结果显示CYP87D18 (CYP102801)催化反式-24, 25-二羟基葫芦二烯醇C11位的羟基化生成罗汉果醇;UGT74-345-2、UGT75-281-2、UGT720-269-1和UGT720-269-4负责C3位的初级糖基化,其中UGT720-269-1也是唯一一个负责C24位初级糖基化的酶,UGT720-269-1、UGT94-289-1、UGT94-289-2和UGT94-289-3负责进行C3、C24位葡萄糖链的分支糖基化。
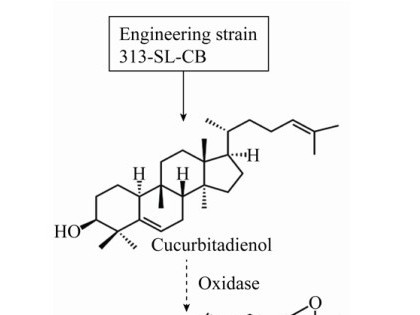
3.3 葫芦二烯醇的生物合成李守连等[78]利用实验室前期获得的三萜化合物的酵母底盘菌WD-2091 (FPS、SQS、SQE及MVA途径均过表达调控),将克隆到的SgCDS进行了异源表达和发酵,葫芦二烯醇的产量为27.44 mg/L;进一步将CDS基因从pRS425高拷贝质粒换到pRS313低拷贝质粒中,以调控CDS基因的表达,获得酿酒酵母细胞工厂313-SL-CB,葫芦二烯醇产量提高了202.07%,经高密度发酵产量达到1 724.10 mg/L,是目前葫芦二烯醇微生物合成的最高产量。该研究为推动葫芦烷型四环三萜化合物的高效细胞工厂创建奠定了基础。
构建M5的微生物细胞工厂可将原有的生物合成路径转移,也可对整个代谢途径进行重新设计与构建。虽然已证明葫芦二烯醇不是罗汉果甜苷合成的骨架物,但可利用高产葫芦二烯醇的工程菌313-SL-CB作底盘细胞,重组氧化酶基因,实现葫芦二烯醇向24, 25-环氧葫芦二烯醇的转化,再经过EPH、CYP450和糖基转移酶的催化,生成M5 (图 3)。
 |
| 图 3 罗汉果甜苷V微生物细胞工厂构建思路Fig. 3 Ideas for the construction of mogroside V microbial cell factory. Dotted-arrow represents the step of prediction, and double-arrows represent multi-step reaction. |
|
图选项
|
随着人们健康意识的提高,消费者对食物的追求不再局限于口感的满足,还越来越重视其健康性和功能性,使得天然非糖甜味剂的需求量呈“爆炸式”增长[30]。尤其是世界上最强的天然甜味物质之一的M5,因兼具药用功能,不仅可作为天然非糖甜味剂满足大众需求,同时也可作为糖尿病人、肥胖者的蔗糖替代品[79]。世界范围内对M5的需求逐渐增加[80],植物提取法已无法满足市场需求。合成生物学在植物天然产物的高效、可持续获取中具有独特的优势,已应用于多种天然产物的合成[81-83],因此,利用合成生物学进行M5的规模化生产成为必然趋势。目前M5生物合成途径得到了完整解析,关键酶进行了克隆和功能验证,但仍缺乏微生物生产的研究。
基于合成生物学原理,我们提出构建M5细胞工厂的两种策略:其一,如上文提到的(图 3),在高产葫芦二烯醇的工程菌313-SL-CB基础上实现向M5的转化,这是最便捷的途径;其二,可将参与2, 3;22, 23-双环氧角鲨烯到M5的5个酶基因(图 2)重组到酵母细胞中,实现从头合成。利用这两种策略实现M5活性分子的微生物生产仍存在诸多难题:首先第一种策略中催化葫芦二烯醇氧化成24, 25-环氧葫芦二烯醇的酶没有被挖掘,第二种策略中酵母内源的ERG1不能为SgCDS提供充足的2, 3;22, 23-双环氧角鲨烯;其次M5生物合成途径中涉及的酶和中间体较多,代谢过程复杂,将外源基因整合到单一的微生物细胞中难以实现其高效协调表达,也会给宿主造成较大的代谢压力;最后SgCDS、UGT720-269-1和UGT94-289-3都是非特异性酶,能作用于多种底物形成不同的产物,在底盘细胞中催化的顺序和方向难以控制。
针对存在的问题,我们提出以下策略:鉴定筛选催化葫芦二烯醇生成24, 25-环氧葫芦二烯醇的氧化酶和高效催化双环氧化反应的SQE;对2, 3-环氧角鲨烯的下游途径进行更加精确的调控,将2, 3-环氧角鲨烯更多地引向罗汉果甜苷的合成;近年来模块化共培养工程成为减轻细胞压力、提高目标产物产量的新策略[84-85],由此可将M5的生物合成途径合理地划分为不同的模块,然后将每个模块整合到特定的菌株中,将募集的菌株整合在一个空间,通过共培养实现M5的从头合成;利用结构生物学对酶蛋白进行结构解析,了解具体催化机制,通过适当的酶改造,增强葫芦二烯醇合酶和糖基转移酶的底物特异性;开发关键化合物实时监控和代谢动态调控技术,实现酶的定向催化。伴随着合成生物学和代谢工程的发展,必将实现M5的低成本、规模化生产。
| [1] |
Suez J, Korem T, Zeevi D, et al. Artificial sweeteners induce glucose intolerance by altering the gut microbiota. Nature, 2014, 514(7521): 181-186. DOI:10.1038/nature13793
|
| [2] |
Kokotou MG, Asimakopoulos AG, Thomaidis NS. Artificial sweeteners as emerging pollutants in the environment: analytical methodologies and environmental impact. Anal Methods, 2012, 4(10): 3057-3070. DOI:10.1039/c2ay05950a
|
| [3] |
Gupta P, Gupta N, Pawar AP, et al. Role of sugar and sugar substitutes in dental caries: a review. ISRN Dent, 2013, 2013: 519421.
|
| [4] |
Bray GA, Popkin BM. Dietary sugar and body weight: have we reached a crisis in the epidemic of obesity and diabetes?: health be damned! Pour on the sugar. Diabetes Care, 2014, 37(4): 950-956.
|
| [5] |
Yang QH, Zhang ZF, Gregg EW, et al. Added sugar intake and cardiovascular diseases mortality among US adults. JAMA Intern Med, 2014, 174(4): 516-524. DOI:10.1001/jamainternmed.2013.13563
|
| [6] |
Świąder K, Wegner K, Piotrowska A, et al. Plants as a source of natural high-intensity sweeteners: a review. J Appl Bot Food Qual, 2019, 92: 160-171.
|
| [7] |
Kroger M, Meister K, Kava R. Low-calorie sweeteners and other sugar substitutes: a review of the safety issues. Compr Rev Food Sci Food Saf, 2006, 5(2): 35-47. DOI:10.1111/j.1541-4337.2006.tb00081.x
|
| [8] |
Jin ML, Muguruma M, Moto M, et al. Thirteen-week repeated dose toxicity of Siraitia grosvenori extract in Wistar Hannover (GALAS) rats. Food Chem Toxicol, 2007, 45(7): 1231-1237. DOI:10.1016/j.fct.2006.12.030
|
| [9] |
Kinghorn AD, Kaneda N, Baek NI, et al. Noncariogenic intense natural sweeteners. Med Res Rev, 1998, 18(5): 347-360. DOI:10.1002/(SICI)1098-1128(199809)18:5<347::AID-MED5>3.0.CO;2-T
|
| [10] |
Adeogun O, Adekunle A, Ashafa A. Chemical composition, lethality and antifungal activities of the extracts of leaf of Thaumatococcus daniellii against foodborne fungi. Beni-Suef Univ J Basic Appl Sci, 2016, 5(4): 356-368. DOI:10.1016/j.bjbas.2016.11.006
|
| [11] |
Goyal SK, Samsher, Goyal RK. Stevia (Stevia rebaudiana) a bio-sweetener: a review. Int J Food Sci Nutr, 2010, 61(1): 1-10.
|
| [12] |
Singh DP, Kumari M, Prakash HG, et al. Phytochemical and pharmacological importance of stevia: a calorie-free natural sweetener. Sugar Tech, 2019, 21(2): 227-234. DOI:10.1007/s12355-019-00704-1
|
| [13] |
Jin JS, Lee JH. Phytochemical and pharmacological aspects of Siraitia grosvenorii, luo han kuo. Orient Pharm Exp Med, 2012, 12(4): 233-239. DOI:10.1007/s13596-012-0079-x
|
| [14] |
Zhang XB, Song YF, Ding YP, et al. Effects of mogrosides on high-fat-diet-induced obesity and nonalcoholic fatty liver disease in mice. Molecules, 2018, 23(8): 1894. DOI:10.3390/molecules23081894
|
| [15] |
Mizutani K, Kuramoto T, Tamura Y, et al. Sweetness of glycyrrhetic acid 3-O-β-D-monoglucuronide and the related glycosides. Biosci Biotechnol Biochem, 1994, 58(3): 554-555. DOI:10.1271/bbb.58.554
|
| [16] |
Isbrucker RA, Burdock GA. Risk and safety assessment on the consumption of Licorice root (Glycyrrhiza sp.), its extract and powder as a food ingredient, with emphasis on the pharmacology and toxicology of glycyrrhizin. Regul Toxicol Pharmacol, 2006, 46(3): 167-192.
|
| [17] |
DuBois GE, Prakash I. Non-caloric sweeteners, sweetness modulators, and sweetener enhancers. Annu Rev Food Sci Technol, 2012, 3: 353-380. DOI:10.1146/annurev-food-022811-101236
|
| [18] |
Williamson EM, Liu XM, Izzo AA. Trends in use, pharmacology, and clinical applications of emerging herbal nutraceuticals. Br J Pharmacol, 2020, 177(6): 1227-1240. DOI:10.1111/bph.14943
|
| [19] |
Matsumoto K, Kasai R, Ohtani K, et al. Minor cucurbitane-glycosides from fruits of Siraitia grosvenori (Cucurbitaceae). Chem Pharm Bull, 1990, 38(7): 2030-2032. DOI:10.1248/cpb.38.2030
|
| [20] |
Liu T, Wang XH, Li C, et al. Study on the antitussive, expectorant and antispasmodic effects of saponin V from Momordica grosvenori. Chin Pharm J, 2007, 42(20): 1534-1536,1590 (in Chinese).
刘婷, 王旭华, 李春, 等. 罗汉果皂苷Ⅴ的镇咳、祛痰及解痉作用研究. 中国药学杂志, 2007, 42(20): 1534-1536,1590. |
| [21] |
Liu C, Dai LH, Dou DQ, et al. A natural food sweetener with anti-pancreatic cancer properties. Oncogenesis, 2016, 5(4): e217.
|
| [22] |
Takasaki M, Konoshima T, Murata Y, et al. Anticarcinogenic activity of natural sweeteners, cucurbitane glycosides, from Momordica grosvenori. Cancer Lett, 2003, 198(1): 37-42. DOI:10.1016/S0304-3835(03)00285-4
|
| [23] |
Chen WJ, Wang J, Qi XY, et al. The antioxidant activities of natural sweeteners, mogrosides, from fruits of Siraitia grosvenori. Int J Food Sci Nutr, 2007, 58(7): 548-556. DOI:10.1080/09637480701336360
|
| [24] |
Zhou Y, Zheng Y, Ebersole J, et al. Insulin secretion stimulating effects of mogroside V and fruit extract of Luo Han Kuo (Siraitia grosvenori Swingle) fruit extract. Acta Pharm Sin, 2009, 44(11): 1252-1257.
|
| [25] |
Tu DQ, Ma XJ, Zhao H, et al. Cloning and expression of SgCYP450-4 from Siraitia grosvenorii. Acta Pharm Sin B, 2016, 6(6): 614-622. DOI:10.1016/j.apsb.2016.06.009
|
| [26] |
Makapugay HC, Nanayakkara NPD, Soejarto DD, et al. High-performance liquid chromatographic analysis of the major sweet principle to Lo Han Kuo fruits. J Agric Food Chem, 1985, 33(3): 348-350.
|
| [27] |
Rao SR, Ravishankar GA. Plant cell cultures: Chemical factories of secondary metabolites. Biotechnol Adv, 2002, 20(2): 101-153.
|
| [28] |
Dudareva N, DellaPenna D. Plant metabolic engineering: future prospects and challenges. Curr Opin Biotechnol, 2013, 24(2): 226-228.
|
| [29] |
Smanski MJ, Zhou H, Claesen J, et al. Synthetic biology to access and expand nature's chemical diversity. Nat Rev Microbiol, 2016, 14(3): 135-149.
|
| [30] |
Philippe RN, De Mey M, Anderson J, et al. Biotechnological production of natural zero-calorie sweeteners. Curr Opin Biotechnol, 2014, 26: 155-161.
|
| [31] |
Cameron DE, Bashor CJ, Collins JJ. A brief history of synthetic biology. Nat Rev Microbiol, 2014, 12(5): 381-390.
|
| [32] |
Itkin M, Davidovich-Rikanati R, Cohen S, et al. The biosynthetic pathway of the nonsugar, high-intensity sweetener mogroside V from Siraitia grosvenorii. Proc Natl Acad Sci USA, 2016, 113(47): E7619-E7628. DOI:10.1073/pnas.1604828113
|
| [33] |
Li DP, Zhang HR. Studies and uses of Chinese medicine Luohanguo-a special local product of Guangxi. Guihaia, 2000, 20(3): 270-276 (in Chinese).
李典鹏, 张厚瑞. 广西特产植物罗汉果的研究与应用. 广西植物, 2000, 20(3): 270-276. |
| [34] |
Lee CH. Intense sweetener from Lo Han Kuo (Momordica grosvenori). Experientia, 1975, 31(5): 533-534. DOI:10.1007/BF01932442
|
| [35] |
Kasai R, Nie RL, Nashi K, et al. Sweet cucurbitane glycosides from fruits of Siraitia siamensis (chi-zi luo-han-guo), a Chinese folk medicine. Agric Biol Chem, 1989, 53(12): 3347-3349.
|
| [36] |
Ukiya M, Akihisa T, Tokuda H, et al. Inhibitory effects of cucurbitane glycosides and other triterpenoids from the fruit of Momordica grosvenori on Epstein-Barr virus early antigen induced by tumor promoter 12-O-tetradecanoylphorbol-13-acetate. J Agric Food Chem, 2002, 50(23): 6710-6715. DOI:10.1021/jf0206320
|
| [37] |
Wang L, Li LC, Fu YX, et al. Separation, synthesis, and cytotoxicity of a series of mogrol derivatives. J Asian Nat Prod Res, 2019, 1-15.
|
| [38] |
Murata Y, Yoshikawa S, Suzuki YA, et al. Sweetness characteristics of the triterpene glycosides in Siraitia grosvenori. J Jpn Soc Food Sci Technol, 2006, 53(10): 527-533. DOI:10.3136/nskkk.53.527
|
| [39] |
Takemoto T, Arihara S, Nakajima T, et al. Studies on the constituents of fructus momordicae. I. On the sweet principle. Yakugaku Zasshi, 1983, 103(11): 1151-1154. DOI:10.1248/yakushi1947.103.11_1151
|
| [40] |
Takemoto T, Arihara S, Nakajima T, et al. Studies on the constituents of fructus momordicae. Ⅱ. Structure of sapogenin. Yakugaku Zasshi, 1983, 103(11): 1155-1166. DOI:10.1248/yakushi1947.103.11_1155
|
| [41] |
Takemoto T, Arihara S, Nakajima T, et al. Studies on the constituents of fructus momordicae. Ⅲ. Structure of mogrosides. Yakugaku Zasshi, 1983, 103(11): 1167-1173. DOI:10.1248/yakushi1947.103.11_1167
|
| [42] |
Li DP, Ikeda T, Huang YL, et al. Seasonal variation of mogrosides in Lo Han Kuo (Siraitia grosvenori) fruits. J Nat Med, 2007, 61(3): 307-312. DOI:10.1007/s11418-006-0130-7
|
| [43] |
Itkin M, Heinig U, Tzfadia O, et al. Biosynthesis of antinutritional alkaloids in solanaceous crops is mediated by clustered genes. Science, 2013, 341(6142): 175-179.
|
| [44] |
Harrison DM. The biosynthesis of triterpenoids, steroids, and carotenoids. Nat Prod Rep, 1990, 7(6): 459-484.
|
| [45] |
Lange BM, Ahkami A. metabolic engineering of plant monoterpenes, sesquiterpenes and diterpenes-current status and future opportunities. Plant Biotechnol J, 2013, 11(2): 169-196. DOI:10.1111/pbi.12022
|
| [46] |
Bouvier F, Rahier A, Camara B. Biogenesis, molecular regulation and function of plant isoprenoids. Prog Lipid Res, 2005, 44(6): 357-429. DOI:10.1016/j.plipres.2005.09.003
|
| [47] |
Liao P, Hemmerlin A, Bach TJ, et al. The potential of the mevalonate pathway for enhanced isoprenoid production. Biotechnol Adv, 2016, 34(5): 697-713. DOI:10.1016/j.biotechadv.2016.03.005
|
| [48] |
Laule O, Fürholz A, Chang HS, et al. Crosstalk between cytosolic and plastidial pathways of isoprenoid biosynthesis in Arabidopsis thaliana. Proc Natl Acad Sci USA, 2003, 100(11): 6866-6871. DOI:10.1073/pnas.1031755100
|
| [49] |
Shibuya M, Adachi S, Ebizuka Y. Cucurbitadienol synthase, the first committed enzyme for cucurbitacin biosynthesis, is a distinct enzyme from cycloartenol synthase for phytosterol biosynthesis. Tetrahedron, 2004, 60(33): 6995-7003. DOI:10.1016/j.tet.2004.04.088
|
| [50] |
Zhang JS, Dai LH, Yang JG, et al. Oxidation of cucurbitadienol catalyzed by CYP87D18 in the biosynthesis of mogrosides from Siraitia grosvenorii. Plant Cell Physiol, 2016, 57(5): 1000-1007.
|
| [51] |
Lee JH, Weickmann JL, Koduri RK, et al. expression of synthetic thaumatin genes in yeast. Biochemistry, 1988, 27(14): 5101-5107. DOI:10.1021/bi00414a023
|
| [52] |
Daniell S, Mellits KH, Faus I, et al. Refolding the sweet-tasting protein thaumatin Ⅱ from insoluble inclusion bodies synthesised in Escherichia coli. Food Chem, 2000, 71(1): 105-110. DOI:10.1016/S0308-8146(00)00151-5
|
| [53] |
Masuda T, Kitabatake N. Developments in biotechnological production of sweet proteins. J Biosci Bioeng, 2006, 102(5): 375-389. DOI:10.1263/jbb.102.375
|
| [54] |
Ceunen S, Geuns JMC. Steviol glycosides: chemical diversity, metabolism, and function. J Nat Prod, 2013, 76(6): 1201-1228. DOI:10.1021/np400203b
|
| [55] |
Wang JF, Li SY, Xiong ZQ, et al. Pathway mining-based integration of critical enzyme parts for de novo biosynthesis of steviolglycosides sweetener in Escherichia coli. Cell Res, 2016, 26(2): 258-261.
|
| [56] |
Olsson K, Carlsen S, Semmler A, et al. Microbial production of next-generation stevia sweeteners. Microb Cell Fact, 2016, 15: 207. DOI:10.1186/s12934-016-0609-1
|
| [57] |
Xu GJ, Cai W, Gao W, et al. A novel glucuronosyltransferase has an unprecedented ability to catalyse continuous two-step glucuronosylation of glycyrrhetinic acid to yield glycyrrhizin. New Phytol, 2016, 212(1): 123-135. DOI:10.1111/nph.14039
|
| [58] |
Li C, Zhao YJ, Feng XD, et al. Application of glycosyl transferase in glycyrrhizic acid synthesis: CN, 110106222. 2019-08-09 (in Chinese).
李春, 赵雨佳, 冯旭东, 等.一种糖基转移酶在合成甘草酸中的应用: CN, 110106222. 2019-08-09. |
| [59] |
Liu JD, Zhang WP, Du GC, et al. Overproduction of geraniol by enhanced precursor supply in Saccharomyces cerevisiae. J Biotechnol, 2013, 168(4): 446-451.
|
| [60] |
Augustin JM, Kuzina V, Andersen SB, et al. Molecular activities, biosynthesis and evolution of triterpenoid saponins. Phytochemistry, 2011, 72(6): 435-457.
|
| [61] |
Guo HH, Li RF, Liu SB, et al. Molecular characterization, expression, and regulation of Gynostemma pentaphyllum squalene epoxidase gene 1. Plant Physiol Biochem, 2016, 109: 230-239. DOI:10.1016/j.plaphy.2016.10.002
|
| [62] |
Rasbery JM, Shan H, LeClair RJ, et al. Arabidopsis thaliana squalene epoxidase 1 is essential for root and seed development. J Biol Chem, 2007, 282(23): 17002-17013.
|
| [63] |
Yu Y, Chang PC, Yu H, et al. Productive amyrin synthases for efficient α-amyrin synthesis in engineered Saccharomyces cerevisiae. ACS Synth Biol, 2018, 7(10): 2391-2402.
|
| [64] |
Wang ZH, Yeats T, Han H, et al. Cloning and characterization of oxidosqualene cyclases from Kalanchoe daigremontiana: enzymes catalyzing up to 10 rearrangement steps yielding friedelin and other triterpenoids. J Biol Chem, 2010, 285(39): 29703-29712. DOI:10.1074/jbc.M109.098871
|
| [65] |
Yao Z, Zhou PP, Su BM, et al. Enhanced isoprene production by reconstruction of metabolic balance between strengthened precursor supply and improved isoprene synthase in Saccharomyces cerevisiae. ACS Synth Biol, 2018, 7(9): 2308-2316.
|
| [66] |
Paramasivan K, Mutturi S. Regeneration of NADPH coupled with HMG-CoA reductase activity increases squalene synthesis in Saccharomyces cerevisiae. J Agric Food Chem, 2017, 65(37): 8162-8170. DOI:10.1021/acs.jafc.7b02945
|
| [67] |
Ro DK, Paradise EM, Ouellet M, et al. Production of the antimalarial drug precursor artemisinic acid in engineered yeast. Nature, 2006, 440(7086): 940-943. DOI:10.1038/nature04640
|
| [68] |
Nelson JA, Steckbeck SR, Spencer TA. Biosynthesis of 24, 25-epoxycholesterol from squalene 2, 3;22, 23-dioxide. J Biol Chem, 1981, 256(3): 1067-1068.
|
| [69] |
Boutaud O, Dolis DH, Schuber F. Preferential cyclization of 2, 3(S):22(S), 23-dioxidosqualene by mammalian 2, 3-oxidosqualene-lanosterol cyclase. Biochem Biophys Res Commun, 1992, 188(2): 898-904. DOI:10.1016/0006-291X(92)91140-L
|
| [70] |
Godio RP, Fouces R, Martín JF. A squalene epoxidase is involved in biosynthesis of both the antitumor compound clavaric acid and sterols in the basidiomycete H. sublateritium. Chem Biol, 2007, 14(12): 1334-1346. DOI:10.1016/j.chembiol.2007.10.018
|
| [71] |
Suzuki H, Achnine L, Xu R, et al. A genomics approach to the early stages of triterpene saponin biosynthesis in Medicago truncatula. Plant J, 2002, 32(6): 1033-1048.
|
| [72] |
Zhao H, Guo J, Tang Q, et al. Cloning and expression analysis of squalene epoxidase genes from Siraitia grosvenorii. China J Chin Mater Med, 2018, 43(16): 3255-3262 (in Chinese).
赵欢, 郭娟, 唐其, 等. 罗汉果角鲨烯环氧酶基因的克隆及表达分析. 中国中药杂志, 2018, 43(16): 3255-3262. |
| [73] |
Wu TK, Chang CH, Liu YT, et al. Saccharomyces cerevisiae oxidosqualene-lanosterol cyclase: a chemistry-biology interdisciplinary study of the protein's structure-function-reaction mechanism relationships. Chem Rec, 2008, 8(5): 302-325. DOI:10.1002/tcr.20157
|
| [74] |
Dai LH, Liu C, Zhu YM, et al. Functional characterization of cucurbitadienol synthase and triterpene glycosyltransferase involved in biosynthesis of mogrosides from Siraitia grosvenorii. Plant Cell Physiol, 2015, 56(6): 1172-1182. DOI:10.1093/pcp/pcv043
|
| [75] |
Han JY, Kim HJ, Kwon YS, et al. The Cyt P450 enzyme CYP716A47 catalyzes the formation of protopanaxadiol from dammarenediol-Ⅱ during ginsenoside biosynthesis in Panax ginseng. Plant Cell Physiol, 2011, 52(12): 2062-2073. DOI:10.1093/pcp/pcr150
|
| [76] |
Caputi L, Malnoy M, Goremykin V, et al. A genome-wide phylogenetic reconstruction of family 1 UDP-glycosyltransferases revealed the expansion of the family during the adaptation of plants to life on land. Plant J, 2012, 69(6): 1030-1042. DOI:10.1111/j.1365-313X.2011.04853.x
|
| [77] |
Tang Q, Ma XJ, Mo CM, et al. An efficient approach to finding Siraitia grosvenorii triterpene biosynthetic genes by RNA-seq and digital gene expression analysis. BMC Genomics, 2011, 12: 343. DOI:10.1186/1471-2164-12-343
|
| [78] |
Li SL, Wang D, Liu Y, et al. Study of heterologous efficient synthesis of cucurbitadienol. China J Chin Mater Med, 2017, 42(17): 3326-3331 (in Chinese).
李守连, 王冬, 刘怡, 等. 葫芦二烯醇的异源高效合成研究. 中国中药杂志, 2017, 42(17): 3326-3331. |
| [79] |
Xia Y, Rivero-Huguet ME, Hughes BH, et al. Isolation of the sweet components from Siraitia grosvenorii. Food Chem, 2008, 107(3): 1022-1028. DOI:10.1016/j.foodchem.2007.09.014
|
| [80] |
Wang L, Yang ZM, Lu FL, et al. Cucurbitane glycosides derived from mogroside ⅡE: structure-taste relationships, antioxidant activity, and acute toxicity. Molecules, 2014, 19(8): 12676-12689. DOI:10.3390/molecules190812676
|
| [81] |
Liu LQ, Liu H, Zhang W, et al. Engineering the biosynthesis of caffeic acid in Saccharomyces cerevisiae with heterologous enzyme combinations. Engineering, 2019, 5(2): 287-295.
|
| [82] |
Srinivasan P, Smolke CD. Engineering a microbial biosynthesis platform for de novo production of tropane alkaloids. Nat Commun, 2019, 10: 3634.
|
| [83] |
Chen HF, Zhu CY, Zhu MZ, et al. High production of valencene in Saccharomyces cerevisiae through metabolic engineering. Microb Cell Fact, 2019, 18: 195. DOI:10.1186/s12934-019-1246-2
|
| [84] |
Wang RF, Zhao SJ, Wang ZT, et al. Recent advances in modular co-culture engineering for synthesis of natural products. Curr Opin Biotechnol, 2020, 62: 65-71. DOI:10.1016/j.copbio.2019.09.004
|
| [85] |
Li ZH, Wang XN, Zhang HR. Balancing the non-linear rosmarinic acid biosynthetic pathway by modular co-culture engineering. metab Eng, 2019, 54: 1-11. DOI:10.1016/j.ymben.2019.03.002
|