继《我国抗体药物生产厂房关键建筑参数研究》之后,火石创造推出姊妹篇《我国细胞制备中心产业空间关键建筑参数研究》。
随着全球细胞治疗进入发展快车道和中国市场大踏步迈入商业化元年,细胞治疗产品研发、生产用产业空间的关键建筑参数备受各地政府、产业园区、企业关注。本文重点结合国内相关行业规范,并在大量实地调研、专家访谈的基础上对细胞制备中心产业空间关键建筑参数予以探讨,以期为各地发展细胞治疗产业提供空间建设参考。
一 建筑特殊性
层高、荷载、建面等是关键建筑参数
细胞治疗产品涉及广大人民的生命健康,因此其建筑设计在各个方面都有着较强的特殊性和严格的要求。对于细胞治疗产品产业空间,唯有合理的规划及设计才能够充分满足企业从创新到研发再到商业化生产的整个发展成长过程需求。因此,十分有必要明确细胞治疗产业空间的关键参数及其参数范围,根据关键参数设计产业空间,以实现产业空间与产业发展的精准匹配。
生物医药产业空间关键建筑参数主要包括层高、荷载、层数、建筑面积、单层建面等,其中层高=梁高+洁净区净高+技术夹层高度。一般而言,医药工业建筑层高的决定因素主要有以下方面:大型工艺设备(反应罐、顶装层流单元、灭菌柜、分装机、冻干机)、净化空调系统与公用服务管道(电缆桥架、消防/冷热媒管道、工艺空间上部的送回风管道)。生物医药厂房洁净度要求越高,所需要的风管高度越大,则层高需要越高。
二 建筑标准
无统一建筑技术规范,但团体标准日趋完善
目前,我国没有统一的关于细胞治疗产业标准化厂房的建筑技术规范,各产业园区和企业均依据研发生产需要自行设计相关参数,但选址、设计及布局应符合现行的《实验室生物安全通用要求》GB19489、《生物安全实验室建筑技术规范》GB50346、《药品生产质量管理规范》(GMP)、美国血库协会(AABB)以及《医药工业洁净厂房设计标准》GB 50457的相关要求。
细胞制备中心是一个以精准性、个体化的预测与干预为特点的医学范式而建立的链接生物治疗技术与临床转化应用的细胞制备技术服务中心,其作为各地发展细胞治疗产业的重要载体,近年来各地对其建筑技术标准和管理规范日趋完善。
截至2022年6月,我国已有包括上海市、深圳市、湖南省、河北省、杭州市、青岛市多个省(市)政府部门或行业团体出台“细胞制备中心”建筑技术标准或管理规范,对细胞制备中心的建设要求、设置原则、人员配备要求、管理要求等予以明确。例如2013年上海市质量技术监督局发布《临床细胞治疗平台设置基本要求》(DB31/T 687),明确临床细胞治疗平台设置基本要求。
表1 各地关于细胞制备中心的建筑技术标准和管理规范政策文件
数据来源:火石创造根据公开资料整理
三 关键参数
相较于其他赛道关键参数具有更高标准
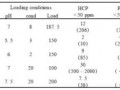
综合各地相关标准和要求,根据生物医药厂房关键参数总结提炼细胞治疗研发、生产空间的关键建筑参数如下。其中,由于细胞制备的整个操作过程一般需要在洁净区内完成,因此对细胞制备中心的单层建面有特殊要求,以保障细胞制备全程处于无菌操作环境。其次,由于细胞制备对洁净度的要求,空气洁净度至少应在B级背景下的A级环境中进行(或C级背景下的A级环境中进行),其层高一般不小于6m。另外,由于自体细胞制备为小批量生产,无需大型发酵设施设备,因此标准荷载即可满足要求。
表2:细胞制备中心产业空间关键建筑参数(部分)
数据来源:火石创造
四 其他要求
厂址选择和总平面布置
(1)厂址选择
细胞制备建筑位置选择应符合《药品生产质量管理规范》GMP和行业相关规范,应根据下列原则并经技术经济方案比较后确定。
应在大气含尘、含菌浓度低,无有害气体,自然环境好的区域;应远离铁路、码头、机场、交通要道以及散发粉尘和有害气体的工厂、贮仓、堆场等空气污染、水质污染、振动或噪声干扰的区域;应远离散发花粉传播源的区域;应远离产生放射性物质的区域;不宜选择坡地或地质条件变化太大的区域。垃圾站旁、医院旁、道路旁和闹市等地方不应作为细胞制备建筑建设场地,离开这些区域不应少于200m。
将要进行拆迁的建筑,易发生自然灾害(如易发生洪水、泥石流、海啸和火山爆发等)的地方不能作为细胞制备建筑建设场地。
细胞制备建筑与交通干道之间的距离宜大于50m;当细胞制备建筑与交通干道之间设有不能开花的城市绿化带时,可根据具体条件适当减少,但不应小于25m;与交通次干道之间的距离应大于25m。
对于有微震控制要求的建筑位置的选择,应实际测定周围现有震源和模拟震源的影响,并应与容许震动值比较分析后确定。
(2)总平面布置
细胞制备建筑设计及布局应符合《药品生产质量管理规范》GMP要求,质量检测区同时应符合《检测和校准实验室能力的通用要求》GB/T27025的要求。
厂区总平面布置时,应按洁净生产、非洁净生产、辅助生产、公用动力系统和办公、辅助和生活等功能区合理布局。细胞制备建筑平面布局应符合《实验室生物安全通用要求》GB19489、《医院洁净手术部建筑技术规范》GB50333、《生物安全实验室建筑技术规范》GB50346、《医药工业洁净厂房设计规范》GB50457、中国药典、国家和行业相关规范的要求。