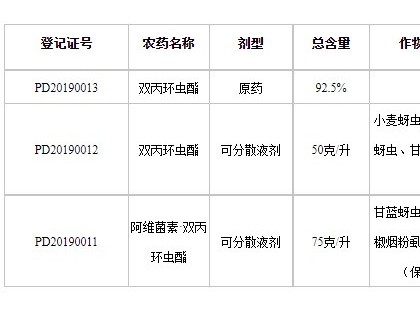
1.1 鼠李糖脂的来源
鼠李糖脂通常是由铜绿假单胞菌在一定培养条件下,通过生物发酵的方法产生的具有表面活性的糖脂类产物[1]。1949年,Jarvis和Johnson最早对使用铜绿假单胞菌(Pseudomonas spp.)生产鼠李糖脂进行了报道[2]。目前,人们通常采用假单胞菌(Pseudomonas spp.)发酵生产鼠李糖脂。发酵法的关键是首先筛选出性能优良的高产菌株,然后再进行培养条件的优化来提高产量、降低成本。培养基中的碳源是决定生物表面活性剂产量和结构的重要因素。鼠李糖脂在菌株培养中生产的限制条件是发酵过程中累积的次级代谢产物,这些限制条件不包括碳源,而氮源和磷则会限制鼠李糖脂的生产[3]。鼠李糖脂发酵的关键首先是能筛选或者构建出鼠李糖脂产量高的菌株,然后再对合适的生产菌株的发酵的各种条件进行优化,从而达到高产量低成本的目标。条件优化主要从碳源、氮源、无机盐离子以及pH、温度等方面来进行[4]。
目前主要通过代谢工程和基因工程方法来提高鼠李糖脂产量,这些策略的主要目的是:(a)不使用化学消泡剂获得高浓度的鼠李糖脂;(b)利用可再生资源生产鼠李糖脂,降低生产底物成本;(c)控制生产过程中的其他产物,获得单一的鼠李糖脂而不是混合物;(d)建立鼠李糖脂的非致病性生产菌株;(e)寻常基础材料生物催化鼠李糖脂的生产[5]。实际工业生产中,鼠李糖脂生产条件的优化主要是通过添加脂肪酸、生产菌株随机突变、控制发酵pH值、控制底物摄取量和运用Tween-80及Triton X-100提高鼠李糖脂的产量。之前有研究者将鼠李糖基转移酶复合物I(Rh1AB)在相对较安全的生产宿主恶臭假单胞菌KT2440中异源表达,但是产量提高的很少[6]。可以通过构建工程菌株提高鼠李糖脂产量,之前有研究证明自转运酯酶参与了细胞膜的形成和运动,也参与了脂类的运输,当敲除自转运酯酶基因,鼠李糖脂产量明显降低,由此可知,自转运酯酶也参与了鼠李糖脂的形成,过量表达自转运酯酶EstA[7]和鼠李糖基转移酶复合物I(Rh1AB)提高鼠李糖脂产量[8]。
1.2 鼠李糖脂的结构
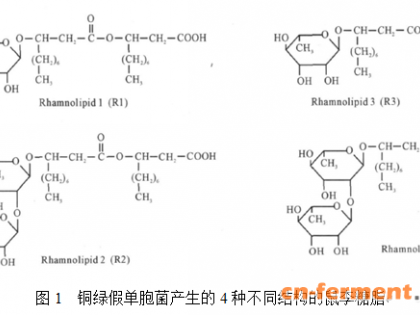
鼠李糖脂结构主要包括两部分,由鼠李糖和具有不同碳链长度的饱和或不饱和脂肪酸构成。鼠李糖脂的分子结构中既有极性基团又有非极性基团,是一类中性两极分子。亲水基团是非离子形式的单或双鼠李糖,疏水基团是由带羟基的脂肪酸组成。在生物合成过程汇总,这些基团之间可能相互衔接而生成多种结构相近的同系物,并且不同的菌株和发酵条件所得到的鼠李糖脂同系物组成不同。研究表明[9],铜绿假单胞菌产生的鼠李糖脂主要有四种结构,如图1所示[10],分别是RL1、RL2、RL3和RL4,其中RL1和RL3 为单鼠李糖脂;RL2和RL4为双鼠李糖脂。随着现代分析手段的应用,发酵产物中大量不同的鼠李糖族同系物被发现,而且它们分别连着不同的脂肪酸链,鼠李糖环也各不相同。

1.3鼠李糖脂的理化性质及优点
鼠李糖脂是一种阴离子表面活性剂,是表面活性剂家族中的后起之秀,它是由微生物所产生的一类具有表面活性的生物大分子物质。它不仅溶于甲醇、氯仿和乙醚,在碱性水溶液中也表现出良好的溶解特性,与化学合成的表面活性剂相比,生物表面活性剂除具有降低表面张力、稳定乳化液和增加泡沫等相同作用外,由于生物表面活性剂来自微生物的代谢活动,还具有一般化学合成的表面活性剂无法比拟的特征和优点:(1)高效性:生物表面活性剂的化学结构要比化学合成的表面活性剂复杂和庞大得多。单个分子要占据更大的空间,因而表面活性要强于化学表面活性剂,具有更多的活性基团,可以更好地吸附于油水界面,改善油水界面性状,因而在降低水-气及油-水界面张力方面更加有效。
(2)耐温性:有些生物表面活性剂可耐受高温,如由地衣芽孢杆菌产生的脂肽在75℃时至少可耐热140h而保持很好的表面性能。
(3)耐盐性:生物表面活性剂在10%的盐溶液中仍不沉降或析出,而化学合成表面活性剂在2~3%的盐溶液中就会失活。
(4)可生化降解性:生物表面活性剂在水体或土壤中都能很快被微生物100%降解。
(5)环境友好性:生物表面活性剂产品本身低毒或无毒,生产的原料天然,工艺简单,使用中用量少,选择性好,对环境友好。
(6)可原位合成性:因而有可能大大降低其使用成本。另外,通过微生物的生物方法可以在分子中引进化学方法难以合成的复杂基团,使得生物表面活性剂化学结构具有多样性,从而可能使其具有某种特殊功能。
鼠李糖脂是目前生物表面活性剂中最重要、应用最广泛的一类,它属于水溶性阴离子生物表面活性剂,具有降低界面张力、增溶、乳化、渗透、润湿等多种功能,同时它又具有较好的热稳定性和化学稳定性,在90℃时仍具有很好的表面性能,并且能被微生物100%降解,是典型的环保型绿色产品。
1.4 鼠李糖脂生物表面活性剂已获得的绿色认证
(1)急性经口毒性试验LD50>5000mg/kg·Bw,属实际无毒。
(2)2004年,美国环保署即通过了鼠李糖脂作为生物农药的备案(PC Code 110029)。
(3)纽约州环境保护部固体和危险材料农药管理局,新的活性成分鼠李糖脂登记农药新产品的注册文件(EPA注册编号72431-1)。
(4)鼠李糖脂作为一种新的活性成分,申请登记生物杀菌剂的联邦登记公告。2003年5月7日(68 FR 24456)。
(5)美国环保署(EPA),关于鼠李糖脂生物表面活性剂在食品中、农药化学品中的容许量申请及批复。(68 FR 25026和68 FR 16796)
1.5 鼠李糖脂生物表面活性剂在绿色农业上的应用方向
(1)添加于肥料中提高肥料利用率,增强肥效;
(2)直接作为生物农药或添加于农药产品中,增强药效;
(3)用于土壤调节,增强土壤活力;
(4)用于果蔬保鲜。
二、鼠李糖脂在生物农药方面的应用
2.1鼠李糖脂的防治机理
2.1.1鼠李糖脂对于孢子类植物病原菌的生物合成有抑制作用
鼠李糖脂可破坏真菌的细胞膜,使孢子丧失移动性并快速水解,进而抑制真菌孢子萌发和菌丝生长。Stanghellini等[11]研究发现浓度为30μg/mL鼠李糖脂能使辣椒疫霉病和黄瓜腐霉病孢子在1min内全部完全水解。鼠李糖脂瓦解真菌孢子细胞壁,促使植物病菌死亡,在葡萄灰霉病、大豆疫霉菌、辣椒炭疽病上也同样发现鼠李糖脂有溶解真菌细胞壁的作用[12-14]。真菌细胞壁主要由几丁质和β-1,3-葡聚糖组成,几丁质在细胞壁内部,葡聚糖在细胞壁内外部均有。鼠李糖脂处理被真菌病害侵染的植物之后,植物体内几丁质酶和β-1,3-葡聚糖酶增加,病原菌细胞壁被水解酶破坏,菌丝细胞壁变薄,破碎,最终死亡[11,13]。
此外,鼠李糖脂能阻止病菌孢子的移动,降低病菌对植株的侵染率[12,14,15]。鼠李糖脂在土壤中有很好的溶解性和分散性,高浓度的鼠李糖脂在土壤中能有效阻止孢子移动,降低其对植物的侵染,从而达到预防植物病害的目的。
2.1.2诱导抗性
植物与病原体协同进化过程中,逐渐形成了一系列的高效保护机制来抵御病原物的侵害。植物免疫系统分两个层次,第一个层次是由病原相关分子模式(PAMPs)触发的免疫反应(PTI);第二个层次是触发性免疫(ETI);PTI和ETI 都属于免疫信号,但PTI比ETI更加强烈和持久[16-18]。
茉莉酸、水杨酸和乙烯在植物PTI和ETI信息网络中起着关键的作用。鼠李糖脂可促使拟南芥防御基因PR-1(水杨酸标记基因),PDF1.2(茉莉酸/乙烯标记基因)和PR-4(乙烯标记基因)表达,触发拟南芥的防御反应[19]。在西瓜、葡萄、小麦和烟草中,鼠李糖脂诱导植物免疫反应也有报道[13,20,21]。鼠李糖脂能激活PTI,预防葡萄灰霉病的发生,用0.025 mg/mL鼠李糖脂处理灰霉病感染的葡萄叶片,与对照相比几丁质酶基因表达高达320倍[13]。几丁质酶和β-1,3-葡聚糖酶属于水解酶类的病程相关蛋白(PRS)也属于防御产物,与植物系统诱导性抗性(ISR)密切相关。鼠李糖脂能在室温条件下通过诱导植物抗性反应来预防西瓜枯萎病,与对照相比,喷施1.0 g/L 的鼠李糖脂,可使西瓜叶片几丁质酶和β-1,3-葡聚糖酶分别升高49.95%和63.04%[22]。在酶水解真菌细胞壁过程中,细胞壁可释放出寡糖,可作为植物多种抗病反应的激发因子,诱导植物抗病反应[23]。鼠李糖脂能促使植物抗性基因表达,激活植物自身免疫系统,诱导植物对病原菌产生抗性,从而使植物免受病菌的侵害。
2.1.3具有优良的乳化性能及渗透性能
鼠李糖脂在农药产品中可作为乳化剂添加,同时由于其优良的表面活性及改善植物细胞通透性的作用,在促进农药有效成分植物吸收上也能发挥很好的作用。
农药普遍存在投放量高、有效利用率低的问题,喷施的药液不能在生物靶向表面形成理想的润湿分布,药液流失严重,有效成分传递率降低,造成农药的大量浪费,此外常用的表面活性剂相对分子质量较低,用在农药水基性剂型上(如水乳剂、悬乳剂等),会导致它们在贮存期间粒子的絮凝和聚集以及粒子间粘连增多的问题,不能使农药达到长期稳定的效果,故需要通过提高药量来达到效果。
鼠李糖脂作为一种相对分子质量较大的表活剂,其自身的结构特点决定其具备较为优良的分散性及吸附粒子能力,使药剂在使用中更好的附着于表面,不易脱落和转移,能够保证农药作用效果的长期稳定性。此外,其表面活性促进药剂对植物的渗透作用,达到增溶增效的目的。
2.1.3 杀蚜机理
蚜虫的角质层膜由烷烃、蜡脂、脂肪酸和磷脂组成,这些物质具有亲脂性,可和含有亲脂和亲水基团的表面活性剂鼠李糖脂作用。鼠李糖脂破坏了蚜虫的角质层膜,从而起到防止蚜虫的目的。
三、鼠李糖脂表面活性剂在农业中的其他应用
3.1 含鼠李糖脂的有机水溶肥
鼠李糖脂生物表面活性剂毒性低、可生物降解、生物相容性好、起泡性更高、在极端温度、pH、盐浓度下的选择性和专一性更好。因此,近年来,鼠李糖脂生物表面活性剂作为生物有机肥的的生产和使用日益受到人们的广泛关注。有研究结果表明鼠李糖脂能够降低植株叶片的表面张力,使得肥料在叶片表面全面溶解散开、气孔张开。这些改变可以促进叶片对肥的吸收,增强叶片的光合作用,从而促进植株生长。此外,由于鼠李糖脂对蚜虫的杀蚜活性及抑菌防病性,其作为叶面肥使用还可以兼具生物农药的功能,具有促生和杀虫的双重功效,可谓“一举多得”。
鼠李糖脂生物表面活性剂作为有机水溶肥使用,用于提高肥料作用效率表现在:
(1)丰富的营养成分,可为植物生长提供营养
鼠李糖脂生物表面活性剂是以植物油、无机盐、微量元素等为原料,通过微生物代谢产生,产物中含有大量的氮、磷等营养元素,氮、磷等元素是植物生长的必须元素,也是肥料中主要有效成分,通过添加鼠李糖脂生物表活剂,可以减少肥料中对该类元素的添加量,减少生产成本,并且作为一种生物多样物质的混合体,其中的菌体分解的蛋白和核酸等物质亦可被用于激活地层微生物,提高微生物活性,加速植物根系对土壤中营养成分的吸收,促进植物生长。
(2)优良的表面活性,促进肥料的渗透吸收
鼠李糖脂生物表面活性剂可作为润湿剂应用于叶面喷施。将营养物质喷施到叶片表面,通过叶片细胞的外质连丝和气孔被作物吸收。然而自然界中,许多植物叶片都覆有一层蜡质层,使叶片表面成为一种低能表面,鼠李糖脂生物表活剂可作为润湿剂,添加于叶面肥料中,以疏水基通过色散力吸附在蜡质层的表面,亲水基则伸入肥液中形成定向吸附膜取代了疏水的蜡质层,改善肥料在蜡质层的润湿状况,使肥料充分铺展,促进肥料营养物质最大限度的被吸收利用。
(3)螯合微量金属离子,促进植物对微量元素的吸收利用
微量元素是植物正常生长所必需的,其在植物内部的作用有很强的专一性,缺乏微量元素,农作物产量降低,质量下降,严重时可能绝产,因此微量元素是植物肥料中不可缺少的成分,然而对于施与土壤中的肥料,微量元素易散失,有效作用率低的情况经常出现,鼠李糖脂生物表活剂具备将部分微量元素螯合的功能,在弱碱性环境下电离出的羧基可固定根系周围的微量元素,降低微量元素在土壤中快速散失的可能性,保证了肥料的长效性。
3.2含鼠李糖脂种衣剂
鼠李糖脂开发成种子包衣剂涂于种子表面,在种子表皮形成一层糖脂化的复合物颗粒层,进入土壤后能吸附和保持大量的水分,提高种子萌发能力,抵抗干旱的外部环境,促进根部发育,促进营养物质的运输,导致较早的和更好的发芽。幼苗生长较快并带出更大的根源。
3.3含鼠李糖脂的动物饲料
通过将鼠李糖脂混合到饲料中,可以预防或治疗由革兰氏阳性细菌引起的各种动物感染症,包括金黄色葡萄球菌(牛、羊乳腺炎、皮下肿瘤、皮肤炎、败血症等的致病菌)、表皮葡萄球菌、猪链球菌(猪脑膜炎、败血症、心内膜炎、关节炎的致病菌)、牛链球菌(牛鼓胀症的致病菌)等。反刍动物摄取后能改善反刍动物的瘤胃发酵,抑制甲烷生成并促进丙酸生成,促进反刍动物的生长,改进养分吸收、改善肉质,大大减少饲料中抗生素的使用。
含鼠李糖脂的动物饲料可用于鸟类或哺乳类动物的饲料、宠物食品、宠物用营养补充剂等,如犬、猫等宠物、家畜中鸡、猪、牛、羊的饲养。而对生物体及环境安全性高。
参考文献
[1]Guo Y, Hu Y,Gu RR,et a1.Characterization and micellization of rhamnolipidic fractions and crude extracts produced by Pseudomonas aeruginosa mutant MlG-N146[J].Journal of Colloid and Interface Seience,2009,331(2):356-363.
[2]Jarvis FG Johnson MJ.A. glycolipid produced by Pseudomonas aeruginosa[J].Am. Chem. Soc.1949,71:4124-4126.
[3] Manresa JM, Caballol R, Grau A. et al. Association of mixed connective tissue disease and erythema nodosum. Medicina Clinica, 1991,97(19):757.
[4]孙超,郭斐.培养基组成对铜绿假单胞菌NY3产鼠李糖脂性能和结构的影响.环保科技, 2012,18(3): 31-34.
[5] Q Wang, X Fang, B Bai,. et al. Engineering bacteria for production of rhamnolipid as an agent for enhancedoil recovery. Biotechnology & Bioengineering,2007,98(4): 842-854.
[6] P Setoodeh, A Jahanmiri, R Eslamloueyan. et al. Statistical Screening of Medium Components for Recombinant Productionof Pseudomonas aeruginosa, ATCC 9027 Rhamnolipids by Nonpathogenic Cell FactoryPseudomonas putida, KT2440. Molecular Biotechnology,2014,56: 175-191.
[7] L Han, P Liu, Y Peng, J Lin. et al. Engineering the biosynthesis of novel rhamnolipids in Escherichia coli for enhanced oil recovery. Journal ofApplied Microbiology,2014,117(1):139-150.
[8] RS Reis, AG Pereira, BC Neves. et al. Gene regulation of rhamnolipid production in Pseudomonas aeruginosa, - Areview. Bioresource Technology,2011,102(11): 6377-6384.
[9] Champion JT, Gilkey JC, Lamparski H, et a1.Electron microscopy of Rhamnolipid(Biosurfactant) morphology:Effects of pH,cadmium,and octadecane[J].Colloid Interface Sci.1995,170:569-574.
[10]杨道茂,阳永荣等.铜绿假单胞杆菌发酵生产鼠李糖脂的研究[D].浙江大学.2002.
[11] Stanghellini M E,Kim D H,Rasmussen S L,et al. Control of root rot of peppers caused byPhytophthora capsici with a nonionic surfactant[J]. Plant disease,1996,80(10):1113-1116.
[12] SoltaniDashtbozorg S,Miao S,J u L .R hamnolipids as environmentally friendlybiopesticide against plant pathogen Phytophthorasojae[J]. Environmental Progress & SustainableEnergy,2016,35(1):169-173.
[13] Varnier A L,Sanchez L,Vatsa P, et al. Bacterialrhamnolipids are novel MAMPs confer ringresistance to Botrytis cinerea in grapevine[J].Plant,Cell& Environment,2009,32(2):178-193.
[14] Lahkar J,Goswami D,Deka S,et al. Novelapproaches for application of biosurfactantproduced by Pseudomonas aeruginosa,forbiocontrol of Colletotrichum capsici,responsiblefor anthracnose disease in chilli[J]. EuropeanJournal of Plant Pathology,2017:1-15.
[15] Araujo L V D,Guimarães C R,Marquita R LD S,et al. Rhamnolipid and surfactin:Antiadhesion/antibiofilm and antimicrobial effects[J]. Food Control,2016,63:171-178.
[16] Boller T,Felix G. A renaissance of elicitors:perception of microbe-associated molecularpat ter n s a nd d a n ger sig n a l s by pat ternrecognitionreceptors[J]. Annual Review of PlantBiology,2009,60:379-406.
[17]Dodds P N,Rathjen J P. Plant immunity:towardsan integrated view of plant–pathogen interactions[J]. Nature Reviews Genetics,2010,11(8):539-548.
[18]Katagiri F,Tsuda K. Understanding the plantimmune system[J]. Molecular Plant-microbeInteractions,2010,23(12):1531-1536.
[19] Sa nchez L,Courteau x B,Huber t J,et a l.Rhamnolipids Elicit Defense Responses andInduce Disease Resistance against Biotrophic,Hemibiotrophic,and Necrotrophic PathogensThat Require Different Signaling Pathways inArabidopsis and Highlight a Central Role forSalicylic Acid[J]. Plant Physiology,2012,160(3):1630-1641.
[20]Stanghellini M E,Miller R M. Biosurfactants:Their identity and potential efficacy in the
biological control of zoosporic plant pathogens[J]. Plant disease,1997,81(1):4-12.
[21]VatsaP,SanchezL,ClementC,et al.Rhamnolipid Biosurfactants as New Players inAnimal and Plant Defense against Microbes[J].International Journal of Molecular Sciences,2010,11(12):5095-5108.
[22]刘菊. 鼠李糖脂对西瓜枯萎病防治作用的研究[D].杭州:浙江大学,2012.
[23]Klarzynski O,Plesse B,Joubert J M,et al.Linear β-1,3 Glucans Are Elicitors of DefenseResponses in Tobacco[J]. Plant Physiology,2000,124(3):1027-1037.