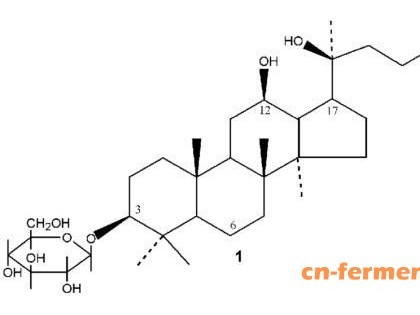
喜树碱是从喜树皮和果实中提取的抗肿瘤植物药,对胃肠道肿瘤和头颈癌等有良好的疗效,但会引发中性粒细胞减少和迟发型腹泻等不良反应。7- 乙基-10 羟基喜树碱(SN-38,1) 属于喜树碱类药物,是已上市药物伊立替康(CPT-11,2) 的活性代谢产物,其抗肿瘤活性是2 的100 ~ 1 000倍,具有作用强、活性高的特点。1 的作用机制是通过稳定拓扑异构酶(Topo) Ⅰ与DNA 形成的复合物而促进细胞凋亡,继而干扰DNA 的复制。
1 虽然具有较强的抗肿瘤活性,但极难溶于水和大部分生物相容性溶剂,与酸不能成盐。此外,1 的内酯环是其抗肿瘤活性的关键部位,但该结构不稳定,对热、光、碱等敏感,在pH 7 或以上时大部分的内酯结构开环变成羧酸盐,抗肿瘤活性显著降低,不良反应增加,极大限制了1 的应用。
脂质体是由磷脂与胆固醇组成的具有双层结构的封闭囊泡,生物相容性优良,作为载体有较大的优势,并具有被动靶向、长效、缓释等优点。本研究采用薄膜水化- 高压均质法制备1 长循环脂质体,拟为开发高效、低毒、长循环的1 新制剂提供帮助。
1 仪器与试剂
Alliance 2695 型高效液相色谱仪;
Nano-ZS90 型粒度测定仪;
ZLXS5003Y 型纯水仪;
Tecnai G2 F20 型透射电镜。
1 原料药;2 注射液;盐酸伊立替康三水合物;5 % 葡萄糖溶液;氢化大豆磷脂、二硬脂酰磷脂酰乙醇胺- 聚乙二醇2000;胆固醇;葡聚糖凝胶Sephadex G-50;乙腈、甲醇为色谱纯,其他试剂均为分析纯。
2 方法与结果
2.1 处方及工艺
采用薄膜水化- 高压均质法制备1 脂质体悬液。称取1 原料药20 mg、HSPC 600 mg、胆固醇200 mg 和DSPE-PEG2000 120 mg,置圆底烧瓶中,加入氯仿∶甲醇(8 ∶ 1)40 ml,超声溶解,于60 ℃减压旋蒸除去有机溶剂成膜。加入2 mmol/L乙酸钠缓冲液(pH 5.0)40 ml,水化形成脂质体初乳,再经微射流高压均质机以137.9 MPa 的压力均质5次,即得澄清透明的1 脂质体悬液。再经0.22 μm微孔滤膜过滤除菌,4 ℃密封保存。
2.2 脂质体的形态及粒度分布
2.2.1 脂质体的形态
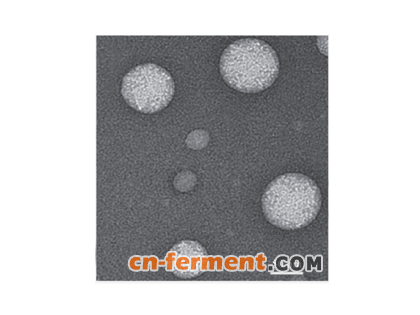
取“2.1”项下制备的1 脂质体悬液,以水适当稀释后用2%磷钨酸负染,滴至专用铜网上,自然挥干,静置使粒子在铜网上沉积,用透射电镜观察其形态。结果在透射电镜下观察到1 脂质体的外观呈球形或椭球形( 图1)。

图1 1 脂质体的透射电镜照片(×3 000)
2.2.2 1 脂质体的粒度分布及ζ 电位测定
取“2.1”项下制备的脂质体悬液,以超纯水稀释后,测定粒径及ζ 电位。结果( 图2) 显示,脂质体的平均粒径为(110±5)nm( n=3),PDI 为0.25±0.05(n=3),表明制备的脂质体粒度分布比较均一;ζ 电位为(-17.6±1)mV(n=3)。
2.3 1 脂质体包封率的测定
2.3.1 色谱条件
色谱柱 Waters XBridge C18 柱(4.6 mm×250 mm,5 μm) ;流动相 乙腈∶水(30 ∶ 70) ;检测波长265 nm;柱温30 ℃;流速1.0 ml/min;进样量20 μl。

图2 1 脂质体的粒度分布(A) 及ζ 电位分布(B)
2.3.2 方法学考察
以甲醇配制1 的系列浓度溶液,分别进样测定。以峰面积(A) 为纵坐标、1 浓度( c) 为横坐标进行线性回归,得到的标准曲线方程为A=65 922.17c-1435.12( r=0.999 9),结果表明1 浓度在0.25 ~10 μg/ml 范围内线性良好。
取同一供试品溶液,按上述色谱条件重复进样测定5 次,记录峰面积,计算得RSD 为0.60%( n=5),表明精密度良好。取同一供试品溶液,按“2.3.1”项下色谱条件在0、2、4、6、8 和12 h 进样测定,计算得RSD 为1.01% (n=6),表明供试品溶液在12 h 内稳定。高、中、低浓度样品的平均加样回收率分别为(102.45±0.33)%、(100.00±0.28)%、(99.78±1.93)% (n=3)。
2.3.3 洗脱曲线的绘制
取充分溶胀( 冷水中浸泡12 h 以上) 的葡聚糖凝胶Sephadex G-50,装填于色谱柱内,制备凝胶柱(45 cm×1 cm),共制备2 根。取1 溶液( 取1 原料药5 mg,加入10 mmol/L 氢氧化钠溶液10 ml 溶解即得) 及“2.1”项下制备的1 脂质体悬液0.5 ml上柱,分别以10 mmol/L 氢氧化钠溶液及25 mmol/L乙酸钠缓冲液(pH 5.0) 洗脱。按每管2 ml 收集洗脱液;碱洗脱液加入盐酸酸化后进样测定,带有乳光的酸洗脱液用甲醇溶解后进样测定。结果显示1脂质体在第7 ~ 14 管流出,游离药物在第20 ~ 44管流出,表明游离药物与脂质体可实现良好的分离( 图3)。

图3 洗脱曲线
2.3.4 柱回收率与柱加样回收率
配制3 种不同浓度的1 溶液,分别取0.5 ml 上柱,将收集的药物组分酸化后,按“2.3.1”项下条件进行色谱分析,计算柱回收率。结果平均值为(96.23±2.33)% (n=3)。另将3 种不同浓度的1溶液与空白脂质体混合,得标准混合液,分别取0.5 ml 上柱, 将收集的药物组分酸化后进样测定, 计算得柱加样回收率, 结果平均值为(101.53±2.63)% (n=3)。
2.3.5 包封率测定
精密量取“2.1”项下1 脂质体悬液0.5 ml 上柱,先以25 mmol/L 乙酸钠缓冲液(pH 5.0) 洗脱至脂质体组分全部流出,再换用10 mmol/L 氢氧化钠溶液洗脱未包封的游离药物。按洗脱曲线收集脂质体组分,移至50 ml 量瓶中,用甲醇定容,摇匀后精密量取5 ml 置10 ml 量瓶,再用甲醇定容,用于测定脂质体中包载的药量W。另取脂质体悬液0.5 ml 置50 ml 量瓶中,同法操作,测得脂质体悬液中的总药量W0。按“2.3.1”项下色谱条件分别进样测定,计算得1 脂质体的包封率为(93±3)% (n=3)。
2.4 脂质体体外释放测定精密量
取“2.1” 项下1 脂质体悬液和1 溶液1 ml,分别置经预处理的透析袋( 截留分子量10 000) 中,将袋口扎紧,置释放介质[1%十二烷基硫酸钠(SDS) 的0.01 mol/L 磷酸盐缓冲液(PBS,pH 7.4)]20 ml 中,于(37±5)℃恒温振荡,转速为100 r/min。分别于2、4、6、12、24、30、36、48、60、72、78 和84 h 取出全部释放介质( 及时更换同温等量释放介质)。取不同时间点的释放外液1.5 ml,加入10 mol/L 盐酸20 μl 酸化后按“2.3.1”项下条件测定,计算累积释放率(Q)。结果表明,1 溶液在36 h 时的释药量可达90.2%,而1 脂质体在84 h 时的累积释放率为55.6%,表明1 脂质体具有一定的长循环和缓释效果( 图4)。

图4 1 脂质体的体外释放曲线(n=3)
2.5 药效学试验
2.5.1 动物模型的建立
将人胰腺癌AsPC-1 细胞株以每只5×106 个的密度接种至裸鼠右侧腋窝皮下。用游标卡尺测量肿瘤直径,待肿瘤生长至体积约为300 mm3,取出肿瘤组织剪切成约1.5 mm3 的瘤块,在无菌条件下接种于健康裸鼠右侧腋窝皮下,待肿瘤生长至平均体积为140 ~ 150 mm3,分组给药。
2.5.2 试验用药
2 注射液:取盐酸伊立替康三水合物2.17 g( 相当于含2 2 g)、山梨醇4.5 g、乳酸90 mg,加入适量灭菌注射用水,超声溶解,用1 mol/L 氢氧化钠溶液调至pH 3.5,加灭菌注射用水至200 ml,经0.22 μm 滤膜无菌过滤,按每瓶10 ml 分装。临用前以5%葡萄糖溶液稀释到给药浓度。
1 脂质体注射液:取“2.1”项下制备的脂质体悬液,临用前以5%葡萄糖溶液稀释至给药浓度。
2.5.3 试验分组与给药
将18 只荷瘤裸鼠随机分为3 组,分别为试验组(1脂质体,5 mg/kg)、阳性对照组(2 注射液,10 mg/kg)、对照组(5%葡萄糖溶液)。以上3 组试验动物均每周尾静脉注射给药3 次( 间隔1 d),连续给药3 周,给药体积均为0.2 ml。
2.5.4 药效评价指标
试验中观察裸鼠的一般生理情况及移植瘤体积增长情况。每周2 次称量裸鼠体质量并记录,同时测量移植瘤长径(a) 和短径(b),按公式计算肿瘤体积V(V=0.5×a×b2)。最后一次给药24 h 后处死动物,剥离肿瘤并称重。以相对肿瘤体积(relative tumor volume,RTV)、体积抑瘤率(voluminhibition rate,VIR)、瘤重抑制率(weigh inhibitionrate,WIR) 为指标进行药效学评价。计算公式如下。RTV=Vt / V0VIR=RTV对照/ RTV给药×100%WIR= (W对照-W给药)/W给药×100%式中,V0 为分组给药时测量所得的肿瘤体积,Vt 为每次测量时的肿瘤体积;W 为瘤重。
2.5.5 结果与讨论
给药时的裸鼠已处于成熟期,此阶段的健康裸鼠体质量会维持在20 g 左右。若给予荷瘤裸鼠的药物毒性大,会使裸鼠的体质量下降;若裸鼠的体质量无明显下降,则提示给予的药物无明显毒性。本试验中,给药组裸鼠的体质量无明显变化,表明1脂质体对裸鼠生长无明显的毒性( 图5)。

图5 荷瘤裸鼠的体质量(n=6)
1 脂质体组对人胰腺癌AsPC-1 裸鼠皮下移植瘤的生长抑制作用与2 注射液相当( 图6),提示1脂质体(5 mg/kg) 与2 注射液(10 mg/kg) 效用相当。


图6 各试验组的相对肿瘤体积(A)、体积抑瘤率(B) 和瘤重抑制率(C)(n=6)
讨论
1 是伊立替康的活性代谢产物,水溶性和脂溶性均较差,本试验采用薄膜水化- 高压均质法制备脂质体,操作简便快速,制得的脂质体粒径均一、包封率高,具备开发前景。DSPE-PEG2000 的加入可以降低网状内皮细胞对于脂质体的摄取,延长药物体内循环的时间;并可使脂质体荷负电,增加脂质体的物理稳定性。由于目前无1 的上市制剂,所以药效学试验中采用2 注射液为阳性对照。理论上,1 应分布在脂质体的双分子层中,可减少其内酯环的开环,有利于提高药效。因此在设计给药剂量时,1 脂质体为5 mg/kg,而2 注射液为10 mg/kg。本试验表明,试验组和阳性对照组对荷瘤裸鼠的肿瘤抑制效果相似,提示1 脂质体的药效较高,具有一定的临床优势。
1 脂质的体外释放采用动态透析法测定。由于1 在PBS 中溶解度较小,为达漏槽条件,在PBS中加入1% SDS。1 脂质体在84 h 累积释放率为55.6%,可能是因为HSPC 的相变温度为53 ℃,在37 ℃的释放条件下该脂质体较稳定,为药物在体内的长循环释放提供了可能。
采用制剂手段将1 制备成脂质体弥补了其自身的生物药剂学缺陷,避免了体内开环失活。相较于自制的2 注射液既提高了生物安全性又增强了疗效,因此1 脂质体剂型具有开发前景。[1]