吡咯喹啉醌(Pyrroloquinoline quinone,PQQ)为红褐色的具有强氧化还原活性的芳香三环邻位醌类化合物,是继黄素核苷酸(FMN/FAD)和吡啶核苷酸(NAD/NADP)之后发现的第3种氧化还原酶辅因子[1-2]。PQQ虽然是作为细菌脱氢酶辅因子被发现,但是广泛存在于植物、动物和人体组织器官中,人乳中PQQ含量高达140–180 μg/L[3]。真核细胞中,PQQ作为受体协同辅酶Q10完成呼吸链的电子传递,提供生物生长所需的生物能,具有促进机体生长、线粒体增殖、神经生长因子合成和清除胞内自由基等功能,在食品、医药及化妆品领域具有重要的应用价值[4-6]。需要指出的是,PQQ虽然是动物正常生长发育和繁殖的必需因子,但是哺乳动物自身不能合成,只能从外界摄取[7-8]。
PQQ的生产方法主要是化学合成法和微生物发酵法,化学法合成步骤繁杂、纯化成本高昂,微生物发酵法成为PQQ产业化的发展方向[9]。截止2019年9月,6家向美国FDA申请PQQNa2进行GRAS注册的企业中,只有诸城市浩天药业有限公司采用的是化学合成法。目前,PQQ的生物合成途径已经解析清楚,不同于辅酶Q10等其他常见的从头合成辅因子,PQQ是一种仅需通过5–6步酶促反应催化合成的翻译后蛋白修饰产物[10]。然而PQQ的调控机制仍未阐明且遗传操作体系不成熟,通过理性设计手段改造大幅度提高甲基营养菌的PQQ产量相对比较困难,传统育种方案仍然是主要手段[11-15]。因此,低成本、高通量的高产PQQ突变株的筛选方案,对实现优良菌株大规模选育是迫切需要的。
迄今为止,能够合成PQQ的生物主要是细菌,其中又以革兰氏阴性细菌为主[16]。不同细菌PQQ的合成量差异显著,有些细菌只能合成微量的PQQ以满足自身的代谢需求,如微环菌属、假单胞菌属和枝动杆菌属等;有的细菌却能产生过量的PQQ,如生丝微菌属、嗜甲基菌属和交替假单胞菌属等,其中甲基营养型细菌的PQQ合成水平最高[17-18]。甲基营养菌是一类以甲醇等C1化合物为唯一碳源和能量进行生长的革兰氏阴性菌,PQQ随菌体生长在细胞质中合成,然后转运至细胞间质与脱氢酶结合氧化碳源为细胞生长提供碳骨架[19]。然而,PQQ与脱氢酶是通过Ca2+或Mg2+介导的配位键相连,结合力较弱,转运过程中容易游离至胞外,PQQ大量合成[20-21]。根据美国FDA公布的GRAS文件,日本Mitsubishi Gas和海正药业等5家微生物发酵法生产PQQ的企业均是以Hyphomicrobium denitrificans作为生产菌株。传统的诱变育种存在正突变率低、遗传稳定性差等问题,适应性驯化能够在较短的时间内有效地改善菌株的目标表型和生理特征,而不影响除目的性状以外的其他优良性状[22]。本研究以H. denitrificans FJNU-6为研究对象,根据生丝微菌能在纯无机盐培养基中以甲醇为唯一碳源和能量来源进行生长的生理特性,设计出甲醇为拮抗因子进行实验室定向驯化,建立光谱法快速筛选方法,选育获得PQQ高产突变株。最后,对突变株进行了5 L发酵罐培养,相较出发菌株,不仅甲醇消耗速率和PQQ产量提高,而且单位细胞的PQQ产量提高超过142.2%,展示出其工业应用潜力。
1 材料与方法1.1 材料1.1.1 菌种脱氮生丝微菌H. denitrificans FJNU-6为本课题组从福建省泉州市惠安湄洲湾南岸海域沉积物中筛选获得[23]。
1.1.2 培养基筛选培养基(g/L):(NH4)2SO4 3,KH2PO4 2,Na2HPO4·12H2O 3,MgSO4·7H2O 1,CaCl2·2H2O 0.5,FeSO4·7H2O 0.1,pH 6.8;固体培养基添加2%的琼脂粉。
发酵培养基:甲醇25 g/L,(NH4)2SO4 2 g/L,Na2HPO4·12H2O 5 g/L,MgSO4·7H2O 1 g/L,KH2PO4 1.4 g/L,微量元素液1 mL/L,维生素辅液2 mL/L,pH 6.8。
微量元素液[24](mg/L):FeSO4·7H2O 80,ZnSO4·7H2O 22.5,MnSO4·4H2O 40,CuSO4·5H2O 5,NaCl 15,(NH4)6Mo7O24·4H2O 0.3,KI 0.3,CoCl2·6H2O 0.03,H3BO3 3,CaCl2·2H2O 300。
维生素辅液[17](g/L):核黄素0.2,吡哆素0.4,硫胺素0.4,泛酸钙0.4,烟酸0.4,对氨基苯甲酸0.2,生物素0.02,叶酸0.02,肌醇2。
1.1.3 引物表 1为本研究使用的引物,均采用AlleleID 6.0软件设计。
| Primer name | Primer sequence (5′–3′) | Size (bp) |
| recA-F | AGGTCGTCAAGAACAAGG | 18 |
| recA-R | CGTTATAGGACATCCAAGC | 19 |
| gapdh-F | CGACTTCAACCACGATGC | 18 |
| gapdh-R | TCATACCAGGCGAGAACG | 18 |
| pqqA-F | ATGGAAAGCAGTTACCG | 17 |
| pqqA-R | TCAGATGAGGTTGATCTCAG | 20 |
| pqqB-F | ATCGTAAAGCCAGCAAGTC | 19 |
| pqqB-R | ATCATCTCGCCGTCTTCG | 18 |
| pqqC-F | AAGGACGCAGCACTCATC | 18 |
| pqqC-R | TCATCAGGAAGCAGACCATC | 20 |
| pqqD-F | GCGACGAGTGTTGAGGAAATC | 21 |
| pqqD-R | TGTCAGCGAGGATCTCTTGC | 20 |
| pqqE-F | TCGGCATTCTCCAAATCC | 18 |
| pqqE-R | GATGAGGTTCGTGTAGAGG | 19 |
| moxFα-F | ATCGGGATGCGTCAGAAG | 18 |
| moxFα-R | CAAGATGAAGTTCGGCTACC | 20 |
| moxFβ-F | CCTTGCGAGACTCAACCTG | 19 |
| moxFβ-R | CAACTGCTGGGAACCGAAG | 19 |
取培养至对数中期的培养液8 000×g离心5 min,弃上清,用等体积的无菌生理盐水混匀洗涤2次,然后转移至放有搅拌子的培养皿中,置于预热30 min紫外灯(功率15 W)下30 cm处的磁力搅拌器上(50 r/min)照射40 s,8 000×g离心5 min,弃上清。
1.2.2 NTG诱变取培养至对数中期的培养液8 000×g离心5 min,弃上清,用等体积的无菌生理盐水混匀洗涤2次,然后加入5 g/L NTG母液至终浓度1.1 g/L,30 ℃、150 r/min避光培养60 min。8 000×g离心5 min,取菌体,用等体积的PBS缓冲液(pH 7.0)重悬,重复1遍。
1.2.3 实验室适应性驯化按照UV和NTG诱变方法间隔处理培养至对数生长期的菌体,每次处理后的菌悬液转移至等体积的筛选发酵培养基中,30 ℃、220 r/min避光培养。初始甲醇浓度为2%,每轮驯化后浓度增加1%;初始培养时间为5 d,每轮驯化后增加1 d。
1.3 PQQ高产菌株的高通量筛选1.3.1 高产突变株的快速筛选按照驯化流程进行10轮适应性驯化,每轮驯化后取培养液测定菌浓、甲醇残留浓度和PQQ含量,并进行梯度稀释涂布于含有4%甲醇的固体筛选培养基平板上培养7 d。挑取平板上的单菌落转接于装有1 mL发酵培养基的白色96深孔板中,30 ℃、500 r/min振荡培养5 d。8 000×g离心5 min,吸取上清至透明96孔板中,通过光谱法测定上清液中的PQQ含量。
1.3.2 摇瓶培养复筛将快速筛选获得的产量较高菌株转接至装有30 mL发酵培养基的250 mL挡板瓶中,30 ℃、220 r/min振荡培养6 d。8 000×g离心5 min,吸取上清,利用HPLC法精确测定培养液中的PQQ含量[20]。
1.3.3 遗传稳定分析将复筛获得的高产突变株在发酵培养基平板上划线连续传代9次,每代次随机挑取5个单菌落进行摇瓶培养,测定其PQQ产量,验证菌株的遗传稳定性。
1.4 分批发酵验证高产菌株产PQQ性能采用二级培养模式分批培养出发株FJNU-6和突变株FJNU-R8,按10% (V/V)接种量,将种子液接入初始装有3 L发酵培养基的玻璃罐,30 ℃培养143 h。初始甲醇浓度为5 g/L,然后控制在0.5 g/L左右;通气量:2.4–3 L/min;罐压:0.05 MPa;pH:对数生长期前6.2–6.5,之后调节为7.0;搅拌转数关联溶氧,控制在40%。
1.5 pqq和moxF基因簇表达差异分析将出发菌株FJNU-6和突变株FJNU-R8分别在含有2%、4%、6%、8%、10%和12%甲醇的培养基中培养60 h,离心收集菌体。采用NcleoSpin RNA试剂盒提取总RNA,反转录获得cDNA。以获得的cDNA为模板,进行荧光定量PCR分析pqq和moxF基因簇的表达差异。采用LightCycler® 96 SW 1.1软件,以recA和gapdh为内参基因。基因表达差异分析通过2–ΔΔCt算法进行计算。
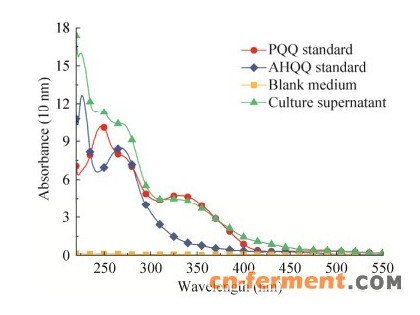
2 结果与分析2.1 PQQ高产菌快速筛选方法的建立PQQ是以pqqA编码的含有谷氨酸和酪氨酸残基多肽链PqqA为前体,经PqqB、PqqE和PqqD等酶的缩合、氧化和异构形成中间产物AHQQ,然后在PqqC的作用下通过3分子O2参与进行8个电子的氧化及环化形成PQQ。因此,AHQQ是摇瓶培养过程中最主要的代谢副产物[15, 25]。全波谱扫描表明,筛选培养基没有任何明显的吸收峰,AHQQ在275 nm处有较强的吸收峰,FJNU-6培养液上清含有AHQQ和蛋白质多肽等代谢副产物,但仍具有254 nm和330 nm两个PQQ特征吸收峰(图 1)。光谱法是一种精密度较高的PQQ发酵液快速检测方法,其准确度受培养基组分干扰[26]。分别用HPLC法和光谱法(OD254与OD330)测定FJNU-6培养过程中PQQ含量的变化,培养液中的PQQ含量与254 nm和330 nm处的吸光值呈正相关,且相关系数均高于R2 > 0.999。培养液在330 nm处的吸光值受培养过程中产生的中间代谢产物影响较小,且组内和组间精度偏差均小于2%。因此,选择330 nm作为酶标仪的筛选波长(CPQQ=35.40×OD330+0.844 4,R2=0.999 5)。
 |
| 图 1 FJNU-6培养液上清的全波谱扫描曲线Fig. 1 The full-spectrum scanning curve of culture supernatant from H. denitrificans FJNU-6. |
|
图选项
|
按照驯化过程进行10轮定向驯化,菌株长势良好,菌体浓度逐步提高,甲醇残余浓度均低于0.8 g/L (图 2A)。当初始甲醇浓度超过6%,菌体生长加快,每轮菌液的OD650增加幅度均大于1.1,残余甲醇浓度低于0.4 g/L;初始甲醇浓度只有低于8%时,驯化液中PQQ的含量才随甲醇浓度增加而提高。单位细胞PQQ产率(图 2B)分析表明,随着驯化甲醇浓度的提高,单位细胞的胞内PQQ含量逐步提高;当甲醇浓度超过5%,胞内PQQ含量超过0.2 mg/g DCW,单位细胞的PQQ分泌量开始迅速减少。过高浓度的甲醇不但降低了PQQ的合成量,也抑制了PQQ的分泌。因此,甲醇驯化浓度确定为6%、7%、8%和9%。
 |
| 图 2 驯化中OD650、PQQ含量和甲醇浓度的变化Fig. 2 The content of methanol and PQQ, OD650 in the process of domestication. |
|
图选项
|
将经过5、6、7和8轮驯化的菌液稀释涂布于4%甲醇平板,各挑取100个单菌落进行快速筛选,结果如图 3所示。从图中可以看出,随着驯化轮次的增加,突变株的PQQ平均含量和最高产量也呈现出先升后降的现象,进一步表明驯化过程中甲醇的浓度并非越高越好,高甲醇浓度的确会降低PQQ的产量。
 |
| 图 3 不同驯化浓度的菌株筛选结果Fig. 3 Screening results of mutant strain under different methanol concentration. |
|
图选项
|
4轮驯化结果统计分析(表 2)表明,适应性驯化是一个正突变株富集过程,菌株的正突变率从80%提高到98%。随着驯化的进行,菌株出现了钝化现象,产量差异越来越小。
| Methanol concentration (%) | Positive mutation rate (%) | Maximum yield (mg/L) | Minimum yield (mg/L) |
| 6 | 80 | 53.85 | 16.09 |
| 7 | 91 | 68.74 | 18.21 |
| 8 | 94 | 65.31 | 20.27 |
| 9 | 98 | 55.56 | 18.66 |
挑取5株产量最高的突变株分别在2%的甲醇平板上连续划线传代9次,每次挑取单菌落进行摇瓶验证PQQ产量(图 4)。结果发现,经过8轮驯化以后筛选获得的突变株具有较高的稳定性,传代培养的PQQ产量差异在6%之内波动。突变株FJNU-R8的PQQ产量最高,9轮传代培养的PQQ含量在65 mg/L上下波动。因此选择突变株FJNU-R8进行分批发酵验证。
 |
| 图 4 突变株的遗传稳定性Fig. 4 Genetic stability of mutant strains. |
|
图选项
|
采用二级发酵培养FJNU-6和FJNU-R8 (图 5)。从图中看出,甲醇作为唯一碳源和能量来源而迅速被消耗,菌体快速进入对数生长期,出发菌株FJNU-6的甲醇消耗较快,31 h初始甲醇仅剩0.13 g/L,而突变菌株在39 h初始甲醇还剩0.10 g/L。下罐(143 h)时,出发菌株FJNU-6的生物量45.41 g/L,比生长速率最大为0.19 h–1;突变株FJNU-R8的生物量41.83 g/L,比生长速率最大只有0.16 h–1,略低于出发菌株。PQQ主要在对数生长期中后期和稳定期合成,与菌体生长不完全同步。下罐(143 h)时,出发菌株FJNU-6的PQQ产量为487.6 mg/L,比合成速率最大为4.22×10–4 h–1,单位细胞产量为10.74 mg/g DCW;突变株FJNU-R8的PQQ产量达到1 087 mg/L,比合成速率最高达到了5.44×10–4 h–1,单位细胞产量达到26.01 mg/g DCW,是出发菌株的1.42倍。
 |
| 图 5 H. denitrificans出发株FJNU-6 (A)和突变株FJNU-R8 (B)的分批补料培养曲线Fig. 5 The culture curves of H. denitrificans FJNU-6 (A) and FJNU-R8 (B). |
|
图选项
|
针对突变株FJNU-R8甲醇消耗和PQQ合成速率的变化,进一步通过荧光定量PCR分析在不同甲醇浓度中pqq基因簇(分别编码多肽PqqA、羟化酶PqqB、氧化酶PqqC、分子伴侣PqqD和SAM自由基酶PqqE)和moxF基因簇(编码甲醇脱氢酶的α和β亚基)的表达差异情况(图 6)。从图中可以看出,出发菌株FJNU-6和突变株FJNU-R8的moxF和pqq基因簇表达随甲醇浓度的提高均呈现出先升后降的趋势,与驯化过程中甲醇残余浓度和PQQ含量变化趋势相一致。然而,突变株moxF和pqq基因簇的表达量随甲醇浓度提高而变化的趋势变缓,从基因水平上证实了突变株对甲醇的刺激出现了钝化。
 |
| 图 6 不同甲醇浓度下pqq和moxF基因簇的表达Fig. 6 Gene expression of moxF and pqq gene cluster under different methanol. |
|
图选项
|
利用高浓度的甲醇进行拮抗驯化FJNU-6,细胞应激合成大量的甲醇脱氢酶和辅酶PQQ,以加快甲醇的氧化消耗,moxF和pqq基因簇的表达量随之提高。当甲醇浓度超过5%时,单位细胞的PQQ产量却迅速降低(图 2B)。因此,moxF和pqq基因簇表达随甲醇浓度的提高呈现出先升后降的现象。从图 6中可以看出,突变株FJNU-R8的pqq基因簇中各基因的表达量均高于相应浓度下出发株的表达量,而moxF基因簇的表达量在6%以后就低于出发菌株。由此可以看出,PQQ分泌量与pqq基因簇表达量成正相关。
3 讨论PQQ属于翻译后蛋白修饰产物,其生物合成途径虽然已经解释清楚,但是其调控机制尚未阐明,通过基因工程等理性设计手段过表达一个或几个pqq基因获得PQQ高产菌株相对比较困难。Tina等[11]在氧化葡萄糖酸杆菌Gluconobacter oxydans 621H中过表达pqq基因簇,PQQ产量从0.04 mg/L提高至1.49 mg/L。因此,诱变育种还是高产PQQ甲基营养菌的主要选育方法(表 3)。李慧芝等[27]和李红月等[28]通过ARTP技术对扭脱甲基杆菌M. extorquens进行诱变,利用微生物筛选系统或流式细胞仪最终获得的突变株E-F3和1-C6在3 L发酵罐的产量只有54 mg/L (168 h)和208.7 mg/L (228 h),产量及产率均未达到PQQ工业化生产的要求。目前,PQQ工业化生产的菌株均来源于生丝微菌属Hyphomicrobium。Teizi等[17]在30 L发酵罐中培养Hyphomicrobium sp. TK0441 10 d,PQQ产量达到1 000 mg/L。郑玲辉等[29]对Hyphomicrobium sp. 1112-NTG-1953 (TK0415的UV诱变菌)进行NTG诱变,高产突变株1112-NTG-2318在80 T发酵罐中培养240 h,PQQ产量高达1 783 mg/L。然而,上述高产PQQ的甲基营养菌选育均采用物理或者化学诱变,存在正突变率低、筛选工作量大和耗时长等问题且需要借助昂贵的流式细胞仪等精密仪器。
| Strain | Positive mutation rate (%) | Titer (mg/L) | Increase rate (%) | Reference |
| H. denitrificans FJNU-R8 | 94.00 | 1 087 (5 L fermenter) | 159.70 | This work |
| Hyphomicrobium sp. 1112-0-36 | 0.27 | 1 783 (80 T fermenter) | – | [29] |
| M. extorquens 1-C6 | 3.04 | 208.7 (3 L Fermenter) | 98.02 | [28] |
| M. extorquens E-F3 | 31.60 | 54.00 (3 L Fermenter) | 142.30 | [27] |
本研究所采用的出发菌株H. denitrificans FJNU-6在摇瓶中培养88 h,PQQ产量可以达到121.4 mg/L,是一株极具工业化应用前景的PQQ产生菌株[23]。根据PQQ的特征吸收光谱以及采用无机盐培养基筛选的特点,建立光谱法结合液相色谱法快速筛选PQQ高产突变株的定量方法,提高了菌株的筛选效率。通过设计的甲醇拮抗驯化方案,大大提高了正突变株的比例,缩短了突变株的筛选时间,6轮驯化后的正突变率达到80%以上。本方案不仅能快速筛选出高产PQQ突变株,也能筛选出PQQ低产突变株,能够为PQQ生物合成调控研究提供具有对比意义的资源库,有助于加深PQQ合成机制的了解。利用本筛选方案,成功地筛选出系列高产PQQ的突变株,并对其中表现最好的突变株(FJNU-R8)进行5 L发酵罐扩大培养,发现该突变株的单位细胞产率、甲醇转化得率和PQQ产量均优于出发菌株,表现出更好的工业应用潜力。本文在选育过程中发现PQQ合成和甲醇脱氢酶的合成是一个相互协调的过程,一定浓度的甲醇能够刺激PQQ和甲醇脱氢酶的同步增加合成,过高浓度的甲醇反而会增强甲醇脱氢酶与PQQ的结合能力,造成PQQ产量的急剧减少。实时荧光定量PCR检测显示,高浓度的甲醇能够提高pqq和moxF基因簇的表达,大幅度提高PQQ产量。因此,通过适应性驯化结合光谱法能够简单快速地构建出高正突变率的突变库,并从中迅速获得高产突变株,而不需要流式细胞仪、微生物药物筛选系统等昂贵的仪器设备。本文提供了一种新的快速筛选高产PQQ甲基营养菌的方法,为获得适用于工业化生产所需的高产菌奠定了基础。
| [1] |
Anthony C, Zatman LJ. The microbial oxidation of methanol. Purification and properties of the alcohol dehydrogenase of Pseudomonas sp. M27. Biochem J, 1967, 104(3): 953-959.
|
| [2] |
Hauge JG. Purification and properties of glucose dehydrogenase and cytochrome b from Bacterium anitratum. Biochim Biophys Acta, 1960, 45: 250-262. DOI:10.1016/0006-3002(60)91449-9
|
| [3] |
Felton LM, Anthony C. Role of PQQ as a mammalian enzyme cofactor. Nature, 2005, 433(7021): E10. DOI:10.1038/433010a
|
| [4] |
Misra HS, Rajpurohit YS, Khairnar NP. Pyrroloquinoline-quinone and its versatile roles in biological processes. J Biosci, 2012, 37(2): 313-325. DOI:10.1007/s12038-012-9195-5
|
| [5] |
Rucker R, Chowanadisai W, Nakano M. Potential physiological importance of pyrroloquinoline quinone. Altern Med Rev, 2009, 14(3): 268-277.
|
| [6] |
Akagawa M, Nakano M, Ikemoto K. Recent progress in studies on the health benefits of pyrroloquinoline quinone. Biosci Biotechnol Biochem, 2016, 80(1): 13-22. DOI:10.1080/09168451.2015.1062715
|
| [7] |
Rucker R, Storms D, Sheets A, et al. Is pyrroloquinoline quinone a vitamin?. Nature, 2005, 433(7025): 10-10.
|
| [8] |
Bishop A, Gallop PM, Karnovsky ML. Pyrroloquinoline quinone: a novel vitamin?. Nutr Rev, 1998, 56(10): 287-293.
|
| [9] |
Li HY, Zeng WZ, Zhou JW. High-throughput screening of Methylobacterium extorquens for high production of pyrroloquinoline quinone. Chin J Biotech, 2018, 34(5): 794-802 (in Chinese).
李红月, 曾伟主, 周景文. 高产吡咯喹啉醌扭脱甲基杆菌的高通量选育. 生物工程学报, 2018, 34(5): 794-802. |
| [10] |
Ravikiran B, Mahalakshmi R. Unusual post-translational protein modifications: the benefits of sophistication. RSC Adv, 2014, 4(64): 33958-33974. DOI:10.1039/C4RA04694C
|
| [11] |
Koehn EM, Latham JA, Armand T, et al. Discovery of hydroxylase activity for PqqB provides a missing link in the pyrroloquinoline quinone biosynthetic pathway. J Am Chem Soc, 2019, 141(10): 4398-4405. DOI:10.1021/jacs.8b13453
|
| [12] |
Ikemoto K, Mori S, Mukai K. Synthesis and crystal structure of pyrroloquinoline quinol (PQQH2) and pyrroloquinoline quinone (PQQ). Acta Crystallogr Sect B, 2017, 73(3): 489-497. DOI:10.1107/S2052520617002281
|
| [13] |
Wecksler SR, Stoll S, Iavarone AT, et al. Interaction of PqqE and PqqD in the pyrroloquinoline quinone (PQQ) biosynthetic pathway links PqqD to the radical SAM superfamily. Chem Commun, 2010, 46(37): 7031-7033. DOI:10.1039/c0cc00968g
|
| [14] |
Magnusson OT, Toyama H, Saeki M, et al. The structure of a biosynthetic intermediate of pyrroloquinoline quinone (PQQ) and elucidation of the final step of PQQ biosynthesis. J Am Chem Soc, 2004, 126(17): 5342-5343. DOI:10.1021/ja0493852
|
| [15] |
Magnusson OT, Toyama H, Saeki M, et al. Quinone biogenesis: structure and mechanism of PqqC, the final catalyst in the production of pyrroloquinoline quinone. Proc Natl Acad Sci USA, 2004, 101(21): 7913-7918. DOI:10.1073/pnas.0402640101
|
| [16] |
Shen YQ, Bonnot F, Imsand EM, et al. Distribution and properties of the genes encoding the biosynthesis of the bacterial cofactor, pyrroloquinoline quinone. Biochemistry, 2012, 51(11): 2265-2275. DOI:10.1021/bi201763d
|
| [17] |
Urakami T, Yashima K, Kobayashi H, et al. Production of pyrroloquinoline quinone by using methanol-utilizing bacteria. Appl Environ Microbiol, 1992, 58(12): 3970-3976. DOI:10.1128/AEM.58.12.3970-3976.1992
|
| [18] |
Ge X, Zhang WC, Xiong XH, et al. Method for producing pyrroloquinoline quinine through microbial fermentation and fermentation medium used in same: CN, 103224965B. 2013-03-27 (in Chinese).
葛欣, 张惟材, 熊向华, 等.一种微生物发酵生产吡咯喹啉醌的方法及所用的发酵培养基: 中国, 103224965B. 2013-03-27. |
| [19] |
Puehringer S, Metlitzky M, Schwarzenbacher R. The pyrroloquinoline quinone biosynthesis pathway revisited: a structural approach. BMC Biochem, 2008, 9: 8. DOI:10.1186/1471-2091-9-8
|
| [20] |
Yang YX, Xiong XH, You S, et al. Comparing three kinds of pyrroloquinoline quinone detection methods. Lett Biotechnol, 2011, 22(4): 544-547 (in Chinese).
杨延新, 熊向华, 游松, 等. 3种检测吡咯喹啉醌的方法比较. 生物技术通讯, 2011, 22(4): 544-547. DOI:10.3969/j.issn.1009-0002.2011.04.021 |
| [21] |
Masaki N, Daisuke H, Yamaguchi K, et al. Preparation and characterization of Ca2+-free methanol dehydrogenase from Hyphomicrobium denitrificans A3151. Chem Lett, 2005, 34(7): 1036-1037. DOI:10.1246/cl.2005.1036
|
| [22] |
Yang CC, Ye LD, Gu JL, et al. Directed evolution of mandelate racemase by a novel high-throughput screening method. Appl Microbiol Biotechnol, 2017, 101(3): 1063-1072. DOI:10.1007/s00253-016-7790-3
|
| [23] |
Yang SY, Chen J, Ke CR, et al. Screening and fermentation optimization for a pyrroloquinoline quinone producing strain. Pharm Biotechnol, 2014, 21(5): 429-432 (in Chinese).
杨诗颖, 陈佳, 柯崇榕, 等. 吡咯喹啉醌产生菌的筛选及其培养基优化. 药物生物技术, 2014, 21(5): 429-432. |
| [24] |
Stoddard SF. Bacterial strains for the production of pyrroloquinoline quinone: US, 6511820B1, 2000-11-28.
|
| [25] |
Bonnot F, Iavarone AT, Klinman JP. Multistep, eight-electron oxidation catalyzed by the cofactorless oxidase, PqqC: identification of chemical intermediates and their dependence on molecular oxygen. Biochemistry, 2013, 52(27): 4667-4675. DOI:10.1021/bi4003315
|
| [26] |
Nojiri M, Hira D, Yamaguchi K, et al. Crystal structures of cytochrome cL and methanol dehydrogenase from Hyphomicrobium denitrificans: structural and mechanistic insights into interactions between the two proteins. Biochemistry, 2006, 45(11): 3481-3492. DOI:10.1021/bi051877j
|
| [27] |
Li HZ, Kang Z, Li JH, et al. Mutagenesis of Methylobacterium extorquens AM1 for increasing pyrroloquinoline quinone production by atmospheric and room temperature plasma. Chin J Biotech, 2016, 32(8): 1145-1149 (in Chinese).
李慧芝, 康振, 李江华, 等. 常压室温等离子体诱变扭脱甲基杆菌AM1高产吡咯喹啉醌. 生物工程学报, 2016, 32(8): 1145-1149. |
| [28] |
Li HY. Directive breeding fermentation optimization of Methylobacterium extorquens for high pyrroloquinoline quinine production[D]. Wuxi: Jiangnan University, 2018.
李红月.高产吡咯喹啉醌扭脱甲基杆菌的定向选育与发酵优化[D].无锡: 江南大学, 2018. http://cdmd.cnki.com.cn/Article/CDMD-10295-1018251898.htm |
| [29] |
Zheng LH, Du MN, Zhu XR, et al. Hyphomicrobium sp. strain and preparation method for pyrroloquinoline quinone: CN, 106282044A. 2015-05-20 (in Chinese).
郑玲辉, 杜敏娜, 朱小容, 等.一种生丝微菌和吡咯喹啉醌的制备方法: 中国, 106282044A. 2015-05-20. |