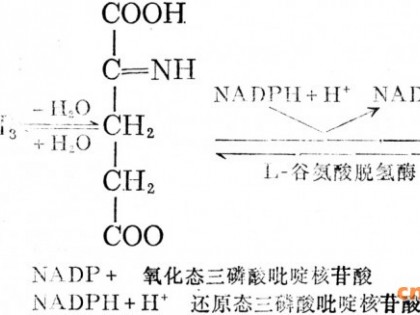
α-氨基-β-羟基丁酸因具有与苏糖类似的结构而被命名为苏氨酸。L-苏氨酸属于8种必需氨基酸之一,但人和动物自身无法合成,必须依靠外部供应。1935年,L-苏氨酸被首次从纤维蛋白水解物中分离并鉴定[1]。苏氨酸是一种重要的营养强化剂,可以增加谷类和乳制品等的营养,缓解人体疲劳,促进生长发育。在医学上,由于苏氨酸结构中具有羟基,所以它具有亲水和保水作用并能保持人体皮肤水分;其制剂具有促进人体内抗脂肪肝发展的药效,是复方氨基酸输液的组成部分;同时,苏氨酸是生产最有效和低过敏性的抗生素——单环菌素的最重要原料[2]。因此,苏氨酸主要用于食品保健品、制药、化学试剂和畜牧饲料添加剂等[3]。
苏氨酸的生产方法主要包括蛋白质水解、化学合成和微生物发酵。目前微生物发酵法已成为苏氨酸生产的主流方法[4]。长期以来,由于畜牧业、食品、医药、保健品和化妆品等领域的发展,国内外市场对苏氨酸的需求量持续快速增长,成为除赖氨酸、蛋氨酸以外发展最快的第三大氨基酸。结合上述特点,国内外对L-苏氨酸的需求促进了L-苏氨酸的大规模生产。但国内微生物发酵法生产L-苏氨酸的研究起步较晚,最早的报道见于20世纪80年代。在菌种选育、基因工程菌构建及发酵条件优化等方面与日本等发达国家相比整体水平尚有一定的差距。因此,培育L-苏氨酸高产菌株以降低生产成本来提高国际市场竞争力是十分必要的。
由于大肠杆菌和谷氨酸棒杆菌遗传背景研究得较为透彻,具有操作简便、易于控制、培养基简单且生长快速的优点,近年来成为改造高产苏氨酸的热门菌株。随着技术的日趋成熟,系统代谢工程成为改造菌株生产氨基酸的理想方法。例如,沈琼通过增强L-苏氨酸合成途径关键酶基因thrABC和L-苏氨酸分泌有关基因rhtC的表达,使苏氨酸产量达到52.7 g/L[5]。另外,王焕章等通过敲除苏氨酸脱氢酶基因的同时过表达苏氨酸操纵子使苏氨酸产量达到75 g/L[6]。周茜修饰大肠杆菌Escherichia coli THRD的乙醛酸循环,敲除iclR并用不同强度的启动子替换aceBAK启动子,苏氨酸产量达到117.5 g/L[7]。除上述方法外,还可以通过定点突变解除调控底物对关键性酶的抑制或阻遏作用;通过基因过表达或基因定点突变,增加丙酮酸、天冬氨酸和高丝氨酸等前体物质的代谢通路;通过基因敲除或基因定点突变阻断或弱化副产物合成途径,达到提高L-苏氨酸产量的目的。在国外,Lee等通过系统代谢工程改造大肠杆菌苏氨酸合成及代谢通路,构建的工程菌株产量达到82.4 g/L[8]。本研究以大肠杆菌E. coli THR为起始菌株,运用代谢工程方法、基因敲除、基因异源过表达等技术手段,修饰苏氨酸代谢途径和苏氨酸转运途径,提高NADPH生成量,获得了一株高产苏氨酸的大肠杆菌。
1 材料与方法1.1 材料1.1.1 实验菌株与质粒
本研究中使用的菌种和质粒见表 1。
| 菌株和质粒 Strains and plasmids |
特性 Characteristics |
来源 Sources |
| 菌株Strains | ||
| E. coli JM109 | el4-(McrA-) RecA1 endA1 gyrA96 thi-1 hsdR17 supE44 relA1 Δ(lac-proAB) [F/traD36 proAB+lacq lacZ ΔM15] | Stratagene |
| E. coli THR | L-threonine producing strain (ILEr, AHVr) | Laboratory stock |
| Corynebacterium glutamicum ATCC13032 | Wild type strain | Laboratory stock |
| Clostridium acetobutylicum ATCC 824 | Wild type strain | Laboratory stock |
| E. coli THR/pEC-XK99E | E. coli THR strain carrying pEC-XK99E | This study |
| E. coli THR1 | E. coli THRΔlysC | This study |
| E. coli THR2 | E. coli THRΔlysCΔpfkB | This study |
| E. coli THR3 | E. coli THRΔlysCΔpfkBΔsstT | This study |
| E. coli THR4 | E. coli THR1 strain carrying pEC-XK99E-lysCfbr | This study |
| E. coli THR5 | E. coli THR2 strain carrying pEC-XK99E-lysCfbrthrE | This study |
| E. coli THR6 | E. coli THR3 strain carrying pEC-XK99E-lysCfbrthrEgapC | This study |
| 质粒Plasmids | ||
| pEC-XK99E | expression shuttle plasmid, kanamycin resistance | Laboratory stock |
| pEC-XK99E-lysCfbr | pEC-XK99E carrying lysCfbr | This study |
| pEC-XK99E-lysCfbr thrE | pEC-XK99E carrying lysCfbr and thrE | This study |
| pEC-XK99E-lysCfbrthrEgapC | pEC-XK99E carrying lysCfbr, thrE and gapC | This study |
1.1.2 培养基
低盐LB培养基:参照文献[9],其中NaCl 5.0 g/L。
LB固体培养基:参照文献[9],另加琼脂20.0 g/L。抗性筛选时加入终浓度为70 mg/L的氨苄青霉素或25 mg/L的卡那霉素(LBK25)。
基本培养基(g/L):葡萄糖2.0,NH4NO3 1.0,NaCl 1.0,KH2PO4 0.5,Na2HPO4 1.5,MgSO4·7H2O 0.1。
摇瓶种子培养基(g/L):蛋白胨12.0,酵母膏8.0,NaCl 5.0,用30% NaOH调节pH 7.1,1×105 Pa灭菌20 min。
二级种子培养基(g/L):葡萄糖20.0,H3PO4 0.6 mL,MgSO4·7H2O 0.5,KCl 0.6,FeSO4·7H2O 0.01,MnSO4·4H2O 0.01,CSL (TN) 0.6,消泡剂0.5 mL,甜菜糖蜜(BM) 12.0 mL,用氨水调节pH 5.6,1×105 Pa灭菌20 min (葡萄糖和磷酸一起灭菌,其余一起灭菌,然后两者混合)。
发酵罐培养基(g/L):葡萄糖20.0,H3PO4 0.5 mL,MgSO4·7H2O 0.4,KCl 0.6,FeSO4·7H2O 0.01,MnSO4·4H2O 0.01,CSL (TN) 0.3,消泡剂0.5 mL,甜菜糖蜜(BM) 18.0 mL,甜菜碱(Betaine) 1.0,用氨水调节pH 5.0,1×105 Pa灭菌20 min (葡萄糖和磷酸一起灭菌,其余一起灭菌,然后二者合并)。
1.1.3 主要试剂和仪器
DNA聚合酶、T4 DNA连接酶,诺唯赞(南京)生物科技有限公司;各种限制性内切酶,宝生物工程(大连)有限公司;质粒提取试剂盒、胶回收试剂盒以及核苷酸片段纯化试剂盒,康润生物(北京)生物科技有限公司;氨苄青霉素和卡那霉素,生工生物工程(上海)股份有限公司;其他试剂,国药集团(上海)有限公司。
可见紫外分光光度计,尤尼柯(上海)仪器有限公司;凝胶水平电泳仪,北京六一仪器厂;生物传感分析仪,山东省科学院生物研究所;冷冻离心机,Beckman Coulter公司;高速离心机,Sigma公司;凝胶成像系统,Bio-Rad公司;高效液相色谱(HPLC)系统,安捷伦科技有限公司。
1.1.4 PCR引物
基于NCBI数据库中E. coli THR基因组序列,用DNAMAN软件设计用于各基因、敲除框的扩增和验证引物,如表 2所示。
| 引物名称 Primers name |
序列 Primers sequence (5′→3′) |
限制性酶切位点 Restriction sites |
| ΔlysC-F | TAGTGACAAGAAAATCAATACGGCCCGAAATATAGCTTCCAGGCCATACAGTAT CGTCTTGAGCGATTGTG | - |
| ΔlysC-R | CTCTTCCCTTGTGCCAAGGCTGAAAATGGATCCCCTGACACGAGGTAGTTGATAA GCTGTCAAACATGAGA | - |
| lysC-F | TTACTCAAACAAATTACTATGCA | - |
| lysC-R | ATGTCTGAAATTGTTGTCTCC | - |
| ΔpfkB-F | TTCTTCACTTTCCGCTGATTCGGTGCCAGACTGAAATCAGCCTATAGGAGGAAATGCGTCTTGAGCGATTGTG | - |
| ΔpfkB-R | AACGCGTTGCCGACAGGTTGGTGATGATTCCCCCAATGCTGGGGGAATGTTTTTGG ATAAGCTGTCAAACATGAGA | - |
| YΔpfkB-F | GCTCCAATAAATCATATTG | - |
| YΔpfkB-R | CATGACTTTTGAGCATAGTC | - |
| ΔsstT-F | AGATGCGTCGACAGAACGCACCAGGGATGTGCGACAACACAATGAAAGGATCGAAAACGTCTTGAGCGATTGTG | - |
| ΔsstT-R | ATTGATCCGTTTAAAGTTGAGAAAACCCCTTCCGCCGTAGACGAAAGGGGTTAAACAAGATAAGCTGTCAAACATGAGA | - |
| YΔsstT-F | ATGACTACGCAACGTTCAC | - |
| YΔsstT-R | TTAATTACGCAGGGCG | - |
| lysCfbr-F | GGAATTCGTGGCCCTGGTCGTACAG | EcoR I |
| lysCfbr-R | GGGGTACCTTAGCGTCCGGTGCCTG | Kpn I |
| thrE-F | GGGGTACCAAGGAGATATAATGTTGAGTTTTGCGACC | Kpn I |
| thrE-R | ACGCGTCGACTTACCTTTTATTACCGAATCTCTG | Sal I |
| gapC-F | ACGCGTCGACAAGGAGATATAATGGCAAAGATAGCTATTAATG | Sal I |
| gapC-R | ACGCGTCGACTTAAACTATTTTGCTATTTTTGC | Sal I |
| 注:下划线是同源扩展的序列;斜体为酶切位点序列;-:无酶切位点. Note: Underlined sequences are homologous extensions; Italics are sequences of restriction sites; -: No restriction sites. |
||
1.2.1 敲除lysC、pfkB、sstT基因
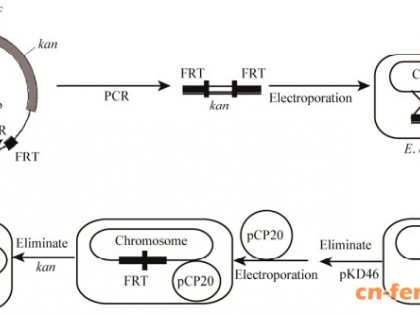
E. coli THR菌株lysC基因的敲除过程如图 1所示。第一步用kan基因置换待敲除靶基因:以pKD13作为PCR模板,使用引物ΔlysC-F和ΔlysC-R扩增获得DNA片段(包括lysC的上游和下游同源臂序列、kan基因和2个FRT位点),用1 mm电击杯在1 800 V电压下转化E. coli THR/pKD46感受态细胞中[8]。电击后,将细胞在37 ℃孵育2 h后涂布在LBK25平板上。pKD46在阿拉伯糖的诱导下表达重组蛋白,介导敲除框同源臂基因和大肠杆菌基因组发生重组。培养12 h后挑取单个菌落,使用两对检测引物进行PCR扩增,确定敲除盒上、下游片段大小正确,判定lysC敲除成功。第二步消除kan基因和pCP20质粒:为了达到消除kan的目的,需要温敏型质粒pCP20携带并编码的FLP重组酶,该酶可以介导2个FRT位点之间的切除。电转pCP20质粒进入E. coli THRΔlysC::kan菌株中,在42 ℃培养12 h后稀释并涂布在LB固体培养基上。挑取单个菌落,分别点种在LBK25平板和LB平板,37 ℃培养12 h,挑取仅能在LB平板上生长的单菌落用于PCR验证,片段大小正确即为E. coli THRΔlysC。用同样的方法敲除pfkB、sstT。
 |
| 图 1 敲除lysC基因流程Figure 1 Flow chart of making lysC knock-out |
|
图选项
|
1.2.2 表达lysCfbr、thrE、gapC质粒的构建与电转化
(1) 目的片段的扩增
依据GenBank中公布的大肠杆菌E. coli MG1655、谷氨酸棒杆菌Corynebacterium glutamicum ATCC13032及丙酮丁醇梭菌Clostridium acetobutylicum ATCC 824整个基因组序列设计扩增各个基因的引物(表 2),并使用上述3种基因组作为PCR模板来扩增目的基因。PCR体系按说明书操作,PCR反应条件:95 ℃ 5 min;95 ℃ 30 s,相应退火温度30 s,72 ℃相应时间,35个循环;72 ℃ 10 min;12 ℃保温。根据引物退火温度和目标片段长度设定实验中的退火温度和延伸时间见表 3。引物合成和靶基因测序由安徽通用生物工程公司完成。
| 反应目的 Reaction purpose |
正向引物 Forward primer |
反向引物 Reverse primer |
退火温度 Annealing temperature (℃) |
延伸时间 Extension time (s) |
产物长度 Product length (bp) |
| 扩增lysC敲除片段Amplification of lysC knockout fragment | ΔlysC-F | ΔlysC-R | 50 | 90 | 1 447 |
| 扩增pfkB敲除片段Amplification of pfkB knockout fragment | ΔpfkB-F | ΔpfkB-R | 53 | 60 | 1 039 |
| 扩增sstT敲除片段Amplification of sstT knockout fragment | ΔsstT-F | ΔsstT-R | 50 | 80 | 1 344 |
| lysC敲除验证lysC knockout verification | lysC-F | lysC-R | 57 | - | - |
| pfkB敲除验证pfkB knockout verification | YΔpfkB-F | YΔpfkB-R | 60 | - | - |
| sstT敲除验证sstT knockout verification | YΔsstT-F | YΔsstT-R | 55 | - | - |
| 扩增lysCfbr片段Amplification of lysCfbr fragment | lysCfbr-F | lysCfbr-R | 56 | 75 | 1 266 |
| 扩增thrE片段Amplification of thrE fragment | thrE-F | thrE-R | 60 | 90 | 1 485 |
| 扩增gapC片段Amplification of gapC fragment | gapC-F | gapC-R | 53 | 60 | 1 005 |
| Note: -: No data. | |||||
(2) 质粒的构建与转化
通过PCR扩增lysCfbr、thrE和gapC基因以获得目标片段,以引物中设计的酶切位点进行酶切、片段纯化,获得酶切后的lysCfbr、thrE和gapC基因片段。用EcoR I和Kpn I双酶切pEC-XK99E,纯化回收,与相同酶切后的lysCfbr基因片段过夜酶连、转化,培养后挑取单个菌落进行菌落PCR及质粒酶切验证。选择构建正确的质粒(pEC-XK99E- lysCfbr)用Kpn I和Sal I双酶切,经纯化后与thrE基因过夜酶连,经转化、验证获得pEC-XK99E- lysCfbrthrE质粒。用Sal I单酶切,纯化、回收后与gapC基因连接、转化、菌落PCR酶切验证。最终构建成质粒pEC-XK99E- lysCfbrthrEgapC,将成功连接并测序正确的重组质粒分别电转化宿主菌大肠杆菌,依次构建基因工程菌E. coli THRΔlysC/ pEC-XK99E-lysCfbr (即E. coli THR4)、E. coli THRΔlysCΔsstT/pEC-XK99E-lysCfbrthrE (即E. coli THR5)和E. coli THRΔlysCΔsstTΔpfkB/pEC-XK99E- lysCfbrthrEgapC (即E. coli THR6)。
1.2.3 目的基因的表达
将菌体在37 ℃、100 r/min条件下培养至OD600值为0.6-0.8,在37℃以1.0 mmol/L的终浓度添加IPTG,诱导4 h后收集并处理菌体。通过SDS-PAGE凝胶电泳分析蛋白表达情况。
1.2.4 5 L发酵罐发酵苏氨酸
上罐操作实验流程:菌种超低温冰箱-80 ℃保存→平板活化→摇瓶培养→5 L发酵罐培养菌种活化平板:每个平板用1 mL移液器吸取0.12 mL菌液涂布平板,于37 ℃恒温培养24 h;摇瓶培养(培养体积100 mL/500 mL三角瓶):温度37 ℃,转速90 r/min,pH 6.8-7.2,培养时间5-7 h,每2 h中间过程取样,测定pH和OD600值;5 L发酵罐培养(培养体积2 L):底糖30 g/L,流加糖浓度800 g/L、流加10%聚醚消泡剂、浓氨水控制pH 7.00±0.05;温度37.0±0.1 ℃,DO (Dissolved oxygen) > 25%,发酵罐培养36 h。
1.2.5 测定方法
菌体浓度测定:每2 h取一次样品,吸出0.2 mL发酵液,用稀盐酸稀释25倍,用分光光度计测定600 nm处的吸光度。
酶活性测定:天冬氨酸激酶(AK)活性测定参照文献[10]。3-磷酸甘油醛脱氢酶和苏氨酸转运蛋白活性测定参照文献[11]。
葡萄糖浓度测定:采用SBA-40C型生物传感器测量。
苏氨酸浓度测定:取1 mL发酵液,10 000 r/min离心5 min去除菌体,经孔径0.22 μm的滤膜过滤所得滤液,用高效液相色谱法(HPLC)测定其中苏氨酸浓度[12]。Agilent 1200色谱仪,色谱柱为Agilent ZORBAX Eclipse AAA,流动相为乙腈-乙酸钠缓冲液,流速1 mL/min,检测器为DAD二极管阵列检测器,检测波长360 nm,色谱柱温度为33℃。
2 结果与分析2.1 苏氨酸代谢途径中lysC、pfkB、sstT基因的敲除大肠杆菌中含有3种天冬氨酸激酶:AKⅠ、AKⅡ、AKⅢ,分别由lysC、metL、thrA编码,使天冬氨酸磷酸化后分别进入L-Lys、L-Met、L-Thr的合成途径。其中,由lysC编码的AKⅢ其基因表达和酶活性都被L-赖氨酸阻遏和抑制。敲除大肠杆菌的lysC基因并用谷氨酸棒状杆菌的天冬氨酸激酶lysCfbr代替。大肠杆菌每生成1分子苏氨酸需要消耗3分子NADPH,因此通过删除磷酸果糖激酶II基因pfkB,增加进入磷酸戊糖途径(PPP)的碳通量以提供更多NADPH。大肠杆菌苏氨酸吸收蛋白主要有TdcC和SstT,其中SstT发挥主要作用,将SstT敲除将有效降低苏氨酸吸收速率,减少胞内积累,从而提高大肠杆菌苏氨酸生成量。
用PCR鉴定发现lysC被kan成功替换,结果如图 2A所示。在42℃培养敲除成功的转化子,消除温敏型辅助质粒pCP20及kan基因。用同样的方法敲除pfkB、sstT基因。
 |
| 图 2 PCR验证lysC基因的敲除(A)以及验证pfkB和sstT基因的敲除(B)Figure 2 Confirmation of lysC, pfkB and sstT deletion in E. coli THRNote: M: DL10000 DNA marker. A: 1: E. coli THR genomic DNA (1 350 bp); 2: E. coli THRΔlysC::kan (No band); 3: E. coli THRΔlysC(254 bp). B: 1: E. coli THR1 genomic DNA (1 090 bp); 2: E. coli THRΔlysCΔpfkB::kan (1 503 bp); 3: E. coli THRΔlysCΔpfkB (260 bp); 4: E. coli THR2 genomic DNA (1 415 bp); 5: E. coli THRΔlysCΔpfkBΔsstT::kan(1 513 bp); 6: E. coli THRΔlysCΔpfkBΔsstT (255 bp). |
|
图选项
|
2.2.1 重组表达质粒的构建
相比大肠杆菌,在谷氨酸棒杆菌中仅有一种天冬氨酸激酶,它由lysC基因编码,本实验试着敲除大肠杆菌自身天冬氨酸激酶(AKⅢ),并异源表达谷氨酸棒杆菌中解除了反馈抑制的天冬氨酸激酶lysCfbr;由于生产苏氨酸菌体需要大量NADPH,异源表达丙酮丁醇梭菌中由gapC编码的NADP+依赖型甘油醛-3-磷酸脱氢酶,增加代谢途径中NADPH的供应[13];谷氨酸棒杆菌的thrE编码转运蛋白,有效地将苏氨酸转运出细胞。这3种基因的有效转录促进苏氨酸合成和细胞外积累。因此本研究构建了质粒pEC-XK99E-lysCfbrthrEgapC,用于这3个基因的过量表达,见图 3。
 |
| 图 3 pEC-XK99E-lysCfbrthrEgapC质粒构建图Figure 3 Construction of pEC-XK99E-lysCfbrthrEgapC |
|
图选项
|
构建质粒pEC-XK99E-lysCfbrthrEgapC的验证如图 4所示,pEC-XK99E-lysCfbr用EcoR I单酶切得到8 284 bp片段,pEC-XK99E-lysCfbr用EcoR I和Kpn I双酶切得到7 018 bp和1 266 bp两个片段;pEC-XK99E-lysCfbrthrE用Kpn I单酶切得到9 769 bp的单片段,pEC-XK99E-lysCfbrthrE用Kpn I和Sal I双酶切得到8 284 bp和1 485 bp两个片段;pEC- XK99E-lysCfbrthrEgapC用Sal I单酶切得到9 769 bp和1 005 bp两个片段。3个质粒单、双酶切后,经琼脂糖凝胶电泳检测,条带大小均与预测结果一致。
 |
| 图 4 重组质粒的酶切验证电泳图Figure 4 Enzymatic digestion of recombinant plasmid注:M:DL10000 DNA marker;1:pEC-XK99E-lysCfbr单酶切;2:pEC-XK99E-lysCfbr双酶切产物lysCfbr;3:pEC-XK99E-lysCfbrthrE单酶切;4:pEC-XK99E-lysCfbrthrE双酶切产物thrE;5:pEC-XK99E-lysCfbrthrEgapC单酶切产物gapC.Note: M: DL10000 DNA marker; 1: pEC-XK99E-lysCfbr single digestion; 2: pEC-XK99E-lysCfbr double digestion product lysCfbr; 3: pEC-XK99E-lysCfbrthrE single digestion; 4: pEC-XK99E-lysCfbrthrE double digestion product thrE; 5: pEC-XK99E-lysCfbrthrEgapC single digestion product gapC. |
|
图选项
|
2.2.2 目的基因的诱导表达
重组菌于37 ℃培养,至OD600为0.6-0.8时加入终浓度为1.0 mmol/L的IPTG诱导目的蛋白表达,4 h后收集菌体,对菌体进行超声破碎,并通过SDS-PAGE电泳分析。以出发菌株E. coli THR/pEC-XK99E为空白对照,检验目的基因在受体菌中的表达情况,结果如图 5所示,与对照组相比,E. coli THR/pEC-XK99E-lysCfbr在47 kD处出现特异性蛋白条带,与文献[14]报道一致。重组菌E. coli THR/pEC-XK99E-lysCfbrthrE出现2条特异性条带,分别在47 kD和52 kD附近处,这与lysCfbr、thrE基因编码的蛋白理论分子质量相一致。而重组菌E. coli THR/pEC-XK99E-lysCfbrthrEgapC表达时,分别在47、52和36 kD[15-16]处有明显的加粗变深的条带,说明靶基因在重组细菌中成功表达。
 |
| 图 5 E. coli THR中表达lysCfbr、thrE和gapC的SDS-PAGE电泳检测图Figure 5 Analysis of lysCfbr, thrE and gapC expression in E. coli THR by SDS-PAGE gel electrophoresisNote: M: Protein ladder; 1: E. coli THR/pEC-XK99E; 2: E. coli THR/pEC-XK99E-lysCfbr; 3: E. coli THR/pEC-XK99ElysCfbrthrE; 4: E. coli THR/pEC-XK99E-lysCfbrthrEgapC. |
|
图选项
|
2.2.3 异源表达蛋白的酶活性测定
通过对粗酶液的蛋白定量和酶活性测定,获得相应酶的比酶活见表 4。从表 4可以看出,与原始菌相比,异源表达lysCfbr时AK的活性提高了45.6倍,而对另外两种酶的活性几乎无影响。多个基因串联表达时,ThrE、GADPH的酶活均实现了从无到有的质变且活性提高明显。值得注意的是,随着串联基因数量的增加,酶活会随之略有减弱,但均高于原始菌株。酶活性测定结果表明,来自谷氨酸棒杆菌和丙酮丁醇梭菌的基因均能在大肠杆菌中表达且活性良好。
| 菌株Strains | AK Ⅲ | ThrE | GADPH |
| E. coli THR/pEC-XK99E | 0.003 | 0.002 | 0.002 |
| E. coli THR/pEC-XK99E- lysCfbr | 0.143 | 0.001 | 0.002 |
| E. coli THR/pEC-XK99E- lysCfbrthrE | 0.125 | 0.478 | 0.001 |
| E. coli THR/pEC-XK99E- lysCfbrthrEgapC | 0.116 | 0.298 | 0.254 |
将出发菌株E. coli THR和重组菌株E. coli THR4、E. coli THR5、E. coli THR6分别接入液体LB培养基,于37 ℃、90 r/min条件下培养30 h,每2 h取样,稀释适当倍数后测定600 nm处的吸光度,并对培养时间作图绘制生长曲线,对照为原始菌株E. coli THR。如图 6所示,3株重组菌株在生长过程中的延迟期均比原始菌株E. coli THR有延长,原因可能在于较大的外源质粒对菌体生长造成压力,而且在工程菌对数期加入IPTG对菌体生长有抑制作用。值得注意的是,随着携带质粒大小的增加,质粒对菌株延迟期延长的效果越不明显。这可能是因为少数几个非持家基因的缺失不会对菌体致死,且质粒携带基因表达了相关蛋白。异源表达thrE可以促进苏氨酸分泌,降低胞内苏氨酸浓度,从而促使细胞吸收更多的碳源用于菌体生长和产物合成。另外,gapC的过表达可以增加胞内NADPH的浓度,作为多种反应的供氢体,促进体内糖酵解、TCA循环等关键代谢反应,从而促进菌体生长。除E. coli THR4最终菌体长势弱于出发菌株外,E. coli THR5和E. coli THR6最终的细胞密度均高于原始菌株。
 |
| 图 6 E. coli THR及其重组菌株的生长曲线Figure 6 The growth curve of E. coli THR and its recombinant strains |
|
图选项
|
经过5 L发酵罐发酵比较起始菌株与基因工程菌的生长和产酸情况。结果如图 6所示,改造后的菌株对数期均有延长,比原始菌株晚2-4 h进入平稳期。由图 7可知,发酵36 h后,相比E. coli THR1、E. coli THR2、E. coli THR3的最大生物量,E. coli THR4、E. coli THR5、E. coli THR6均有所提高,说明lysCfbr、thrE、gapC均成功在宿主菌中表达,并弥补了lysC、pfkB、sstT基因敲除带来的不利影响。发酵结束时,E. coli THR6的苏氨酸产量显著高于对照组E. coli THR,其苏氨酸产量、糖酸转化率及单位产酸能力分别为105.30±0.50 g/L、43.20%和5.76 g/g DCW,较对照组(68.78±1.18 g/L、30.25%和4.38 g/g DCW)分别提高54.4%、42.8%和31.5%。
 |
| 图 7 基因改造对苏氨酸发酵的影响Figure 7 Effect of genetic modification on threonine fermentationNote: A: E. coli THR; B: E. coli THR1; C: E. coli THR2; D: E. coli THR3; E: E. coli THR4; F: E. coli THR5; G: E. coli THR6. |
|
图选项
|
原始菌株和工程菌株发酵液中L-苏氨酸的含量由高效液相色谱测定,结果如表 5所示,可知在原始菌株E. coli THR发酵液中L-苏氨酸产量为68.78±1.18 g/L,基因工程菌E. coli THR4和E. coli THR5发酵液中L-苏氨酸的产量分别为80.68±1.23 g/L和91.27±0.67 g/L,而工程菌E. coli THR6发酵液中L-苏氨酸的产量达到105.30±0.50 g/L。这可能是由于L-苏氨酸属于天冬氨酸家族氨基酸,自L-天冬氨酸起,天冬氨酸激酶(AK)参与第一步催化反应。敲除E. coli THR的天冬氨酸激酶(AK Ⅲ),有利于增加苏氨酸合成通路的碳通量,同时异源表达谷氨酸棒杆菌中解除了反馈抑制的天冬氨酸激酶lysCfbr,达到增加L-苏氨酸前体高丝氨酸的目的。在此基础上缺失大肠杆菌苏氨酸吸收蛋白SstT,同时异源表达谷氨酸棒杆菌中的苏氨酸分泌蛋白ThrE,从大肠杆菌苏氨酸转运系统出发,有效减弱吸收系统的同时强化分泌系统,更多地积累胞外L-苏氨酸。由于大肠杆菌合成1分子L-苏氨酸需要消耗3分子NADPH,所以,从增加胞内NADPH的角度出发,敲除磷酸果糖激酶II基因pfkB,增加进入磷酸戊糖途径的碳通量,同时异源表达丙酮丁醇梭菌中由gapC编码的NADP+依赖型甘油醛-3-磷酸脱氢酶,增加代谢途径中NADPH的供应。由于合成L-苏氨酸的代谢途径较长,影响因素较多,单独对某个基因的改造对苏氨酸代谢通量影响不大,从多个方面进行多基因改造才能获得一定的效果。
| 菌株Strains | 最大生物量Maximum biomass (g DCW/L) | L-苏氨酸产量L-Threonine (g/L) | 糖酸转化率Sugar and acid conversion rate (%) | 单位产酸能力Unit acid production capacity (g/g DCW) |
| E. coli THR | 15.70±5.31 | 68.78±8.78 | 30.25 | 4.38 |
| E. coli THR1 | 13.46±3.46 | 69.16±9.16 | 25.78 | 5.14 |
| E. coli THR2 | 12.98±2.98 | 72.25±2.25 | 29.24 | 5.57 |
| E. coli THR3 | 15.09±5.09 | 75.64±5.64 | 33.29 | 5.04 |
| E. coli THR4 | 14.48±4.48 | 80.68±0.68 | 39.21 | 5.57 |
| E. coli THR5 | 16.70±6.26 | 91.27±0.67 | 37.75 | 5.47 |
| E. coli THR6 | 18.26±8.26 | 105.30±0.50 | 43.20 | 5.76 |
大肠杆菌中含有3种天冬氨酸激酶AKⅠ、AKⅡ、AKⅢ,分别由lysC、metL、thrA编码,使天冬氨酸磷酸化后分别进入L-Lys、L-Met、L-Thr的合成途径,而谷氨酸棒杆菌中只有一种天冬氨酸激酶LysC[17]。苏氨酸转运系统中,大肠杆菌具有3种分泌蛋白RhtA、RhtB、RhtC和3种吸收蛋白TdcC、SstT和LIV-1,而谷氨酸棒杆菌中只有1种苏氨酸摄入蛋白ThrE[18]。大肠杆菌中主要存在NAD+依赖型GADPH (NAD+-GADPH)[18],因此通过异源表达丙酮丁醇梭菌的NADP+-GADPH (gapC)编码,增加NADPH生成。基于代谢工程手段构建大肠杆菌用于苏氨酸的工业化生产已引起研究者的高度关注。梁媛等[19]运用Red重组技术和基因过表达技术,在过表达rhtC的同时敲除了sstT基因,结果表明细胞中L-苏氨酸流出能力得到有效增强,L-苏氨酸在细胞中浓度降低,与原始菌株相比,L-苏氨酸的产量增加了15.33%。杨冬美等[20]从菌株E. coli W3110出发,构建了TdcC、SstT和LIV-1系统单缺失和多缺失菌株,并将重组质粒pKKthrAC1034TBC分别转入原始菌和重组菌,重组菌苏氨酸吸收能力比T04降低了12.97%,胞外苏氨酸积累量比对照菌W3110(pKKthrAC1034TBC)高出172.5%。Siedler等[21]通过单敲除pfkA、pfkB、pgi及双敲除pfkA和pfkB,增加进入PPP途径的碳通量,从而增加代谢过程中NADPH的生成。张雪等[22]通过用高拷贝质粒载体pMD19-T表达thrA345BC操纵子,使野生型菌株E. coli W3110中L-苏氨酸胞外积累量达到9.2 g/L。Lee等[8]在一株E. coli L-苏氨酸生产菌中,通过对编码苏氨酸脱水酶(TD)的ilvA进行点突变C290T,降低了其催化活性,并通过敲除染色体上的tdh基因达到减少L-苏氨酸胞内消耗的目的。周茜[7]修饰大肠杆菌E. coli THRD的乙醛酸循环,敲除iclR并用不同强度的启动子取代aceBAK启动子,苏氨酸产量和糖酸转化率分别增加了20.61%和20.70%。
本研究通过敲除苏氨酸代谢途径中lysC、pfkB、sstT基因,达到增加通往苏氨酸合成的碳通量、增加代谢过程中NADPH的产生和加快苏氨酸合成后向胞外转运的目的;同时,构建了表达质粒pEC-XK99E-lysCfbrthrEgapC,通过在E. coli THR菌株中过量表达lysCfbr、thrE和gapC等基因,促进了苏氨酸前体物质的合成,增加代谢途径中NADPH的供应和苏氨酸的胞外转运,将大肠杆菌中苏氨酸的产量提高到105 g/L,获得了一株高产苏氨酸的大肠杆菌。
| [1] |
Jia DS. Market status quo and the development foreground of threonine[J]. Feed China, 2006(1): 28-30. (in Chinese)
贾冬舒. 苏氨酸市场现状及发展前景[J]. 饲料广角, 2006(1): 28-30. DOI:10.3969/j.issn.1002-8358.2006.01.010 |
| [2] |
Huang J, Xu QY, Chen N. The methods and study evolution of L- threonine production[J]. Journal of Henan University of Technology (Natural Science Edition), 2007, 28(5): 88-92. (in Chinese)
黄金, 徐庆阳, 陈宁. L-苏氨酸的生产方法及研究进展[J]. 河南工业大学学报:自然科学版, 2007, 28(5): 88-92. |
| [3] |
Sprenger GA. Aromatic amino acids[A]//Wendisch VF. Amino Acid Biosynthesis — Pathways, Regulation and metabolic Engineering[M]. Berlin, Heidelberg: Springer, 2006: 93-127
|
| [4] |
Feng MQ, Zhai CJ. Deliberation on the preparation of L-threonine[J]. Hebei Journal of Industrial Science & Technology, 1999, 16(4): 15-18. (in Chinese)
冯美卿, 翟超进. L-苏氨酸制备方法评述[J]. 河北工业科技, 1999, 16(4): 15-18. DOI:10.3969/j.issn.1008-1534.1999.04.005 |
| [5] |
Shen Q. Construction of threonine genetic engineering bacteria[D]. Shanghai: Master's Thesis of East China University of Science and Technology, 2002 (in Chinese)
沈琼.苏氨酸基因工程菌的构建[D].上海: 华东理工大学硕士学位论文, 2002 |
| [6] |
Wang HZ, Wu X, Peng RH, et al. Method for producing L-threonine by Escherichia coli: CN, CN03151020[P]. 2005-03-23 (in Chinese)
王焕章, 吴新, 彭日荷, 等.大肠杆菌生产L-苏氨酸: 中国, CN03151020.5[P]. 2005-03-23 |
| [7] |
Zhou X. Construction of L-threonine-producing strains and optimization of fermentation process[D]. Tianjin: Master's Thesis of Tianjin University of Science & Technology, 2016 (in Chinese)
周茜. L-苏氨酸生产菌的构建及发酵优化[D].天津: 天津科技大学硕士学位论文, 2016 |
| [8] |
Lee KH, Park JH, Kim TY, et al. Systems metabolic engineering of Escherichia coli for L-threonine production[J]. Molecular Systems Biology, 2007, 3: 149.
|
| [9] |
Sambrook J, Russell DW. Molecular Cloning: A Laboratory Manual[M]. Huang PT, trans. 3rd ed. Beijing: Chemical Industry Press, 2008 (in Chinese)
萨姆布鲁克J, 拉塞尔DW.分子克隆实验指南[M].黄培堂, 译. 3版.北京: 化学工业出版社, 2008 |
| [10] |
Shen Q, Huang XF, Wu HZ, et al. Cloning and expression of the thr operon and the detection of aspartokinase I activity[J]. Pharmaceutical Biotechnology, 2003, 10(3): 133-136. (in Chinese)
沈琼, 黄雪峰, 吴海珍, 等. 苏氨酸操纵子的克隆表达及天冬氨酸激酶的测活[J]. 药物生物技术, 2003, 10(3): 133-136. DOI:10.3969/j.issn.1005-8915.2003.03.002 |
| [11] |
Bisswanger H. Practical Enzymology[J]. Translated by Liu XQ. Beijing: Chemical Industry Press, 2009 (in Chinese)
比斯瓦根H.酶学实验手册[J].刘晓晴, 译.北京: 化学工业出版社, 2009 |
| [12] |
Zhou HY. Strain construction, metabolic regulation and process optimization for L-phenylalanine production[D]. Wuxi: Doctoral Dissertation of Jiangnan University, 2011: 53-55 (in Chinese)
周海岩. L-苯丙氨酸生产菌株的构建、代谢调控和发酵条件优化[D].无锡: 江南大学博士学位论文, 2011: 53-55 |
| [13] |
Xu JZ. Breeding L-lysine hyper producer by Corynebacterium glutamicum based on metabolic engineering[D]. Wuxi: Doctoral Dissertation of Jiangnan University, 2014 (in Chinese)
徐建中.基于代谢工程选育谷氨酸棒杆菌L-赖氨酸高产菌[D].无锡: 江南大学博士学位论文, 2014 |
| [14] |
Mo XC, Pei JX, Guo Y, et al. Genome sequence of Clostridium acetobutylicum GXAS18-1, a novel biobutanol production strain[J]. Genome Announcements, 2015, 3(2).
|
| [15] |
Yang JJ, Yang S. Comparative analysis of Corynebacterium glutamicum genomes: a new perspective for the industrial production of amino acids[J]. BMC Genomics, 2017, 18(S1): 940. DOI:10.1186/s12864-016-3255-4
|
| [16] |
Rieping M, Thierbach G, Van Der RME, et al. Process for the fermentative preparation of L-threonine: US, 6630332[S]. 2003-10-07
|
| [17] |
Dong XY, Wang XY. Advances in microbial metabolic engineering to increase L-threonine production[J]. Journal of Food Science and Biotechnology, 2016, 35(12): 1233-1240. (in Chinese)
董迅衍, 王小元. 微生物生产L-苏氨酸的代谢工程研究进展[J]. 食品与生物技术学报, 2016, 35(12): 1233-1240. DOI:10.3969/j.issn.1673-1689.2016.12.001 |
| [18] |
Yuzbashev TV, Vybornaya TV, Larina AS, et al. Directed modification of Escherichia coli metabolism for the design of threonine-producing strains[J]. Applied Biochemistry and Microbiology, 2013, 49(9): 723-742. DOI:10.1134/S0003683813090056
|
| [19] |
Liang Y, Yang SY, Liu HL, et al. Effect of transport proteins SstT and RhtC modification on L-threonine production in Escherichia coli[J]. Modern Food Science and Technology, 2014, 30(4): 99-103. (in Chinese)
梁媛, 杨书尧, 刘宏亮, 等. 大肠杆菌转运蛋白SstT和RhtC的改造对L-苏氨酸产量的影响[J]. 现代食品科技, 2014, 30(4): 99-103. |
| [20] |
Yang DM, Li H, Li YR, et al. Effects of TdcC, SstT and LIV-1 systems deletion of Escherichia coli on extracellular L-threonine accumulation[J]. Microbiology China, 2017, 44(1): 20-29. (in Chinese)
杨冬美, 李华, 李由然, 等. 大肠杆菌TdcC、SstT和LIV-1系统缺失对胞外L-苏氨酸积累的影响[J]. 微生物学通报, 2017, 44(1): 20-29. |
| [21] |
Siedler S, Bringer S, Bott M. Increased NADPH availability in Escherichia coli: improvement of the product per glucose ratio in reductive whole-cell biotransformation[J]. Applied Microbiology and Biotechnology, 2011, 92(5): 929-937. DOI:10.1007/s00253-011-3374-4
|
| [22] |
Zhang X, Yan JA, Yu L, et al. Construction of recombinant plasmids containing threonine operon and their effects on L-threonine accumulation[J]. Acta Microbiologica Sinica, 2009, 49(5): 591-596. (in Chinese)
张雪, 闫继爱, 于雷, 等. 含苏氨酸操纵子重组质粒的构建及其对大肠杆菌L-苏氨酸积累的影响[J]. 微生物学报, 2009, 49(5): 591-596. DOI:10.3321/j.issn:0001- |