为了筛选产生吡咯喹啉醌,英文名为pyrroloquinoline quinone(PQQ)的菌株并提高PQQ发酵产量,该研究建立了一种快速的高效液相色谱法检测PQQ,并采用了以甲醇为唯一碳源的选择性培养基,利用光谱法对样品进行初筛,高效液相色谱法(HPLC)对初筛得到的结果再进行复筛。该研究还对筛选得到的菌株发酵产PQQ的培养基进行了优化。研究结果显示:从样品中筛选得56株PQQ产生菌,摇瓶产量最高的一株为20.6 mg /L,通过16s rDNA 测序分析,鉴定该菌株为Methylopila sp.属。对培养基成分中的碳源甲醇进行了优化研究,当甲醇体积浓度为2.5%时,PQQ产量最高,为26.3 mg /L,相比于初始甲醇1.0%提高了28%。该研究建立的高效液相色谱法为PQQ高产菌株的筛选提供一种快速检测方法,筛选到的菌株具有较高的甲醇耐受力和PQQ生产潜力,为之后的PQQ发酵研究提供参考。
吡咯喹啉醌,英文名为pyrroloquinoline quinone(PQQ),作为许多细菌脱氢酶(甲醇脱氢酶,乙醇脱氢酶和葡萄糖脱氢酶等)的辅助因子于1964年首次被发现,它是继吡啶核苷酸和核黄素之后的第三种氧化还原酶的辅酶。PQQ在生物界的分布极为广泛,在动植物和微生物细胞中均发现其存在,但仅有部分革兰氏阴性细菌能合成PQQ。
在具有合成PQQ能力的细菌中,绝大部分只能合成痕量的PQQ以供给细胞生长,只有少部分可以生产过量的PQQ,并将其排泄到培养基中,其中以甲基营养菌的合成能力最强,如甲基菌属(Methylobacill),甲基单胞菌属(Methylomonas),嗜甲基菌属(Methylophilus)和甲基杆菌属(Methylobacterium)等。此外,在纳豆,青椒和猕猴桃等植物体内也含有微量的PQQ,并且牛奶和人类的母乳中也存在较高浓度的PQQ。近几十年来的研究发现PQQ具有多种生理功能,它是许多细菌脱氢酶的辅助因子,参与细胞的电子呼吸链传递;PQQ可以提高微生物细胞的抗逆性,并提高宿主菌的抗氧化能力[18];PQQ还是动植物刺激或生长因子;此外,PQQ与葡萄糖脱氢酶结合形成PQQ-GDH全酶,可用作检测葡萄糖的生物传感器,也可用作生物燃料电池。
由于目前PQQ化学合成步骤复杂,副产物多,而微生物发酵生产PQQ成本低,步骤少,产物分离更容易,因此微生物发酵法成为最有前景的工业化生产路线。虽然对PQQ的研究已有几十年,但其生物合成的具体过程尚未完全阐明,从环境中筛选高产野生菌依然是必不可少的。1992年,URAKAMI等筛选到一株PQQ产生菌,经鉴定为生丝微菌Hyphomicrobium sp.TK0441,优化培养基后在30 L发酵罐上发酵14天后PQQ产量可达到1 g/L。司振军等[22]从土壤中筛选到一株甲基营养菌,经鉴定为Methylobacillus sp.zju323,未经优化的PQQ摇瓶产量为23.2 mg/L,在已报道的研究中属于高水平。本研究建立了一种高效液相色谱法用来快速检测PQQ,并从土壤样品中筛选得到一株PQQ高产菌,并对其进行了菌种鉴定和培养基优化,为后续进行PQQ的进一步生产研究提供依据。
1材料与方法
1.1材料与试剂
细菌样品来自于无锡生产甲醇工厂附近的土壤和污水。PQQ标准品购自于Sigma公司,其他试剂均购自于国药集团。
1.2仪器与设备
G180T灭菌锅,美国致微仪器有限公司;高速冷冻离心机,美国赛默飞世尔科技公司;酶标仪,美国BioTek公司;Agilent-1260高效液相色谱仪,美国安捷伦科技公司。
1.3培养基
筛选培养基:甲醇30 mg /L,(NH4)2SO4 3 g/L,Na2HPO4·12H2O 3 g/L,MgSO4·7H2O 1.5 g/L ,KH2PO4 1.4 g/L,微量元素液 1 mL/L。固体培养基添加2%的琼脂粉。
种子培养基:甲醇10 mg /L,(NH4)2SO4 3 g/L,Na2HPO4·12H2O 3 g/L,MgSO4·7H2O 1.5 g/L,KH2PO4 1.4 g/L,微量元素液 1 mL/L。微量元素液:CaCl2·2H2O 30 mg/L,MnCl4·4H2O 5 mg/L发酵培养基:在种子培养基的基础上加入1 mL维生素液,维生素液配方(mg/L):核黄素200,对氨基苯甲酸200,盐酸硫胺素400,烟酸400,盐酸吡哆醇400,泛酸钙400,叶酸2,生物素2,肌醇2000。
1.4实验方法
1.4.1 PQQ产生菌初筛方法的确立
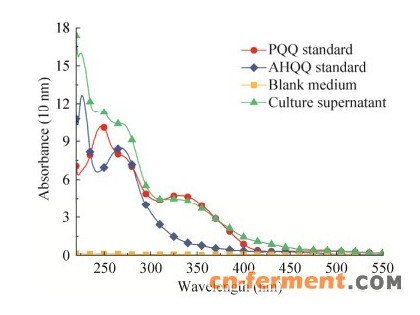
光谱法:对PQQ标准品进行全波长扫描,发现其在249 nm和330 nm处有两个吸收峰,将200 μ L PQQ标准品溶液或发酵离心上清液转移至96孔板中,用酶标仪检测 OD330与 OD249,并将空白培养基以同样的条件处理和检测,从而减去培养基吸光值的干扰。
1.4.2 HPLC法检测PQQ
由于PQQ的结构上连有3个—COOH,因此其易溶于水,极性较大,在普通的C18反相色谱柱上不保留。目前采用较多的是离子色谱对法来检测PQQ,但是离子色谱对平衡时间长,操作复杂且对柱子也有局限性;还有采用加酸调节pH来使PQQ保留在色谱柱上,但这使得峰形拖尾严重并且重现性不好。为此本实验选择亲水色谱柱来解决PQQ难以在色谱柱上保留的问题。以水为流动相,通过COSMOSIL Packed Column 5C18-PAQ反相色谱柱,测定PQQ在249 nm和330 nm的吸光值,根据出峰面积确定其浓度。利用安捷伦1260系列高效液相色谱仪测定PQQ含量,进样量20 μ L,温度30 ℃,流动相为0.05 mol/L乙酸:0.05 mol/L乙酸铵=30:70,流速1 mL/min,在波长249 nm和330 nm下检测PQQ标准品和样品含量。
1.4.3菌株的筛选
将样品制成适当浓度梯度的稀释液,涂布于甲醇筛选培养基平板上,30 ℃培养3~5天,分别挑取不同形态的单菌落接种到种子培养基中,30 ℃,200 r/min 培养3~5天,将发酵液离心取上清液,用光谱法快速检测PQQ含量,再用HPLC法对PQQ产量较高的菌株进行复筛。
1.4.4菌种的鉴定
将PQQ产量最高的菌株在固体培养基上划线,30 ℃培养3~5天,利用普通光学显微镜观察菌体形态特征。取单菌落接种到摇瓶培养基中,30 ℃培养,当菌体OD600为0.5~1时,取3 mL发酵液,10000 r/min离心1 min,弃去上清液,收集菌体,按照细菌基因组DNA提取试剂盒(TIANGEN公司)提取DNA,利用细菌通用引物 27F:5'-AGA GTT TGA TCM TGGCTC AG -3';1492R:5' -GGT TAC CTT GTT ACGACT T-3',通过 PCR 反应扩增该菌株的16s rDNA序列,将产物委托上海生工测序,将测序结果在NCBI网站中进行BLAST比对,用软件MEGA进行系统进化树的构建。
1.4.5甲醇含量对菌体生长和PQQ产量的影响
对培养基中的唯一碳源甲醇进行优化,研究甲醇的不同添加体积浓度(0.5%,1%,1.5%,2%,2.5%,3%,3.5%,4%)对菌体生长和PQQ产量的影响。
2结果与分析
2.1光谱法检测PQQ
研究建立了基于光谱法检测PQQ的快速筛选方法,通过全波长扫描发现PQQ在249 nm和330 nm左右有两个吸收峰。考虑到发酵液中含有蛋白,核酸等在249 nm左右有吸收值的物质,而在330 nm处有吸收值的物质较少,因此,本实验选择研究PQQ浓度和OD330的关系。通过酶标仪检测不同浓度 PQQ标准品的OD330(检测样品时要减去空白发酵培养基的吸光值以除去干扰),发现在330 nm下PQQ浓度与OD330关系为y=0.0218x-0.0354 (R2=0.9957)。当PQQ浓度在2.5~50 mg/L之间时,二者呈现良好的线性关系,由于野生菌产PQQ量多在1~20 mg/L左右,因此使用本方法进行高通量筛选的初筛具有良好的可行性。
2.2 HPLC法检验PQQ
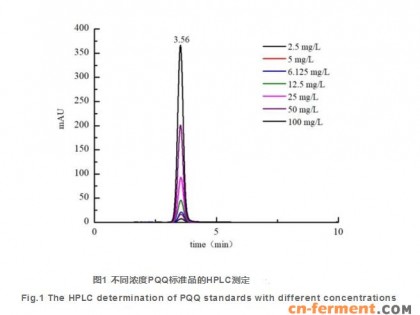
本试验最先分析了别的离子交换柱检验PQQ,結果发觉一般C18柱没法使PQQ合理保存,拆换流动性相工业甲醇和乙腈,或是是梯度方向过柱都不可以保存PQQ。此外发觉更改pH能够使PQQ有一定的保存,但峰形较弱,且托尾比较严重,而且无法非常好分离出来试品发酵物中的PQQ。充分考虑PQQ正负极很大,因而选用耐100%水的COSMOSIL Packed Column 5C18-PAQ正相反离子交换柱来使PQQ有有效的保存。将准备好的七个不一样含量的PQQ标准物质(100,50,25,12.5,6.125,5,2.5 mg/L)开展HPLC检验,每一个浓度值持续气相3次,每一次气相20 μ L。結果如图所示1所显示。不一样含量的PQQ均在3.56 min上下出峰。伴随着PQQ浓度值的提升,峰总面积也逐步提升。因而PQQ浓度值与峰总面积呈成正比的关联。以PQQ浓度值为横坐标轴,色谱仪峰总面积为纵轴,制作标曲,线性相关为y=30.27x 7.32,R2=0.9998,表明线性相关优良。选用COSMOSIL Packed Column 5C18-PAQ正相反离子交换柱检验PQQ,运作时间较短,PQQ出峰時间早,检验高效率。本研究创建的HPLC法检验PQQ具备优良的可行性分析,可做为菌苗产PQQ的复筛方式。
![202109171631892628[1]](https://www.cn-ferment.com/skin/default/image/lazy.gif)
2.3菌种的挑选和评定
经光谱法初筛,从100好几个试样中挑选到50多枝PQQ造成菌,大部分的生产量在2~5 mg/L,极少数能够做到10 mg/L上下,HPLC复筛后在其中PQQ生产量最大的1株为20.6 mg/L,峰图如图2所显示,PQQ在3.57 min出峰,这也是没经提升已报导的摇瓶较高生产量。
该菌种的菌体在工业甲醇培养液平板电脑上为奶白色,浓稠的,边沿齐整,直徑较小,为1~2 mm。菌细胞为球形,革兰氏阳性菌呈阴性,不产芽胞,有荚膜,无微绒毛。该菌种在以工业甲醇和甲胺为氮源的培养液中可以优良生长发育,能运用D-葡萄糖水,绵白糖,葡萄糖和麦芽糖醇。在以氨盐、磷酸盐、牛肉膏、蛋白胨和酵母膏为氮源的培养液里能较好生长发育。选用PCR技术性增加该菌种的16s rDNA 基因序列,经上海生工转录组测序。根据在 NCBI网址中开展开放阅读框编码序列检索及核对,从这当中选择开放阅读框较高菌种的16s rDNA基因序列,以集团公司外菌苗作对比,根据MEGA手机软件,用临接法(Neighbor-Joining)搭建系统发育树。結果如图所示3所显示,该菌种与 Methylopila henanensis strain LYBFD3-16A2的开放阅读框最大,为99%。综合性菌体及菌体形状特点、16s rDNA序列剖析,评定该菌种为Methylopila sp.菌种,取名为Methylopila sp.Z1。
![202109171631892629[1]](https://www.cn-ferment.com/skin/default/image/lazy.gif)
2.4 工业甲醇成分的提升
科学研究工业甲醇的差异加上浓度值(0.5%,1%,1.5%,2%,2.5%,3%,3.5%,4%)对OD600和PQQ生产量的危害,結果如图4所显示。在0.5%~2.5%的含量范畴内,伴随着工业甲醇容积含量的提升 ,菌体OD600和PQQ生产量也慢慢提升,当工业甲醇浓度值为2.5%时,OD600和PQQ生产量均实现最大,再次提升工业甲醇浓度值,OD600和PQQ生产量均有显著降低。这是由于工业甲醇做为病菌生長的唯一氮源,而且或是细菌细胞工业甲醇脱氨酶的底物,在其浓度值较低时,不能给予动能使细胞生长,也不能生产制造过多的PQQ代谢到培养液中,造成 PQQ生成高效率极低。当工业甲醇浓度值慢慢增强时,体细胞能够使用的氮源提升,菌体OD600和PQQ生产量也逐步提升;当工业甲醇浓度值超出2.5%时,因为工业甲醇的毒素使体细胞损害,而且底物浓度值过高抑止工业甲醇脱氢酶的活性,造成 菌体OD600和PQQ生产量降低。因而,2.5%的工业甲醇容积浓度值针对菌体生长发育和PQQ生成是最好的选择。
![202109171631892629[1]](https://www.cn-ferment.com/skin/default/image/lazy.gif)
3 结果
现阶段PQQ的检查办法具体有资产重组酶法,氧化还原反应法,光谱法和HPLC,在其中资产重组酶法常用到的葡萄糖水脱氨酶获取繁杂,提纯全过程繁杂,且取得的酶活不高,不能适用很多的菌苗挑选;氧化还原反应法中使用到的铬黑T钛酸异丙酯氟苯四氮唑蓝(NBT)易受培养液中别的成份的影响,导致呈阴性結果。光谱法实际操作简易,检验迅速,但也有可能遭受培养液中有着类似光波长OD值的危害,但本试验使用的是工业甲醇无机物培养液,并根据HPLC检验试品发觉,基本上沒有影响,因而光谱法做为PQQ造成菌的初筛是高效率有效的。本试验还构建了新的HPLC法检验PQQ,选用亲水性离子交换柱COSMOSIL Packed Column 5C18-PAQ,促使PQQ有有效的保存,而且试品运作时间较短,PQQ在3.56 min出峰,出峰時间早,现场采样短,峰形无托尾,为PQQ检验给予一种新的改善方式。
因为PQQ的微生物生成原理沒有取得彻底诠释,根据基因工程技术和新陈代谢更新改造提升PQQ的生产量远小于野山菌的生产量,因而从自然环境中挑选具备增产PQQ工作能力的菌株是十分必要的。本试验从试品中挑选到一株PQQ增产菌,经评定为Methylopila sp.属,取名为Methylopila_sp. Z1,没经提升的摇瓶生产量做到20.6 mg/L,归属于已报导的较高质量。Z1菌种承受较高工业甲醇,在培养液工业甲醇浓度值为2.5%时,PQQ生产量达26.7 mg/L,对比于原始浓度值提升了28%。Z1是一株有增产PQQ发展潜力的菌种,事后发酵设备塑造和提升加工工艺将进一步提高PQQ生产量。