1,3-二羟基丙酮(1,3-Dihydroxyacetone,DHA)是最简单的酮糖,分子中具有3个官能团,化学性质活泼,可参与多种化学反应,是一种重要的化工医药中间体,广泛应用于化工、医药、食品等领域[1]。DHA的生产主要包括化学合成法和生物转化法。化学合成法存在原料成本高、反应条件苛刻、设备要求高、产品收率低以及污染环境等问题,其应用受到一定限制。生物转化法的优势在于反应条件温和、反应专一性强、环境污染小、底物利用率高。
本文对DHA的生物转化法研究进展进行综述,涉及如下几方面:DHA 的生物合成途径、生产菌种改造、生产工艺优化、分离提取过程优化等。
1 1,3-二羟基丙酮的生物合成途径涉及DHA 生物合成的生化反应主要有3 种:
(1) 第一种生化反应以甘油为底物,在甘油脱氢酶的作用下经甘油脱氢形成DHA。
很多微生物如氧化葡萄糖酸杆菌(Gluconobacter oxydans)[2]、木醋杆菌(Acetobacterxylinum)[3]、大肠杆菌(Escherichia coli)[4]、产气克雷伯氏菌(Klebsiella aerogenes)[5]、弗托氏葡萄糖酸杆菌(Gluconobacter frateurii)[6]等均具有这种功能。
微生物中通常含有3种类型的甘油脱氢酶:1)依赖NAD+的GDH (EC1.1.1.6),主要存在于细胞质中,先将甘油转化为DHA,DHA进一步磷酸化,进入糖酵解和三羧酸循环途径。2) 依赖NADP+的GDH (EC1.1.1.72和EC1.1.1.156),多存在于霉菌和动物组织中,可将甘油氧化为甘油醛或DHA。3) 既不依赖NADP+ 、也不依赖NAD+ 的GDH(EC1.1.99.22),该酶位于葡萄糖酸杆菌属的细胞膜上,如弱氧化葡萄糖酸杆菌(Gluconobactersuboxydans) 、氧化葡萄糖酸杆菌(Gluconobacteroxydans)等[7-8]。
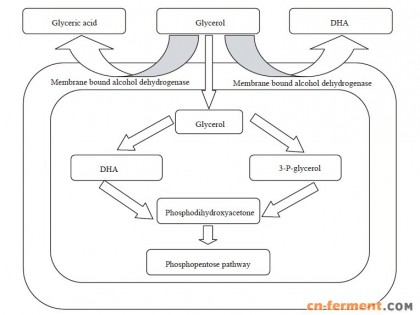
在上述菌种中,GDH (EC1.1.1.6) 和GDH(EC1.1.99.22)经常会同时存在。甘油氧化生成DHA具有2 条途径[9-10]:1) 甘油在膜结合甘油脱氢酶的作用下在周质空间生成DHA,形成的DHA 直接释放到培养基中,该反应无需ATP 和辅因子NAD+,当胞内糖酵解途径及三羧酸循环缺乏时,该途径可为细胞生长及其他代谢过程提供能量。2) 甘油进入细胞内,在胞内甘油脱氢酶的催化下生成DHA,然后转变为磷酸二羟丙酮(DHAP);也可在磷酸激酶催化下形成3-磷酸甘油,再经3-磷酸甘油脱氢酶催化生成DHAP,DHAP 进入磷酸戊糖循环途径,该过程需要ATP 及辅因子NAD+。此外,甘油在细胞膜上也可被膜结合乙醇脱氢酶催化形成甘油酸[11]。甘油在氧化葡萄糖酸杆菌中的代谢途径如图 1 所示。
 |
| 图 1 甘油在氧化葡萄糖酸杆菌中的代谢途径Figure 1 Pathways of glycerol in Gluconobacter oxydans |
|
图选项
|
(2) 第二种生化反应是以甲醇为底物,在二羟基丙酮合成酶的作用下形成。具有该功能的微生物包括两类:一类为仅包含DHA合成酶的甲醇营养型酵母,如多形汉逊酵母(Hansenula polymorpha)[12]等;另一类是既能产生甘油脱氢酶又能产生DHA合成酶的甲醇营养型酵母,如膜璞毕赤酵母(Pichiamembranifaciens)[13]。在甲醇营养型酵母中主要通过木糖单磷酸途径生成DHA,即甲醇首先氧化成甲醛,然后与5-磷酸木酮糖在DHA合成酶的作用下生成DHA和3-磷酸甘油醛,如图 2所示。
 |
| 图 2 甲醇营养型酵母中的代谢途径Figure 2 Pathways of methylotrophic yeasts |
|
图选项
|
(3) 第三种生化反应以果糖为底物转化得到,该类反应存在于运动发酵单胞菌的ED 途径,在代谢果糖生成乙醇的过程中会伴随副产物DHA的产生,其反应实质是3-P-甘油醛→磷酸二羟基丙酮→DHA[14]。
2 生物转化DHA 的菌种改造氧化葡萄糖酸杆菌是一种革兰氏阴性专性好氧菌,属于醋酸杆菌家族,因该菌生产性能相对稳定,可通过膜结合甘油脱氢酶一步法转化甘油生成DHA,且DHA能快速释放到发酵液中,因此成为目前生产DHA的首选工业菌株。当前,生物法转化甘油生产DHA存在以下几方面的问题:底物抑制、产物抑制和溶氧限制。研究发现,高浓度的底物甘油会影响菌株生长和甘油转化率[15]。DHA的存在则会严重影响细胞对甘油的摄入速度[16],Stasiak等研究发现DHA 在很低的浓度下就会抑制菌体有丝分裂活动(20-30 g/L),当DHA 浓度达到70 g/L 时,细胞分裂基本停止[17]。氧化葡萄糖酸杆菌是一种专性好氧微生物,通过有氧呼吸获取能量。因此,生物转化过程中,溶氧影响着菌体的最终生物量和代谢产物的终浓度。为了有效解决上述问题,菌种改造是首选策略。
2.1 传统菌种选育传统菌种改良包括诱变筛选、菌株驯化等。Ma等采用激光诱变获得突变株GM51,甘油脱氢酶的活性提高了75.17%,通过培养条件优化,甘油投料浓度为100 g/L 时,获得91.5%的DHA 产率[18]。Hu 等通过紫外诱变获得具有较高DHA 产率且耐受较高浓度DHA 的菌株Gluconobacter oxydansZJB11001,通过溶氧控制策略优化发酵条件,在15 L 发酵罐上经过72 h 分批补料发酵后,获得209.6 g/L 的DHA[19]。Hu 等采用离子束诱变获得突变株Gluconobacter oxydans ZJB09113,最高DHA浓度为40.0 g/L,比未优化前提高了196.3%[20]。
2.2 基因工程技术改造菌种2005 年Gluconobacter oxydans ATCC 621H 的基因组测序成功[21],利用代谢工程技术改造菌株生产DHA 的研究逐步增多。关于此方面的研究主要集中在以下2 个方面:(1) 通过表达或抑制相关基因,改善现有生产菌的代谢途径;(2) 将关键酶基因在模式菌中表达,构建新的代谢途径。
2.2.1 改善现有菌株代谢途径:研究者们对现有生产菌的代谢途径进行了研究,Gätgens等分别利用启动子gdh和tufB过量表达Gluconobacter oxydans膜系脱氢酶sldAB,提高了菌体和DHA的浓度。当以550 mmol/L甘油作为底物时,过量表达sldAB基因的菌株中DHA的积累达到350 mmol/L,对照菌株为200−280 mmol/L[22]。Habe等则对代谢旁路进行了有效抑制,根据甘油在Gluconobacter oxydans细胞膜上可同时被膜结合甘油脱氢酶和膜结合乙醇脱氢酶催化生成DHA和甘油酸的原理,通过敲除膜结合乙醇脱氢酶得到的ΔadhA突变株可以在3 d内转化220 g/L甘油生成125 g/L DHA,其静息细胞经过3 d可转化230 g/L甘油生成139.7 g/L DHA,实验同时还证明了甘油酸的升高既抑制DHA的生产,也抑制细胞生长[11]。李明华在其研究基础上,在乙醇脱氢酶缺失突变株中同时过量表达膜结合甘油脱氢酶sldAB和透明颤菌血红蛋白,采用静息细胞催化法,在34 h内转化了400 g/L甘油,DHA的产量累计达385.32 g/L,平均产率96.33%[23]。Matsutani等绘制了菌株Gluconobacter thailandicus NBRC325的基因组序列草图[24]。李华等则从腐烂的水果中筛选到一株能发酵生产DHA的弗托氏葡萄糖酸杆菌Gluconobacter frateurii HD924,该菌能发酵80 g/L的甘油产生63.04 g/L的DHA[25]。
本实验室Wu 等首先对氧化葡萄糖酸杆菌的甘油的三维结构和结合位点进行了分子模拟[26];而后Wu 等重构和验证了Gluconobacter oxydans 621H 的全基因组代谢网络iXW433。重构模型包含433 个基因,859 个反应,985 个代谢物,模型预测的代谢状态与Gluconobacter oxydans 的实验数据高度一致[27]。在此基础上,作者则分别过表达了甘油运输蛋白基因glpF 和甘油脱氢酶基因GDH,结果发现glpF 的过表达可有效促进菌种生长,而GDH 的过表达则能够提高甘油转化率,促进DHA 的生产。
2.2.2 关键酶基因在模式菌中的异源表达:将Gluconobacter oxydans 中的甘油脱氢酶基因在模式菌中异源表达也是提高DHA 产率的有效途径。魏东芝等通过扩增氧化葡萄糖杆菌基因组中甘油脱氢酶的编码基因gdh 和NADH 脱氢酶编码基因ndh,构建的质粒pET-gdh 和pET-ndh 单独或共同转入大肠杆菌中。利用该基因工程菌代谢甘油生产DHA,DHA 的浓度可达10−85 g/L[28]。Yang 等利用大肠杆菌共同表达来自于大肠杆菌的gldA 基因和来自于粪肠球菌的nox 基因,获得大肠杆菌重组菌D4,DHA 产率达到0.13 g/(h·g 湿细胞)[29]。
3 DHA 生物合成的生产工艺甘油生物转化生产DHA 的生产工艺包括发酵法、静息细胞催化法、固定化细胞法等。这些方法各有优缺点,但都存在着底物抑制、产物抑制、溶氧限制等问题。
3.1 传统发酵法发酵法生产DHA 是在含有甘油的培养基中接入菌种,发酵后从发酵液中提取DHA。该方法优点是菌体生长与甘油转化相偶联、操作简单、易于控制,缺点是底物甘油存在抑制。Bauer 等采用半连续双阶重复补料分批发酵法,可以获得220 g/L 的DHA[16] 。Hu 等在鼓泡塔生物反应器中培养Gluconobacter oxydans ZJB09112,获得(161.9±5.9) g/LDHA,甘油转化率为(88.7±3.2)%[30]。Hu 等采用pH变速控制的恒氧分批补料策略,在15 L 发酵罐中经72 h 发酵获得(175.9±6.7) g/L DHA,转化率达到(0.87±0.04) g/g[31] 。Grey 等将玻璃试管作为Gluconobacter oxydans 转化甘油生产DHA 的反应器,采用基于HPLC 的快速分光法(每分钟可处理3 个样品)测定DHA 浓度,发现试验结果具有可重复性,反应速率在整个反应过程中保持不变,同时氧扩散系数高[32]。
3.2 静息细胞催化法静息细胞催化法生产过程分为2 个阶段:细胞培养阶段和甘油催化阶段。该方法可一定程度消除甘油对产物的抑制作用,缩短反应时间,便于分离纯化,缺点是操作过程较复杂。Hu 等利用Gluconobacter oxydans ZJB09113 在内部环流生物反应器进行静息细胞催化,72 h 获得(156.3±7.8) g/L的DHA,甘油转化率达89.8%±2.4%[33]。Zhou 等设计了利用依赖于NAD+甘油脱氢酶(GldA)催化DHA生成的重组大肠杆菌,共表达了NAD+氧化酶(NOX)和NAD+转运子(NTT4),分别用于辅因子再生和胞外NAD+的摄入。发现高细胞NAD(H)水平对全细胞生物催化还原有益[34]。
3.3 固定化细胞法固定化细胞法具有细胞可重复利用、易于产物分离、稳定性好、细胞活性可长期保持等优点,然而也存在氧气不易扩散、对介质依赖性大等缺点。Kumar 等将甘油脱氢酶吸入磁性可分离介孔二氧化硅中,经戊二醛处理后形成甘油脱氢酶纳米酶反应器,24 d 后固定化酶活性仍能保持原来的64%,经过7 个批次重复利用后酶活保持在39%[35]。Zheng等通过制备二氧化硅包覆磁性Fe3O4 纳米颗粒共价固定甘油脱氢酶,发现固定化的甘油脱氢酶与游离甘油脱氢酶具有几乎相同的活性,而对DHA 的抑制敏感性则下降了1.3 倍,重复利用10 个周期后酶活性仅下降了9%[36]。
4 DHA 提取分离生物转化法生产DHA,由于DHA在水相溶解度大、热敏,因此分离提取成本高、能耗大。目前报道的DHA提取分离方法包括浓缩结晶法、溶剂萃取法、膜分离法、醇沉蒸发-结晶法等。
4.1 浓缩结晶法浓缩结晶法的难点在于DHA在水中溶解度大、处理液粘度大[37],另外菌体、蛋白质等杂质也对DHA后续结晶造成困难。William[38]先将发酵液通过阳、阴离子交换树脂柱,然后真空蒸发,再加入乙醇或正丁醇,最后得到DHA结晶。Martínez等[39]发现甲醇是形成DHA结晶的最优选择。郑裕国等使用硅胶吸附层析柱,采用乙酸乙酯-乙醇混合溶剂进行淋洗,产品收率达60%。浓缩结晶法的DHA回收率偏低,另外由于水的存在导致蒸发能耗增大[40]。
4.2 溶剂萃取法溶剂萃取法根据溶质在不同溶剂中分配比率的不同来进行分离。张小飞采用强酸性树脂,通过加入乙醛与DHA发生可逆缩醛反应,与甲苯同步萃取耦合实现了DHA的有效分离[41]。溶剂萃取法能耗低、生产能力强、分离效率高等,但是萃取过程中产生的缩醛产物水解困难、收率低、催化剂易受发酵液中盐离子的影响。
4.3 膜分离法膜分离法利用具有选择性的特殊半透膜分开溶液中的某些组分。DHA是小分子物质,可透过半透膜与发酵液中的大分子物质分离。冯屏等利用膜生物反应器连续发酵生产DHA,在生产过程中及时分离出产物和菌体,获得了较高的催化稳定性和生产效率,简化了分离纯化步骤[42]。
4.4 醇沉-蒸发结晶法醇沉工艺常被用来提取或去除核酸、蛋白、多糖等大分子,向发酵液中加入乙醇可以沉降大分子,同时可回收有机酸盐等小分子物质。本研究组采用醇沉-蒸发法同时去除发酵液中的蛋白质和盐离子,再结合结晶操作获得DHA 晶体[43]。该方法同时去除盐离子和蛋白质,减少了分离提取步骤,降低了分离提取成本。
5 展望目前,DHA 的工业化生产主要集中于美国、日本、德国等发达国家。我国起步较晚,但近年来也在传统诱变及基因重组工程菌构建、静息细胞催化、发酵过程优化、反应器选择等方面取得了显著成效。本研究组也在菌种诱变、基因工程菌种改造、甘油脱氢酶分子模拟、发酵工艺优化、分离提取等方面分别进行了一些工作[18, 26-27, 44]。纵观国内外研究现状,尽管对利用甘油生物法生产DHA 的研究取得了一定进展,但相关技术还有待完善。针对工业化生产DHA 研究的几点建议:(1) 开发优势菌种,直接以粗甘油为底物高效生产DHA;(2) 挖掘更多基因信息,研究影响菌种生产DHA 的调控机制(辅因子调控),揭示生产菌种全局代谢过程,利用代谢工程技术改造已有代谢途径,构建新的代谢途径;(3) 根据菌种特性,优化生产工艺,降低底物和产物对菌种的抑制,优化分离提纯工艺,降低生产成本。
| [1] | Mishra R, Jain SR, Kumar A. RETRACTED: Microbialproduction of dihydroxyacetone[J]. Biotechnology Advances, 2008, 26 (4): 293–303. |
| [2] | Deppenmeier U, Hoffmeister M, Prust C. Biochemistry andbiotechnological applications of Gluconobacter strains[J]. Applied Microbiology and Biotechnology, 2002, 60 (3): 233–242. |
| [3] | Nabe K, Izuo N, Yamada S, et al. Conversion of glycerol todihydroxyacetone by immobilized whole cells of Acetobacterxylinum[J]. Applied and Environmental Microbiology, 1979, 38 (6): 1056–1060. |
| [4] | Asnis RE, Brodie AF. A glycerol dehydrogenase fromEscherichia coli[J]. Journal of Biological Chemistry, 1953, 203 (1): 153–159. |
| [5] | Streekstra H, de Mattos MJT, Neijssel OM, et al. Overflowmetabolism during anaerobic growth of Klebsiella aerogenesNCTC 418 on glycerol and dihydroxyacetone in chemostatculture[J]. Archives of Microbiology, 1987, 147 (3): 268–275. |
| [6] | Liu YP, Sun Y, Tan C, et al. Efficient production ofdihydroxyacetone from biodiesel-derived crude glycerol bynewly isolated Gluconobacter frateurii[J]. BioresourceTechnology, 2013, 142 : 384–389. |
| [7] | Yamada H, Nagao A, Nishise H, et al. Formation of glyceroldehydrogenase by microorganisms[J]. Agricultural andBiological Chemistry, 1982, 46 (9): 2325–2331. |
| [8] | Claret C, Bories A, Soucaille P. Glycerol inhibition of growthand dihydroxyacetone production by Gluconobacter oxydans[J]. Current Microbiology, 1992, 25 (3): 149–155. |
| [9] | Claret C, Salmon JM, Romieu C, et al. Physiology ofGluconobacter oxydans during dihydroxyacetone productionfrom glycerol[J]. Applied Microbiology and Biotechnology, 1994, 41 (3): 359–365. |
| [10] | Deppenmeier U, Ehrenreich A. Physiology of acetic acidbacteria in light of the genome sequence of Gluconobacteroxydans[J]. Journal of Molecular Microbiology andBiotechnology, 2009, 16 (1/2): 69–80. |
| [11] | Habe H, Fukuoka T, Morita T, et al. Disruption of themembrane-bound alcohol dehydrogenase-encoding geneimproved glycerol use and dihydroxyacetone productivity inGluconobacter oxydans[J]. Bioscience, Biotechnology, andBiochemistry, 2010, 74 (7): 1391–1395. |
| [12] | O'connor ML, Quayle JR. Pentose phosphate-dependent fixationof formaldehyde by methanol-grown Hansenula polymorphaand Candida boidinii[J]. Journal of General Microbiology, 1980, 120 (1): 219–225. |
| [13] | Liu ZQ, Hu ZC, Zheng YG, et al. Optimization of cultivationconditions for the production of 1,3-dihydroxyacetone by Pichiamembranifaciens using response surface methodology[J]. Biochemical Engineering Journal, 2008, 38 (3): 285–291. |
| [14] | Viikari L, Berry DR. Carbohydrate metabolism inZymomonas[J]. Critical Reviews in Biotechnology, 1988, 7 (3): 237–261. |
| [15] | Blazejak S, Sobczak E. Bioconversion of glycerol intodihydroxyacetone DHA using Acetobacter xylinum[J]. ActaAlimentaria Polonica, 1988, 14 (2): 207–216. |
| [16] | Bauer R, Katsikis N, Varga S, et al. Study of the inhibitory effectof the product dihydroxyacetone on Gluconobacter oxydans in asemi-continuous two-stage repeated-fed-batch process[J]. Bioprocess and Biosystems Engineering, 2005, 28 (1): 37–43. |
| [17] | Stasiak-Różańska L, Błażejak S, Gientka I. Effect of glyceroland dihydroxyacetone concentrations in the culture medium onthe growth of acetic acid bacteria Gluconobacter oxydansATCC621[J]. European Food Research and Technology, 2014, 239 (3): 453–461. |
| [18] | Ma LJ, Lu WY, Xia ZD, et al. Enhancement ofdihydroxyacetone production by a mutant of Gluconobacteroxydans[J]. Biochemical Engineering Journal, 2010, 49 (1): 61–67. |
| [19] | Hu ZC, Zheng YG. Enhancement of 1,3-DihydroxyacetoneProduction by a UV-induced Mutant of Gluconobacter oxydanswith DO Control Strategy[J]. Applied Biochemistry andBiotechnology, 2011, 165 (5/6): 1152–1160. |
| [20] | Hu ZC, Liu ZQ, Xu JM, et al. Improvement of1,3-dihydroxyacetone production from Gluconobacter oxydansby ion beam implantation[J]. Preparative Biochemistry andBiotechnology, 2012, 42 (1): 15–28. |
| [21] | Prust C, Hoffmeister M, Liesegang H, et al. Complete genomesequence of the acetic acid bacterium Gluconobacter oxydans[J]. Nature Biotechnology, 2005, 23 (2): 195–200. |
| [22] | Gätgens C, Degner U, Bringer-Meyer S, et al. Biotransformationof glycerol to dihydroxyacetone by recombinant Gluconobacteroxydans DSM 2343[J]. Applied Microbiology andBiotechnology, 2007, 76 (3): 553–559. |
| [23] | Li MH. Improvement of dihydroxyacetone production inGluconobacter oxydans by gene recombination[D]. Shanghai:Doctoral Dissertation of East China University of Science andTechnology, 2010 (in Chinese) 李明华. 基因重组技术优化氧化葡萄糖酸杆菌催化制备二羟基丙酮的研究[D]. 上海: 华东理工大学博士学位论文, 2010 |
| [24] | Matsutani M, Kawajiri E, Yakushi T, et al. Draft genomesequence of dihydroxyacetone-producing Gluconobacterthailandicus strain NBRC3255[J]. Genome Announcements, 2013, 1 (2): e00118–e00113. |
| [25] | Li H, Liu YP, Sun Y, et al. Isolation and indentification of astrain producing high 1,3-dihydroxyacetone[J]. IndustrialMicrobiology, 2013, 43 (4): 23–28. (in chinese) 李华, 刘宇鹏, 孙杨, 等. 一株高产二羟基丙酮菌株的筛选及鉴定[J]. 工业微生物, 2013, 43 (4):23–28. |
| [26] | Wu XS, Xia ZD, Yang XN, et al. Molecular simulation ofpyrroloquinoline quinine-dependent glycerol dehydrogenase inGluconobacter oxydans[J]. Molecular Simulation, 2012, 38 (12): 1010–1014. |
| [27] | Wu XS, Wang XY, Lu WY. Genome-scale reconstruction of ametabolic network for Gluconobacter oxydans 621H[J]. Biosystems, 2014, 117 : 10–14. |
| [28] | Wei DZ, Ma XY, Zheng Y, et al. Gene engineering bacteria forproducing dihydroxy acetone, constructing method, andapplication: CN, 101092604A[P]. 2007-12-26 (in Chinese) 魏东芝, 马兴元, 郑宇, 等. 生产二羟基丙酮的基因工程菌,其构建方法及其用途: 中国, 101092604A[P]. 2007-12-26 |
| [29] | Yang W, Zhou YJ, Zhao ZK. Production of dihydroxyacetonefrom glycerol by engineered Escherichia coli cellsco-expressing gldA and nox genes[J]. African Journal ofBiotechnology, 2013, 12 (27): 4387–4392. |
| [30] | Hu ZC, Liu ZQ, Zheng YG, et al. Production of 1,3-dihydroxyacetone from glycerol by Gluconobacter oxydansZJB09112[J]. Journal of Microbiology Biotechnology, 2010, 20 (2): 340–345. |
| [31] | Hu ZC, Zheng YG, Shen YC. Dissolved-oxygen-stat fed-batchfermentation of 1, 3-dihydroxyacetone from glycerol byGluconobacter oxydans ZJB09112[J]. Biotechnology andBioprocess Engineering, 2010, 15 (4): 651–656. |
| [32] | Grey C, Viloria-Cols M, Jungvid H, et al. Process developmentof oxygen-demanding reactions utilizing a simple design withparallel glass tube reactors–evaluated using Gluconobacteroxydans DSM24525[J]. Biocatalysis and Biotransformation, 2012, 30 (5/6): 441–445. |
| [33] | Hu ZC, Zheng YG, Shen YC. Use of glycerol for producing 1,3-dihydroxyacetone by Gluconobacter oxydans in an airliftbioreactor[J]. Bioresource Technology, 2011, 102 (14): 7177–7182. |
| [34] | Zhou YJ, Yang W, Wang L, et al. Engineering NAD+ availabilityfor Escherichia coli whole-cell biocatalysis: a case study fordihydroxyacetone production[J]. Microbial Cell Factories, 2013, 12 : 103. |
| [35] | Kumar GS, Wee Y, Lee I, et al. Stabilized glyceroldehydrogenase for the conversion of glycerol todihydroxyacetone[J]. Chemical Engineering Journal, 2015, 276 : 283–288. |
| [36] | Zheng MQ, Zhang SP. Immobilization of glyceroldehydrogenase on magnetic silica nanoparticles for conversionof glycerol to value-added 1,3-dihydroxyacetone[J]. Biocatalysis and Biotransformation, 2011, 29 (6): 278–287. |
| [37] | Zhu Y, Youssef D, Porte C, et al. Study of the solubility and themetastable zone of 1,3-dihydroxyacetone for the drowning-outprocess[J]. Journal of Crystal Growth, 2003, 257 (3/4): 370–377. |
| [38] | William C. Process for the production of dihydroxyacetone: US,4076589[P]. 1978-02-28 |
| [39] | Martínez-Gallegos JF, Burgos-Cara A, Caparrós-Salvador F, et al. Dihydroxyacetone crystallization: process, environmental,health and safety criteria application for solvent selection[J]. Chemical Engineering Science, 2015, 134 : 36–43. |
| [40] | Zheng YG, Hu ZC, Liu ZQ, et al. 1,3-dihydroxyacetoneproducing by microbiology: CN, 1821418A[P]. 2006-08-23 (inChinese) 郑裕国, 胡忠策, 柳志强, 等. 微生物法生产二羟基丙酮: 中国, 1821418A[P]. 2006-08-23 |
| [41] | Zhang XF. Studying on the bioconversion of glycerol intodihydroxyacetone by Gluconobacter oxydans[D]. Chengdu:Master’s Thesis of Southwest Jiaotong University, 2006 (inChinese) 张小飞. 氧化葡萄糖酸杆菌转化甘油生产二羟基丙酮的研究[D]. 成都: 西南交通大学硕士学位论文, 2006 |
| [42] | Feng P, Zhou JC, Xu YP, et al. Production of dihydroxyacetoneby continuous cultivation with membrane bioreactor[J]. Foodand Fermentation Industries, 2003, 29 (12): 40–43. (in chinese) 冯屏, 周家春, 徐玉佩, 等. 膜生物反应器连续发酵法制取二羟基丙酮的研究[J]. 食品与发酵工业, 2003, 29 (12):40–43. |
| [43] | Ma LJ, Lu WY, Xia ZD, et al. Extraction of1,3-Dihydroxyacetone from the Fermentation Broth[J]. Journalof Chemical Engineering of Chinese Universities, 2010, 24 (4): 620–625. (in chinese) 马立娟, 卢文玉, 夏振东. 发酵液中1,3-二羟基丙酮的分离提取研究[J]. 高校化学工程学报, 2010, 24 (4):620–625. |
| [44] | Ma LJ. Study of 1,3-dihydroxyacetone product bybiotechnology[D]. Tianjin: Doctoral Dissertation of TianjinUniversity, 2009 (in Chinese) 马立娟. 生物法生产1,3-二羟基丙酮产品研究[D]. 天津: 天津大学博士学位论文, 2009 |