1,3-丙二醇(1,3-propanediol,简称1,3-PD)是一种重要的化工原料,可用作溶剂、抗冻剂或保护剂、精细化工原料以及新型聚酯———聚对苯二甲酸丙二醇酯(PTT)和聚氨酯的单体。最近研究表明,PTT是一种新型聚酯材料,可用于地毯、工程塑料、膜及服装材料,因此全世界各大公司都竞相研发和试验以探索成本更低的1,3-丙二醇工业化生产途径。目前主要用化学方法合成1,3-PD,此方法需要在高温、高压及贵重催化剂存在的情况下才能实现。因此,设备投资大,技术难度高,产品分离纯化困难,特别是催化剂的制备较难,且产生CO等废气污染环境。而微生物发酵法生产1,3-PD具有条件温和、操作简单、副产物少、绿色环保等优点,所以这方面的研究成为当前国内外研究的热点[1,2]。
传统的微生物发酵法通常是以克雷伯氏菌(Klebsiellapneumoniae)、丁酸梭状芽孢杆菌(Clotridiabutyricum)等天然菌进行甘油的厌氧发酵生成1,3-PD。但该方法存在生产周期较长、甘油转化效率低、原料成本高等问题,是实现大规模应用前需要克服的障碍[3]。利用基因工程的方法将甘油转化为1,3-PD的相关酶即甘油脱水酶基因dhaB和1,3-丙二醇氧化还原酶基因dhaT在大肠杆菌中进行表达的研究在国外早有报导[4,5]。在此基础上结合代谢工程的原理和方法,以丰富且廉价的碳水化合物资源(如淀粉、葡萄糖等)为底物发酵生产1,3-PD的研究取得很好的突破[6]。利用工程菌生产1,3-PD具有生产工艺简单、成本低廉、副产物少、产物分离简单等优点,近年来已越来越受到国内外研究人员的重视[3,6]。
本实验室从2003年起先后在大肠杆菌中成功地表达了dhaB和dhaT基因[7,8],在利用基因工程菌生物转化甘油生成1,3-PD的研究中取得良好的进展。本实验侧重于重组菌株JM109/pSE dhaB dhaT在以甘油为底物生成1,3-PD发酵条件的探索,在微好氧条件下尝试以廉价的乳糖代替IPTG(异丙基硫代 β D 半乳糖苷)作为诱导物、以维生素B12代替辅酶B12,并对其工艺特点和发酵条件进行初步的研究,为规模化生物合成1,3-PD作有意义的探索。
1 材料和方法
1.1 菌种与仪器
重组质粒pSE380.dhaB和pSE380.dhaT由本实验室构建[7,8],大肠杆菌JM109为本实验室保存。
BeckmanDU640紫外可见分光光度器,用于600nm处进行细胞浓度检测。
发酵罐采用全自动的德国产品,型号为B BraunBiotechBioSTATDL30。
1.2 培养基
LB培养基(质量分数):蛋白胨1.0%、酵母膏0.5%、NaCl1.0%,pH7.0,用于细菌培养;
种子培养基:蛋白胨1.6%、酵母膏1.0%、NaCl1.0%,pH7.0,培养基中加入的氨苄青霉素(Amp)终质量浓度为100μg/mL;
发酵培养基:参照参考文献[5],每升含:甘油5g,葡萄糖5g,乳糖5g,Na2HPO46g,KH2PO3g,NH4Cl2g,NaCl0.5g,MgSO42mmoL,酵母粉5g,高压蒸汽灭菌;氨苄青霉素100mg,采用微滤膜过滤除菌;
补料培养基:每升含甘油20%,葡萄糖2.0%,乳糖2.0%,115℃灭菌15min;
维生素B12:添加量为发酵培养基终质量浓度10mg/L,采用微滤膜过滤除菌;
微量元素组分见参考文献[9],采用微滤膜过滤除菌。
1.3 含多顺反子的重组质粒的构建及产1,3-PD的代谢途径
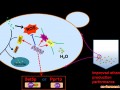
首先用PCR的方法从重组质粒pSE380.dhaT上扩增出含RBS(核糖体结合部位)序列的dhaT基因,连接于重组质粒pSE380.dhaB的多克隆位点中,构建由单个启动子trc带动两个基因表达的多顺反子(见图1),重组质粒命名为pSE dhaB dhaT,酶切鉴定含该多顺反子的重组质粒的正确性后,将它转化到大肠杆菌JM109中进行表达,尝试在大肠杆菌中构建一条新的类似于克雷伯氏菌(K pneumoniae)代谢甘油产生1,3-PD的代谢途径[10](见图2)。由于在此多顺反子中dhaB和dhaT这两个外源基因含有各自的RBS序列以及翻译起始和终止信号,所以能独立翻译出甘油脱水酶(DHAB)和1,3-丙二醇氧化还原酶(DHAT)两个异源蛋白(实验结果没有公开发表)。所运用的基因操作、质粒提取、大肠杆菌感受态细胞制备和转化等操作按参考文献[11]进行。
图1 含dhaB基因和dhaT基因多顺反子构建图

1.4 重组菌株JM109/pSE dhaB dhaT以甘油为底物发酵生产1,3-PD
将重组菌株JM109/pSE dhaB dhaT单菌落接种到含有Amp(100μg/mL)的LB培养基中,培养过夜,第2天以2%(体积分数)的菌液量接种于种子培养基中,30℃振荡培养至OD600为0.5~0.7时,再以4%(体积分数)量接种于盛有20L发酵培养基的发酵罐中,搅拌转速250r/min,37℃发酵培养60h,发酵8h后开始流加补料培养基,每隔2h取2mL发酵液进行细胞浓度检测;并对发酵液离心取上清液,以气相色谱仪监测甘油和1,3-PD的含量。在发酵过程中,通过流加补料培养基的方式将甘油质量分数控制在1.0%~1.5%,以40%(质量分数)柠檬酸和5mol/LKOH来控制发酵液pH为7.0。
1.5 1,3-PD的气相色谱分析
色谱工作条件:日本岛津GC 9A气相色谱仪,氢火焰离子化检测器,色谱柱为内径3mm,长2m不锈钢柱,填充国产高分子微球GDX 101(60.80目)为固定相;汽化室温度为290℃;检测室温度为220℃;载气:氢气600mL/min,空气400mL/min。进样量为1μL,分别以1%(质量分数)分析纯1,3-PD和甘油为标样测定1,3-PD和甘油的含量。
2 结果与讨论
2.1 重组菌株以甘油为底物发酵产物的分析
发酵期间每隔2h取样,分别进行发酵液中的1,3-PD浓度、菌体密度、甘油含量指标的测定,图3为发酵液的气相色谱图,可见1,3-PD和甘油的保留时间分别为1.87min和4.19min。

2.2 重组菌在发酵罐中的发酵动态
图4为重组菌在发酵罐中的发酵动态曲线,发酵温度37℃,发酵历时60h。在发酵24h左右得到菌体的最大OD600值为35.2,发酵10h时开始检测到1,3-PD。整个发酵过程甘油总消耗量约860g,重组菌株在60h时1,3-PD的产量到达最高值,约为15.34g/L,共计307g,甘油总转化率为35.7%。

2.3 甘油脱水酶与维生素B12
在生物转化甘油生成1,3-PD的代谢途径中,甘油脱水酶在辅酶B12存在的情况下催化甘油脱水生成中间产物3.羟基丙醛(3.HPA),再由1,3-丙二醇氧化还原酶将3.羟基丙醛(3.HPA)催化生成1,3-PD,因此辅酶B12对甘油脱水酶的活性有着非常重要的作用,来源于克雷伯氏菌的甘油脱水酶完全依赖辅酶B12作为辅酶才能产生活性[4,5]。由于辅酶B12价格昂贵而无法进行大规模应用,加上大肠杆菌不能从头合成辅酶B12,只能在以钴啉醇酰胺物质作为前体并在诱导条件下启动自身的cob调节子合成辅酶B12,所以在用重组大肠杆菌表达甘油脱水酶发酵生成1,3-PD过程中,在培养基中加入终浓度为10mg/L的维生素B12,可以作为合成辅酶B12的前体,使甘油脱水酶得以重新激活[10,12,13]。本研究通过更加廉价的维生素B12代替辅酶B12进行发酵,结果如图4,有1,3-PD产生和积累,但产量比较低。
2.4 表达载体pSE380的trc启动子
在大肠杆菌中高效地表达异源蛋白,必须将相关基因置于可诱导的强启动的控制之下[14]。在表达载体pSE380中,含有由启动子tac改组而来并可用IPTG诱导的杂交型强启动子trc[15]。本实验将外源dhaB基因和dhaT基因构建由单个启动子trc带动的多顺反子表达质粒,它可以在大肠杆菌中进行IPTG诱导表达,并能独立翻译出具有很高生物活性的DHAB和DHAT两种异源蛋白(实验结果没有发表)。由于IPTG对细胞具有毒性并且价格昂贵,限制了它在工业化生产中的应用,Hsih等[16]报导可以用乳糖作为诱导物来代替IPTG对启动子tac和trc进行诱导。本次发酵首次补加乳糖而不是IPTG作为诱导物,对基因的诱导表达有一定的效果。从图4可以看出,重组大肠杆菌培养10h后开始有1,3-PD产生,并呈直线上升趋势,到60h时1,3-PD产量达到最高值。
2.5 氧对转化的影响
一般情况下,氧的存在不利于1,3-PD产生,因为氧引起代谢途径中两个关键酶,也是本研究构建重组质粒所表达的两个酶即DHAB和DHAT失活[17,18]。但在厌氧条件下,并不利于大肠杆菌宿主的生长。为了解决有氧对酶失活的影响和厌氧对宿主生长不利的矛盾,我们在上罐发酵过程中于前期供给少量的氧,可以得到较高的菌体生长密度,即发酵24h时菌体OD600为35.2,在发酵后期的转化阶段,停止通入空气(也不补加H2和N2),这样就可以将溶氧控制在30%以下。研究表明在微氧条件下,所采用的重组菌依然能转化甘油生成1,3-PD,如图4。
2.6 甘油浓度对转化的影响
甘油脱水酶不仅对氧敏感而容易失活,而且在有甘油存在时,它也会发生自杀失活(suicideinacti vation),当有激活蛋白、ATP、Mn2+或Mg2+、辅酶等因子共同作用下可以将失活甘油脱水酶重新激活[10];也有研究表明,以含有克雷伯氏菌dha调节子的重组大肠杆菌进行厌氧甘油发酵时,过高的甘油浓度会增加3.磷酸甘油(G3P)的积聚从而明显抑制菌体的生长和1,3-PD产生,当培养基中甘油质量分数达到0.5%时,开始呈现出这种影响[19]。由于甘油浓度过低也不利于1,3-PD的生成[20],所以在发酵过程的中后期通过匀速流加20%(质量分数)的甘油,使甘油维持在1.0%(质量分数)左右,有利于1,3-PD的生成。同时补加适量的葡萄糖作为菌体生长的优先碳源,以提高甘油的转化率。
3 结 论
在大肠杆菌JM109中成功地用克雷伯氏菌(K pneumoniae)的甘油脱水酶基因dhaB以及1,3-丙二醇氧化还原酶基因dhaT进行了共表达,所构建的工程菌能转化甘油产生1,3-PD,使原来不产1,3-PD的大肠杆菌能发酵甘油生成1,3-PD。对所构建的重组菌JM109/pSE dhaB dhaT进行小体积发酵研究,尝试在不添加IPTG而是用廉价的乳糖作为诱导物、以维生素B12代替昂贵的辅酶B12进行微好氧发酵的探索。初步研究结果表明,1,3-PD产量为15.34g/L,甘油转化率为35.7%。尽管1,3-PD产量比用克雷伯氏菌(K pneumoniae)原始菌株发酵的最高产量73.3g/L[21]还有很大差距,但可以通过优化发酵条件(优化培养基成分、补加适量的葡萄糖、控制溶氧量、改变诱导物、保持合适的菌体密度等)来大幅度提高1,3-PD的产量。同样,该重组菌在营养要求简单、不需要厌氧环境等复杂的发酵工艺方面显示很好的应用前景。
美国杜邦公司将甘油生产菌酿酒酵母(Saccha romycescerevisiae)中3-磷酸甘油脱氢酶基因DAR1、3-磷酸甘油脂酶基因GPP2以及克雷伯氏菌(K pneumoniae)的甘油脱水酶基因dhaB、大肠杆菌中非特异性的氧化还原酶基因yqhD在一株大肠杆菌中共表达,该工程菌能转化廉价的葡萄糖直接生成1,3-PD,其产量高达129g/L[22],这是目前文献报道的最高产量。本实验室和南宁中诺生物工程有限责任公司合作,已采用类似的技术路线,利用来自于丁酸梭状芽孢杆菌(C butyricum)等的甘油脱水酶基因进行基因工程菌的构建,利用葡萄糖作为原料直接发酵产生1,3-PD的实验也已获得成功,结果将另文发表。
本研究采用重组菌发酵仅仅是生物转化葡萄糖生成1,3-PD过程中甘油转化阶段的一个探索。它是在不需要IPTG为诱导物,不直接添加辅酶B12为辅酶,不需要严格厌氧环境下得出结果,这将为发酵法合成1,3-PD的研究提供新的有现实意义的思路。
参考文献:略