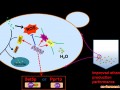
二羟基丙酮(dihydroxy acetone,DHA)作为重要的化工、生化原料在精细化工、食品工业、化妆品工业和水质净化等方面潜在着广泛的应用前景,例如,以DHA为主要成分的保鲜剂可用于果蔬、水产品、肉制品的防腐保
鲜[1~3]。微生物发酵法制备可应用于食品工业领域的DHA已引起人们的关注。其中以甘油为底物,用醋酸杆菌AcetobacterSuboxydans间歇发酵生产 DHA已有报道[3],但因底物和产物的反馈抑制导致产率不高。虽然有多级反应器连续发酵生产DHA可使这一问题在一定程度上得到改善,但仍存在有底物和产物的抑制作用[4]。利用膜生物反应器(MBR)连续发酵制取二羟基丙酮,可在有效地实现在生物反应的同时进行产物的分离,即在同一反应体系中同时实现菌体积累和产物转化。通过膜的选择性滤过作用,即时引出产物,使菌体和产物DHA随时实现分离,避免了产物DHA在菌体细胞周围的高浓度积累,消除了产物对菌体的抑制。可使生物转化的平衡反应向所需方向移动从而获得较高的催化稳定性;并得到不含细胞的澄清透过液,使反应和分离同时进行,大大简化了后续分离纯化过程[5]。笔者以醋酸杆菌Acetobacter Suboxy-dans间歇发酵合成DHA为基础,研究了在MBR连续培养过程中菌体生长特性和各基本参数的影响,进行了甘油生物转化DHA条件的优化, 实验证实了醋酸杆菌在MBR中连续发酵的可能性。
1 材料与方法
1.1 菌 种
本研究所使用菌种AcetobacterSuboxydans由俄罗斯国家遗传和育种研究所提供。
1.2 培养基
种子培养基:葡萄糖30 g/L,玉米浆5·0g/L,蛋白水解液2·0g/L,(NH4)2HPO31·5g/L,MgSO40·25g/L,甘油10g/L。
发酵培养基:玉米浆5·0 g/L,蛋白水解液5·0 g/L,K2HPO42·0 g/L,(NH4)2HPO41·0g/L,MgSO40·25g/L,甘油30~90g/L。
1.3 间歇发酵条件
将冰箱保藏的菌种接种于装液量为100mL种子培养基的500 mL三角瓶中于摇床上30℃、200r/min和pH5·5的条件下,培养18~20h。上述种子培养液按5%接种量接入装有100mL发酵培养基的 500mL三角瓶中,于摇床上30℃、200 r/min和pH5·5时,培养70~80h。
1.4 连续发酵条件
连续培养在工作体积 0·3 L,带有可引出装置的超滤膜组件的中空纤维膜管的连续培养系统(见图1)中进行,工作面积0·0m2,反应温度30℃,用5% NaOH调节pH5·5。连续发酵的种子培养与发酵初始条件同间歇发酵。当菌体生长至对数期,开启连续反应装置。通过蠕动泵,不断加入新鲜培养液,并同时通过膜组件滤出等量体积的不含菌体细胞的澄清发酵液。培养时间从理论上可无限延长,研究中由于时间和技术等原因,连续发酵持续250~400h。
1.5 分析方法
菌浓度用比色法(λ=490 nm)和绝对干重法测定[6]。二羟基丙酮用亚砷酸盐滴定法测定[7]。甘油含量用高碘酸氧化法测定[8]。
2 结果与讨论
2.1 间歇发酵结果
用醋酸杆菌在初始质量浓度为6g/L的甘油的培养基中进行间歇发酵,发酵曲线如图2所示。从图2可见,在发酵初期主要表现为菌体细胞的增长,菌体的比生长速率μ很高, DHA的合成随着μ的减小而增加,当细胞生长进入稳定期,μ接近于零时,DHA的合成达到最大值,随后进入衰亡期,菌体浓度和DHA浓度下降。发酵过程为 80h,最高菌体浓度为4·82 g/L,DHA浓度为53·2 g/L,甘油转化率为88·9 g/L,生产强度(体积产率)为0·761g/(L·h)。
在醋酸杆菌A·suboxydans氧化甘油生成DHA的过程中,定位于细胞膜上的脱氢酶系起了重要的作用[9]。细胞质内膜在稳定期大量生成和定位于膜上的脱氢酶的活性的增加引起细胞氧化活性提高。A·suboxydans在菌体细胞减缓生长或完全停止生长时,仍可氧化甘油生成DHA,并具有较高氧化活性,从而使A·suboxydans在MBR中长时间维持在稳定期时,有较高的氧化活性,转化甘油生成DHA。
2·2 连续培养结果
2·2·1 膜生物反应器中的连续培养
连续培养在工作体积0·3 L,带有泵超滤膜组件的中空纤维管的连续培养系统中进行。培养基中甘油初始浓度为30 g/L,稀释率为0·067h-1,菌体生长曲线见图3。在接种开始后20h内菌体浓度和DHA浓度明显增加,在20 h时达到最高,相应菌体浓度为0·92g/L,DHA浓度为9·6 g/L,随后马上观察到菌体浓度和DHA浓度降低,在25 h达
到最低,分别对应于0·77 g/L和6·3 g/L。随后菌体浓度和DHA浓度又逐步增加,直至进入稳定期,相对应值为3·24g/L和19·3g/L。由图3可见,在MBR进行连续培养的过程中, 在恒定的参数下,微生物生长曲线除了延缓期、指数期、对数期和稳定期,还存在一个过渡期,其特点是菌体和DHA浓度的
下降和马上随之而来的上升。这可能是由于新鲜培养基的加入使所有组分浓度增加和菌体适应的迟缓性造成生命活动的暂时下降所应起的。与单批发酵不同,在MBR连续发酵中稳定期的延长, 使DHA的积累在较长的时间内进行,提高了菌体使用率。在稳定期虽然恒定地向菌体引入培养基各组分,并同时不断分离出代谢产物,但菌体数量并不发生增加, 大部分的营养基消耗于细胞以ATP的形式积累能量,和与此同时发生的DHA的生物合成及部分的菌体细胞修复。此时,菌体浓度和DHA的浓度均保持恒定。
这证实了醋酸杆菌A·suboxydans在菌体细胞减缓生长或完全停止生长时,仍可氧化甘油生成DHA。
稳定期理论上可以无限期存在,实验中也证实在较长的培养时间内(250h)没有发生变化。
2·2·2 不同甘油浓度对连续培养的影响
底物甘油浓度是影响连续发酵过程菌体生长的重要因素。改变培养基中甘油的初始浓度30、60、90 g/L,其他培养条件不变。甘油的初始浓度为60、90 g/L时,微生物生长曲线具有和30 g/L时相类似的特性。各项参数见表1。
从表1可见,甘油浓度从30g/L增加至60g/L,稳定期的菌体浓度,DHA浓度、体积产率都随之显著提高;甘油浓度继续提高至90g/L,DHA的浓度增加幅度不大,只从32·5g/L提高至37·5 g/L。从中可知,在高浓度的甘油时,消耗于菌体维持的能量增加,这和高浓度的甘油对菌体的生长和代谢有一定的抑制作用有关。因此,较为合理的甘油初始浓度为60g/L,体积产率为2·18g/(L·h),是单批发酵(0·761g/(L·h))的2·86倍。
2·2·3 限制性基质对连续培养的影响
在利用MBR连续培养时,决定甘油转化成DHA的主要参数除了底物甘油浓度外,还有在初始培养基中限制性营养基组分、玉米浆和蛋白水解液的初始浓度。改变在初始培养基中玉米浆和蛋白水解液的浓度从5·0g/L到0·5g/L,在甘油浓度为30 g/L,稀释率为0·067 h-1时,连续发酵时间400h,其实验结果见图4。
从图4中可见,在改变玉米浆和蛋白水解液的浓度从5·0g/L到0·5时g/L,并没有发生菌体生长和DHA积累的明显变化,菌体浓度在整个实验过程中并没有下降,DHA的浓度随玉米浆和蛋白水解液浓度的下降而略有下降,尤其是当浓度从 2·5 g/L降低到0·5g/L时。证明了在连续培养中,培养基中的营养成分主要用于维持菌体生命活动,此外也用于细胞的修复过程。而后者又和培养基中的生长元素的存在密切有关,与维持细胞生长相比,所需的生长因子的浓度要低得多。
在连续发酵中可维持较低的玉米浆和蛋白水解液的浓度,如0·5g/L。降低生长因子在培养基中的含量,可以降低原料消耗、减少成本,简化后续的分离过程。
2·2·4 稀释率对连续培养的影响
稀释率也是决定在MBR中菌体生长情况和生物转化的重要参数。在培养基甘油初始浓度为30g/L时,改变稀释率,从0·033/h增加到0·067/h,发现菌体浓度和DHA的浓
度及体积产率的增加,在此范围里,菌体合成
速度和生物转化活性增加。随着流速进一步从0·067/h增加到0·100/h,DHA的浓度和转化率下降,可能是由于过高的流速,导致加入过多的新鲜培养基,而使各组分浓度增加,使菌体适应性下降,造成生命活动和代谢能力下降。因此,对于连续发酵较适宜的稀释率为0·067/h。
3 结 论
(1)利用膜生物反应器可连续发酵制取DHA,其体积产率较间歇发酵提高2~3倍,连续发酵时间为400h。
(2)改变膜生物反应器连续发酵时,底物甘油浓度、培养基配比和流速,将影响菌体生长特性和DHA的合成。本研究连续发酵制取DHA的最适条件为甘油浓度60g/L,稀释率0·067h-1,玉米浆和蛋白水解液浓度为0·5g/L。

在线客服
QQ咨询
电话咨询 13720223167
13720223167
扫码咨询