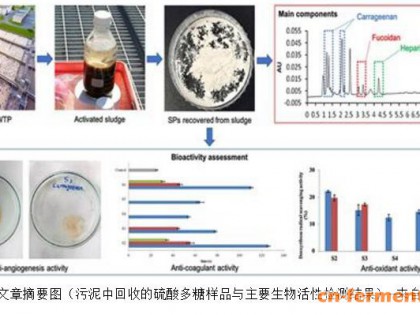
生物表面活性剂是生物(主要是微生物)合成的低分子量、有表面活性的物质,包括糖脂、多糖脂、脂肽、脂蛋白以及中性类脂衍生物等[1]。它们的分子结构主要由两部分组成:一部分是疏油亲水的极性基团,如单糖、聚糖、磷酸基等;另一部分是由疏水亲油的碳氢链组成的非极性基团,如饱和或非饱和的脂肪醇及脂肪酸等。和传统的化学合成表面活性剂相比,生物表面活性剂不仅因合成过程及原料简单在成本上占优势,而且在本身物理化学性质如表面活性、界面活性和破乳性等方面也有明显的优势[2],其已成功应用于增强油类提取(MEOR)、加快被油污染的海面或土壤的油类降解、修复重金属污染的土壤和地下水等[3];同时生物合成的表面活性剂还有比化学合成物在自然界中更易被降解的特点。因此,我们可以推断:在不久的将来,生物表面活性剂在许多方面可以逐渐替代化学合成的表面活性剂。
有关生物表面活性剂的研究最早见于1946 年,ZoBell[4]提出:微生物产生的表面活性剂是微生物提高石油采收率的重要机制之一。20 世纪 60 年代之后,微生物对烃类乳化机制的研究引起了科学家们的广泛关注,微生物生产表面活性剂也成为生物技术领域中的一个新课题。随着基因工程技术的飞速发展及其广泛应用,微生物产表面活性剂的机制得到了更深入的研究。Nakano 和 Zuber 等[5]发现了与表面蛋白生物合成基因有关的 3 个基因: srfA、srfB 和 srP,并分离到一株在 srfB 位置发生突变从而增加表面活性蛋白产量的菌株。Kim 等[16]将.sfP.基因导入.Bacillus subtilis.并表达,发现该基因能够诱导.Bacillus subtilis.生成表面活性剂。本文主要从分子生物学水平介绍国内外生物表面活性剂合成机理的研究进展。
1 不同发酵条件对活性剂合成的影响
碳源和溶氧条件是生物表面活性剂产量的主要影响因子[7]。培养基中的碳源是决定微生物表面活性剂产量和结构的重要因素,有的微生物仅在烃类培养基上生长时才产生生物表面活性剂,但也有的只需要一些糖类和氨基酸就可以产生。钱欣平等[8]将菜油作为大规模生产生物表面活性剂的首选碳源,铜绿假单胞菌则在两类基质中都能产生表面活性剂,但是在烃类基质中产量更高一些,烃链长度对培养基中产生表面活性剂的浓度也有显著影响。培养基中的其余成份对生物表面活性剂的生产也有重要影响,例如 C/N 可以决定假单胞菌对糖脂的生产;NaNO3 是石蜡酪杆菌 B126 (Caseobacterparaf-finicum B126) 合成糖脂的适宜 N 源,用铵盐作 N源则产量较低[9];培养基中加入抗生素,如青霉素或氯霉素等,同样能够影响表面活性剂的产量。细微的培养条件的改变都可能影响生物表面活性剂的合成,因此,实际操作中需要综合考虑各种因素来得到最优发酵条件。
2 底物的变化过程
P. aeruginosa 在含油脂的培养基中主要产生两种鼠李糖脂类表面活性剂:单鼠李糖脂和双鼠李糖脂,在它们的合成过程中,都要经过两个连续的鼠李糖基转移过程,它们分别由两个鼠李糖基转移酶来催化,这两个酶分别为.Rt1 (Rhamnosyl transferase1)和 Rt2(Rhamnosyl transferase 2)。其中,Rt1催化前一个反应,它以TDP-L-鼠李糖(deoxy-thymidine-diphospho-L-rham-nose)为鼠李糖基的供体,以β-羟癸酰-β-羟癸酸(β-hydroxydecanoyl-β-hydroxydecanonate)为受体来合成单鼠李糖脂;Rt2 催化后一个反应,它也以 TDP–L-.鼠李糖为鼠李糖基的供体,但不同的是以单鼠李糖脂为受体来合成双鼠李糖脂。在它们的合成过程中产生一定比例的不同长度的烃类,种类从 C10 到 C18 多达28 种,这表明酶 Rt1 和 Rt2 对 β-羟癸酰半族的专一性不高。Rt1 是由基因 rhlA 和 rhlB 所编码的两条前体多肽组合而成的,其功能方面目前人们还不清楚它的.β-羟酸底物到底与 ACP 或 CoA 中的哪个及怎样相关联。通过对不同宿主产生鼠李糖脂的研究,得到的初步证据表明:Rt1 的底物与 ACP和 CoA 都有关联。Rt2 由 rhlC 基因编码,该酶和脂多糖 (LPS) 生物合成中的鼠李糖基转移酶是同源的。TDP-L-鼠李糖作为鼠李糖半族合成单鼠李糖脂和双鼠李糖脂的供体的同时,也是所有细胞中都有的多聚体糖-L-鼠李糖的合成前体。编码催化1-磷酸葡萄糖合成.TDP-L-鼠李糖的酶的基因 rml在许多细菌中被发现。algC 基因编码一个磷酸甘露糖变位酶(AlgC),该酶能够催化变位反应,例如该酶可将6-磷酸甘露糖转变为.1-磷酸甘露糖。
Olvera等[10]报道称 AlgC 在鼠李糖脂的生物合成中起了非常重要的作用,因为它能够催化.1-磷酸葡萄糖的合成,而.1-磷酸葡萄糖是.dTDP-葡萄糖和最终产物dTDP-鼠李糖的合成前体。人们也尝试用不同宿主来生产鼠李糖脂,但是几乎没有成功过,即使成功,产量也非常少,主要原因正如我们所提到的,酶 Rt1 和 Rt2 的底物都是在新陈代谢过程中产生的复合物。因此,如果要在不同宿主中产生高水平的鼠李糖脂,就有必要建立一个新陈代谢调控机制,该机制要能保证过量产生.TDP-L-鼠李糖以及.β-羟基化脂肪酸。
3 基因组分析
表面活性剂生物合成中的一个必需基因是一个长达 25 kb 的被称为 srfA 的操纵元 (图1)[11~19],它负责编码催化表面活性蛋白合成的几个酶。srfA的突变株不仅中止合成表面活性蛋白,而且还影响细胞利用异种 DNA 和形成孢子的能力,因此这个操纵元表达的蛋白质在细胞特化和分化中有重要作用。srfA 包含 4 个模式化的开放阅读框:ORF1(srfA-A),ORF2 (srfA-B),ORF3 (srfA-C) 和 ORF4(srfA-D),前面 3 个阅读框架分别编码 3 个酶E1A、E1B 和 E2,这 3 个酶对于鼠李糖脂的合成是必要的。
2个编码.L-亮氨酸异构酶的基因位于操纵元srfA-A.和.srfA-B.的.3′.端,这.2.个异构酶和其他公认的细菌的消旋酶在序列上有一致性。srfA-B.包括comP 和 comA 基因,它形成一个信号转导系统,并调节.srfA.的转录。在.srfA-C.基因的末端,有一个区域 (thioesterase,TE) 编码.1.个和脂肪酸 I 型TE 相一致的酶。另一个.TE.区域,就是相对应于第4.个阅读框架. (srfA-D) .的部分,编码.1.个序列上和d-(-a- aminoadipyl)-cyst-einyl-D-valine.合成酶以及哺乳动物细胞的 II 型 TE 同源性较高的蛋白。该TE 区域一直被认为和内酯化过程有关,与第一个区域不同是,该区域并不是表面活性剂的生物合成所必需的。srfA 操纵元是在菌体指数生长后被诱导起作用的,并且它的表达依赖于.comA.基因,该基因原先称为.srfB.基因,它是细菌完成全部发育所需的一个早期基因;其产物 ComA.蛋白的活性是受蛋白激酶 ComP 的磷酸化来调控的。ComA.蛋白和.ComP蛋白可能形成一个复合体,该复合体直接绑定在srfA.启动子上,并且依据培养基中葡萄糖和谷氨酸盐的浓度来正相关调节该启动子的转录水平。最后,两个群体感应机制的交互作用,并且通过两个胞外信号肽来调控 ComA.的磷酸化。在.srfA.操纵元下游.4 kb.远的.sfp.基因,参与该操纵元但没有包含在srfA.内,sfp 基因是表面活性剂生物合成中的第二必要基因,它的核苷酸序被 Nakano.等人[12]于 1992. 年 测 出 , 该 基 因 合 成 酶 Sfp. 属于.4′-PPTases.类。
胞外质粒对微生物表面活性剂的合成也有影响。如乙酸钙不动杆菌[15](Acinetobacter caluoacetiuxKA57) 在原油污泥上生长时出现 4 种质粒。质粒Psr4 控制着这种微生物利用原油基质。这个 20 kb的质粒编码了一个与细胞表面紧密相连的因子,从而使细胞能与烃类基质产生生理作用。在食油假单胞菌 (Psedomonas oleovorans) 中位于 OTC 质粒的.alk BAC 基因编码了一个烷烃末端羟化和脱氢所必需的烷烃利用系统[15],alk BAC.操纵元中调节基因和结构基因在恶臭假单孢菌 (Pseudomonasputida) 和大肠杆菌 (E. coli) 中的异源表达使这些微生物能以正辛烷为唯一.C.源和能源而生长。铜绿假单胞菌中乳糖基因的表达使其能够依靠乳糖或者干酪乳清生长并产生鼠李糖脂,其 rhlABR 基因簇编码合成鼠李糖脂需调节蛋白.rhl R.和鼠李糖苷转移酶.RhlAB。
4 转录水平调节
P. aeruginosa 能产生许多种类的毒素和水解酶的特性一直和它的致病性相关。这些胞外产物包括:不同的蛋白酶、磷脂酶C、外毒素A、鼠李糖脂以及花青苷,所有的 P.aeruginosa 无论是临床的还是环境中的, 都能产生鼠李塘脂,并且在所有的已经研究过的情况中,生物表面活性剂都是在那些同时产生其他外源性有毒性物质的环境条件下产生的。对所有这些产物来说,它们的表达都是在转录水平上受两个群体感应系统调控的。这些易于扩散的被称为自体诱导物的物质,在高细胞浓度条件下,能相互起作用,并激活一些转录调节物。这些细菌自诱导物是.N-.酰基丝氨酸内脂 (HSLs),是不同长度酰基的替代物。在.P.aeruginosa 中人们发现了两个自诱导介导的转录途径:其中一个依赖.N-(3-.氧化癸酰基)-HSL,该物质是以.lasI 基因的产物为底物来合成的。在这条路径中,蛋白 LasR 和 N-(3-.氧化癸酰基)-HSL 一起作用活化合成胰肽酶E、碱性蛋白酶和 LasA 蛋白酶基因的转录。另一个自诱导物调节途径,受由 RhlI 蛋白合成的.N- butyryl-HSL调控。该路径中,通过蛋白 RhlR 的激活来促进pyocyanin 的过量表达来提高其产量,rhlAB.基因编码蛋白.Rt1 和 RpoS,细菌生长稳定期所表达的基因中,包括了编码.RNA.聚合酶.δ.因子的基因。依赖于 RhlR 蛋白的群体感应,包括鼠李糖脂的生产,主要都是在营养受限的条件下表现出来的。第三个群体感应转录水平调节物为蛋白 PhzR,人们在.P.aeruginosa PAO1.的染色体中也发现了该物质。但它在鼠李糖脂生产过程中的调节的具体细节还不清楚。人们已经知道一些在编码鼠李糖脂以及其前体物质合成中起作用的酶的基因,如:rhlC、rml 以及 rhlG,这些基因的表达受蛋白 LasR 或 RhlR 的影响,也受其他转录水平上的调节物的调节 。我们可以看出.P.aeruginosa 的鼠李糖脂合成中的遗传调节网有很大的复杂性,这在调节、构建产高效表面活性剂的菌中有重要作用,从这个角度看,为满足商业上对表面活性物质的要求,构建能产生生物表面活性剂的不同宿主是非常重要的。
5 酶的催化
关于表面活性剂生物合成的研究开始于1998年,Kluge 等人[15]提出了一个非核糖体合成的多酶机制,由一些硫化物作为模板构成了生物表面活性剂合酶;和其他微生物多肽合酶一样,该模式建立在多载体假说的理论基础之上(多载体假说认为酶的载体是由一些.4′-泛酰巯基乙胺化物共同起作用,而不是一个单独的臂)。Vater.小组成员[16]首先分离了表面活性剂合酶的 4 个亚基,并且确认了它们的一些催化特性。已有的证据表明表面活性剂合酶完全处在细胞质内,有 3 个高度纯化的酶已被从细胞内提取物中纯化出来:分别命名为E1A、E1B 和E2,其大小分别为.460 kDa、435 kDa 和.160 kDa;另一个被称为.E3.的大约.40 kDa.大小的片段,是唯一的一个没有被纯化的酶,体外实验表明活性剂生物合成的起始物是.β-羟酰L-谷氨酸酯,并且第一步反应的酶是一个包含.E3.的酰基转移酶。E1A.和E1B 亚基催化初始产物链的延长,通过一系列硫酯键的裂解和同时进行的转肽反应,使初产物从三脂肽延长到十六脂肽,最后由酶.E2.催化亮氨酸残余片段.7.的浓缩,并且将剩余的中间媒介七肽脂从蛋白中释放出来。基于表面活性剂合酶中不同亚基协同合作这样一个事实,我们可以把这个合酶定义为一个整体,这个整体携带了细胞生长发育和成熟过程中所必需的大部分分子信息[17]。生物化学和遗传学分析表明:E1A、E1B 以及 E2,各自对应.srfA-A,srfA-B.以及.srfA-C.形成了一个.7.个模块的线性阵列(每个残基对应.1.个模块),它们影响的顺序决定了活性剂上各基团的排列顺序,每一个模块本身都是由不同功能区域组成的,而且这些区域是由高度保守的基序以一定的排列方式形成的,并且它作为接触独立单元参与反应。在这样一个系统里,脂肪酸半族在和谷氨酸结合前被活化成辅酶.A.的衍生物,另外,在被羧基硫酯键共价结合到酶连硫苷上之前,这.7.个组成性氨基酸分属于.7.个氨基酸活化区,依赖于.ATP.的腺苷酸转移酶激活。但定点突变实验表明:在蛋白质的肽基连接区域,有一些富含丝氨酸残基的.LGGH,DSL.以及.I.等依赖于硫酯的结构域,每一个结构域都是通过一个 4′-磷酸泛酰巯基乙胺基团为连接物来激活氨基酸底物的。这个连接物在翻译后通过一个.4′-磷酸泛酰巯基乙胺转移酶 (4′-PPTase) .来起作用,使这.7.个没有活性的分子转变为完整的有催 化肽键形成活性的分子。人们推测,在肽链蛋白区域的下游,紧接着存在一些别的区域,这些区域控制肽键的形成,并且使差相异构作用分散开来,因此 3 位和 6 位的亮氨酸残基在连接到延伸着的肽链后并在链继续延长之前进行异构化作用。不同的分子相继控制肽链的延伸,直到它被一个硫酯酶.srfA-TE.所切开,并融合到最后一个有活性的区域的.C.末端的后面。接着,肽链的折叠被一个随后而来的分子内酯化所稳定,然后 去初始化.β-OH 脂肪酰半族,这其中也可能有另一个被称为 srfA-D.硫酯酶参与。尽管如此,并没有迹象表明这两个反应有先后顺序或有什么关联。关于Cβ.蛋白的立体结构的研究又让人们提出了一个假设,该假设推测:这样一个典型的几何结构在其环闭合时需要有最小距离的运动,并且最值得注意的是,在第一个活性区域之前有一个参与到酰基转移中的浓缩结构域。生物表面活性剂的产量,除了可能受两个关键酶如酰基转移酶和.4′-磷酸泛酰巯基 乙胺转移酶所引起的初级调控外,也可能受一系列其他胞内酶的互相作用的调控。
6 基因重组技术的应用
因为生物表面活性剂是一个典型次级代谢产 物,所以细菌在合成活性剂时常常合成一系列相关的复合物。因此,在绝大部分生物表面活性剂产生菌的发酵液中,除了主要产物表面活性剂外,也含有至少一种低浓度的肽基变体产物。人们通过向培养基中加入特定的氨基酸,来认识微生物的表面活性剂合成能力,通过大量研究,使用了许多种氨基酸包括非蛋白组分的 L-己氨酸等,发现只有 L-氨基酸残基的 2、4 和/或 7 位可以被替代,并且 4 位的可变性最大。人们从 Bacillus licheniformis 中发现 一个化合物的变体,它类似于活性剂,在其脂性尾端的长度上有微观不均匀性,而且在肽链上有相同的可变区,但是它的 1 位和 5 位不是活性剂的酸性残基,而是氨基。在这个家族的所有种类中只有 D- 氨基酸残基位点有高度的保守性,因此我们推测它们在通过减少结构限制来进行闭环中有重要作用。 Stachelhaus 等人[20]于 1995 年描述了基因重组技术在生物合成上的最初应用,该过程被称为靶定变换结构分子的序列,他们利用两个不同的肽键合酶,通过两步重组反应来获得特定产物,重组酶作用产生了在 2 位或 7 位含有不相关氨基酸的重组的活性剂,这个策略的更广泛用途的研究也正在进行中。通过有目的地把 TE 半族移动到 sfrA 基因中的更深处,可以使新分子的生物合成工艺更加方便。
7 合成过程初探
借助于代谢工程和基因工程的相关知识,确定具体的生物合成路径将有助于了解生物表面活性剂的生理功能。生物表面活性剂中脂肪酸部分的合成单体是乙酰 CoA 或者是烃的氧化中间体,乙酰 CoA是关键的合成中间体。在研究鼠李糖脂合成的相关基因时,利用分子克隆及核苷酸序列分析技术,首先选育出鼠李糖脂合成的缺陷型菌株,分离得到鼠李糖脂生物合成的相关基因,然后将其与野生型菌株的基因实行基因互补。分析发现,当鼠李糖脂的合成单体 (TDP-鼠李糖和相应的脂肪酸) 在细胞内已经存在时,鼠李糖脂的最终合成将被鼠李糖苷转移酶所催化。这类酶共有 2 种,负责催化 4 种鼠李糖脂的生成。而鼠李糖苷转移酶由 rhlAB 基因编码,与 rhlAB 基因位于同一个操纵元上的 rhlR 基因和rhl1 基因顺序排列,负责调控 rhlAB 基因的表达。RhlR 调控蛋白的活性受细胞密度以及由 Rhl1 蛋白形成的一种自诱导剂的影响。rhl1 基因缺陷的变异菌株不能合成鼠李糖脂[18]。
8 展望
自从生物表面活性剂被发现以来,它就是一个人们所感兴趣的基础生物化学研究对象,因为它表面活性方面有和化学合成的活性剂同样的性质,而且相对后者有可以生物降解的特点,所以它在工业方面有很大应用潜力。目前关于提高其发酵产率的研究非常多,并取得了比较显著的成果,比如筛选到了许多在不同条件下能产生生物表面活性剂的微生物,而且对一些菌的最佳发酵条件已经研究的非常清楚,但是关于其合成的调节机制方面的研究还不是很全面,关于细胞的新陈代谢路径和它的初级代谢方面的成果更不多。从工业生产上来看,由于野生发酵菌株的产量有限,而且附属非目的产物很多,使用的底物的价格也比较昂贵,导致其经济效益比化学合成的要差,从而其竞争力不高。因此,我们可以利用和提高各种技术如发酵、代谢和遗传等,进一步提高菌株的发酵产率,改进发酵产物的专一性,使菌种发酵所用底物的范围更为广泛,从而来降低其发酵经济成本,提高其商业上的竞争力,让其真正发挥作用。目前关于生物表面活性剂生物合成方面的一个显明的重要优势是:生物表面活性剂的分子结构可以被修改。因此,生物表面活性剂将来有可能在一些需要的领域有更深远的而且更精确的用途。这些活性分子在基因水平上有明显的结构和功能的独立性,这表明在合成以硫脂为模板的新的表面活性剂分子方面还有很大自由空间。因此,某些新的可能有新特性的脂肽,就有被合成的可能性了。

在线客服
QQ咨询
电话咨询 13720223167
13720223167
扫码咨询