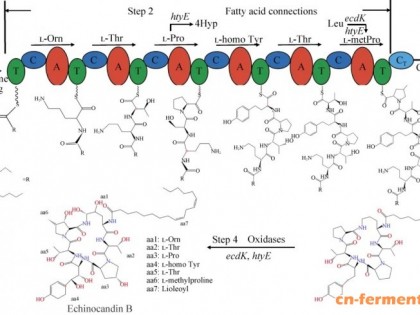
豆油在红霉素发酵中的作用及作用机制的研究(1)
作者:沈兆兵 陈国豪 陈长华
【摘要】 红色糖多孢菌D在15L发酵罐的基础培养基和发酵过程中补加豆油,当基础培养基中豆油量加倍时,效价提高43.1%;发酵过程补加豆油罐的红霉素效价、生产强度和Yp/s比不补豆油的分别提高了69.7%、69.6%和63.8%。通过实验测定发现,发酵过程补加豆油后,异柠檬酸脱氢酶、甲基丙二酰CoA异构酶的比活以及α?酮戊二酸的量均高于不补加豆油时的值,而琥珀酸的量低于不补加豆油时的值。推测豆油经过红色糖多孢菌代谢后进入红霉素合成的一条可能途径:豆油经过代谢后进入TCA循环,并强化了TCA循环的通量,产生了大量α?酮戊二酸,再生成琥珀酰CoA,琥珀酰CoA在甲基丙二酰CoA异构酶的作用下生成甲基丙二酰CoA作为红霉素合成的前体。
【关键词】 豆油; 红色糖多孢菌; 红霉素发酵; α?酮戊二酸; 甲基丙二酰CoA; 琥珀酸
Study on effect of soybean oil on fermentation of erythromycin and its mechanism
ABSTRACT The final production of erythromycin by Saccharopolyspora erythraea was increased by 43.1% in 15L bioreactor with double quantily of soybean oil into culture medium. The final production, production capacity and Yp/s of erythromycin were improved 69.7%, 69.6% and 63.8%, respectively, in 15L bioreactor with added soybean oil during fermentation. Specific activity of NADP+?isocitrate dehydrogenase, methylmalonyl ?coenzyme A mutase and the concentration of α?ketoglutaric acid were higher with added soybean oil than that not added, and the concentration of succinic acid was lower than that without added soybean oil. Therefore, the metabolic pathway from soybean oil to erythromycin was presumed as follows: soybean oil is metabolized into TCA pathway to generate much α?ketoglutaric acid and then generate succinyl?CoA by strengthening TCA pathway, and the methylmalonyl?CoA is formed from succinyl?CoA by isomerization. Finally, methylmalonyl?CoA can be used as the precursor for the biosynthesis of erythromycin.
KEY WORDS Soybean oil; Saccharopolyspora erythraea; Erythromycin fermentation; α?ketog?lutaric acid; Methylmalonyl?CoA; Succinic acid
红霉素的抗菌谱和青霉素相似,是治疗耐药性金葡菌和溶血性链球菌感染所引起疾病的首选药物,临床上可用于对青霉素过敏的患者[1]。红霉素的生物合成是由1个丙酰辅酶A开始的,依次接上6个2?甲基丙二酰辅酶A而形成的[2]。丙酰辅酶A的合成有2条途径:①丙酰辅酶A合成酶途径;②丙酸激酶与酰基磷酸辅酶A转移酶偶联也能够催化丙酸生成丙酰辅酶A。红色糖多孢菌合成红霉素所必须的另一个前体是甲基丙二酰辅酶A,合成甲基丙二酰辅酶A有3条途径[3]:①以三羧酸循环的琥珀酰辅酶A为底物的甲基丙二酰辅酶A变位酶和甲基丙二酰辅酶A消旋酶途径[4];②以丙酰辅酶A为底物的甲基丙二酰辅酶A转羧基酶途径[5];③丙酰辅酶A羧化酶途径[6]。
据报道,油能够为大环内酯类抗生素提供所需的前体,提高短链脂肪酸的合成。合成红霉素过程中短链脂肪酸主要被短链脂肪酸激酶和酰基磷酸辅酶A转移酶系统激活,同时还可以被酰基辅酶A合成酶激活, 丙酸激酶途径是形成丙酰辅酶A的主要途径[3],因而油在红霉素合成中有可能首先通过丙酰辅酶A途径最终促进红霉素的合成。但Hunaiti[4]等又报道在红霉素产生菌中甲基丙二酰辅酶A主要来源于三羧酸循环的琥珀酰辅酶A,而不是丙酰辅酶A。
本文在前人研究的摇瓶实验基础上,重点在15L发酵罐中进行添加豆油实验,结果表明豆油对红霉素的效价及其它几项指标的提高的确有明显作用;通过实验测定了发酵过程补加豆油对发酵液中有机酸以及相关酶活的影响,从理论上推测豆油对红霉素生物合成的作用机制。
1.材料与方法
1.1 菌株和培养基
菌株 红色糖多孢菌D,由本课题组自备。
一级种子培养基(g/L) 淀粉30,糊精20,玉米浆20,黄豆饼粉15,硫酸铵1.4,硝酸铵1.0,氯化钠2,碳酸钙2,豆油4。
二级种子培养基(g/L) 淀粉30,糊精20,玉米浆15,黄豆饼粉15,硫酸铵1.4,硝酸铵1.0,氯化钠2,碳酸钙2,豆油4。
摇瓶培养基(g/L)淀粉30,糊精20,玉米浆4,黄豆饼粉15,硫酸铵1.4,氯化钠1.5,碳酸钙4,豆油4。
发酵罐培养基(g/L) 淀粉50,糊精20,玉米浆15,黄豆饼粉16,硫酸铵8,氯化钠1.7,碳酸钙30,豆油30。
1.2 培养条件
一级种子培养 在500ml摇瓶中加入60ml种子培养基,灭菌前pH调到7.2左右,灭菌后把斜面孢子挖块1cm×1cm左右接种在种子培养基内,33℃培养46~48h。
二级种子培养 在500ml摇瓶中加入60ml种子培养基,灭菌前pH调到7.2左右,灭菌后把一级种子以5%的接种量接种在无菌培养基内,33℃培养24h。
摇瓶培养 在250ml摇瓶中加入25ml含不同量的豆油的摇瓶培养基,以及不含豆油的培养基。培养基灭菌前pH调到7.2,灭菌后把一级种子以10%的接种量接种在摇瓶培养基中,33℃培养144h。
15L发酵罐培养 装培养基10L,接种量为1000ml,培养基灭菌前pH调到7.2,发酵过程中溶解氧控制在30%左右,pH不低于6.8,33℃培养160h。
1.3 分析方法
还原糖和总糖的测定 取不同时期的培养液,用斐林法测定其中的还原糖和总糖。
化学效价的测定 采用磷酸法测定,红霉素经磷酸水解后成黄色,在485nm处有极大吸收值,可以定量测定。此方法主要用于发酵罐中发酵液的红霉素效价的测定。
生物效价的测定 采取计算抑菌圈法进行定量测定。此方法主要用于摇瓶发酵中发酵液的红霉素效价测定。
发酵液中豆油残留量的测定 取不同时期的发酵液,用乙醚萃取法测定发酵液中残留的豆油量。
pH测定 发酵罐发酵过程中pH测定由发酵罐自带的pH电极测定,摇瓶培养过程中的pH测定由pH测定仪测定。
有机酸的测定 用Waters HPLC高效液相系统,Breeze Data Processor数据处理器,流动相为磷酸盐缓冲液,流速1ml/min,柱温35℃,检测波210nm。
异柠檬酸脱氢酶、甲基丙二酰CoA异构酶的比活的测定[7,8]。
2 实验结果
2.1 基础培养基中添加豆油对红霉素发酵的影响
(1)摇瓶发酵基础培养基中添加豆油对红霉素效价的影响 在摇瓶发酵基础培养基中添加不同量的豆油,每个条件接3个摇瓶,取平均效价,结果见Fig.1。Fig.1(a)结果显示, 摇瓶基础培养基中豆油的添加量在0~0.8%范围对效价没有明显的影响,Fig.1(b)显示,当豆油添加量高于0.8%后发酵效价明显开始下降。量增大效价出现下降趋势,有文献报道[5], 豆油的代谢可能通过三羧酸循环来促进红霉素的合成,因而加强豆油的代谢和三羧酸循环的通量必须考虑到O2的充分供给,使豆油代谢和三羧酸循环产生的大量NADH和FADH2能够顺利进入呼吸链进行氧化磷酸化,以保证豆油代谢和三羧酸循环的通畅。
(2)15L发酵罐的基础培养基中添加豆油对红霉素效价的影响 实验结果如Tab.1。发酵结束后,基础培养基中豆油量加倍的罐效价比对照罐提高43.1%。
2.2 在15L发酵罐中过程补加豆油对红霉素发酵的影响
Tab.2列出了在15L发酵罐规模培养的小试实验中,发酵过程补加豆油对红霉素发酵几项指标的影响。可以看出,发酵过程补加豆油的发酵罐,红霉素的效价、生产强度和Yp/s(消耗单位重量的基质形成产物存量即基质的产物得率系数)明显高于不补加豆油的发酵罐。从Tab.3可以看出,以上各项指标的平均值,补加豆油的罐比不补加豆油的罐依次提高了69.7%,69.6%和63.8%。这些指标和2.1(2)的结果提示,在发酵罐基础培养基中以及发酵过程补加适量豆油对红霉素的生产具有促进作用。
2.3 过程补加豆油对异柠檬酸脱氢酶比活的影响
三羧酸循环过程中,异柠檬酸氧化脱羧生成α?酮檬酸脱氢酶所催化。从Fig.2可以看出在整个发酵过程中,过程补加豆油对异柠檬酸脱氢酶的酶活具有促进作用。
2.4 过程补加豆油对15L发酵罐中发酵液中的α?酮戊二酸量的影响
从Fig.3曲线变化可以看出,过程补加豆油的发酵液中α?酮戊二酸的量从50h左右开始显著增大,到80.3h达到最大值。在60~140h补加豆油的发酵液中α?酮戊二酸的量明显比不加豆油的量大。
2.5 过程补加豆油对15L发酵罐中发酵液中的琥珀酸量的影响
从Fig.4中的曲线变化可以看出,在整个发酵过程中补豆油的发酵液中琥珀酸的量比不补油的发酵液中琥珀酸的量低,琥珀酸是琥珀酰辅酶A转化的一条途径,另一条途径是异构化生成甲基丙二酰辅酶A。
2.6 过程补加豆油对甲基丙二酰CoA异构酶比活的影响
从Fig.5可以看出,过程补加豆油的发酵液中糖多孢链霉菌的胞内甲基丙二酰CoA异构酶活力随着发酵的进行明显高于不补加豆油的过程。
3 讨论
本文通过在红霉素发酵罐基础培养基中添加豆油和发酵过程中进行补加豆油实验发现,补加豆油红霉素效价有明显的提高。发酵罐基础培养基中补加豆油效价可以提高43.1%,发酵过程补加豆油可以使效价为进一步推测豆油对红霉素合成的作用机制,实验中测定了发酵过程补加豆油对发酵液中α?酮戊二酸、琥珀酸含量的影响,以及补加豆油对异柠檬酸脱氢酶、甲基丙二酰CoA异构酶比活的影响。
发酵过程补加豆油,异柠檬酸脱氢酶比活得到提高,可以促进异柠檬酸向α?酮戊二酸的转化。测定结果显示,α?酮戊二酸量的确高于不补豆油的发酵液;α?酮戊二酸量的增大导致琥珀酰辅酶A量的增加;测定发现补加豆油条件下琥珀酰辅酶A向琥珀酸转化的通量变小,那么向甲基丙二酰CoA转化的通量可能增大,实验测定发现甲基丙二酰CoA异构酶比活在补加豆油条件下高,因此,琥珀酰辅酶A必然是更多的向甲基丙二酰CoA转化。
综上分析得知,豆油经过代谢后进入TCA循环,强化了TCA循环的通量,产生了大量α?酮戊二酸,再生成琥珀酰CoA,琥珀酰CoA在甲基丙二酰CoA异构酶的作用下生成甲基丙二酰CoA作为红霉素合成的前体。
【参考文献】
[1] Hamedi J, Malekzadeh F, Niknam V. Improved production of erythromycin by Saccharopolyspora erythraea by various plant oils [J]. Biotechnol Lett,2002,24(9):697
[2] 李友荣,刘昌焕. 螺旋霉素的生物合成 IV.发酵过程中ATP与SPM生物合成的关系[J]. 中国抗生素杂志,l990,15(2):83
[3] Raczynska B K, Ruczaj Z, Sawnor K D. Limiting reactions in activation of acyl units in biosynthesis of macrolide antibiotics [J]. Antimicrob Agents Chemother,1973,3(2):162
[4] Hunaiti A A, Kolattkudy O E. Source of methylmalonyl?coenzyme A for erythromycin synthesis [J]. Antimicrob Agents Chemother,1984,25(2):173
[5] Hunaiti A R, Kolattukudy P E. Isolation and characterization of an acyl?CoA carboxylase from an erythromycin?producing Strepomyces erythres [J]. Arch Biochem Biophys,l982,216(1):362
[6] Bramwell H, Hunter I S.Propionyl?CoA carboxylase from Streptomyces coelicolor [J]. Microbiology,l999,142:649
[7] Stjernholm R, Wood H G. Methylmalonyl isomerase Ⅱ.Purification and properties of the enzyme from propionibacteria [J]. Biochemistry,1961,47(3):303
[8] Olano J, Arriaga D, Busto F, et al. Kinetics and thermostability of NADP?isocitrate dehydrogenase from Cephalosporium acremonium [J]. Appl Environm Micro?biol,1995,61(6):2326