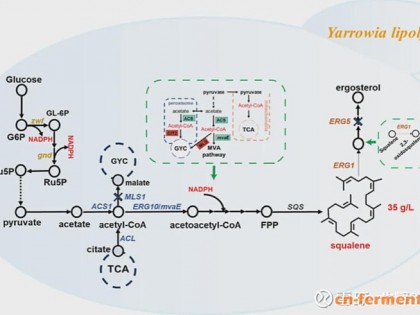
Ecs是一种从蛇毒中提取出来的活性蛋白,由49个氨基酸残基组成,第24~26位是RGD(Arg-Gly-Asp),该序列在许多细胞外基质蛋白分子内广泛存在,可以被细胞表面的多种整合素(integrin)受体分子识别结合,因此,Ecs可以竞争性抑制多种整合素分子与其配体的结合,从而表现出多方面的作用,Ecs可选择性抑制活化血小板和纤维蛋白原的结合,具有抑制血管平滑肌细胞迁移和增生的功能,在预防和治疗动脉栓塞及动脉硬化性疾病方面有良好的应用前景[1~4]。
由于从天然蛇毒中提取Ecs成本太高,化学合成方法也较为昂贵,因此限制了Ecs的大量使用。Ecs分子量小,单独表达存在一定困难,我们采取融合表达方式,构建了Ecs融合表达体系---BL21/pTXB1-Ecs,实现了Ecs融合蛋白的高效表达。本文在此研究基础上,对Ecs工程菌进行高密度发酵培养,并进行Ecs的分离纯化和生物学活性研究,为利用基因工程方法生产Ecs探索新的工艺流程。
1 材料和方法
1.1 材料
1.1.1 质粒和菌株:重组质粒pBV220-Ecs由本室构建并保存,pUC118载体由本室保存,表达载体pTXB1购自NEB公司,宿主菌Escherichia coli BL21(DE3)、JM109由本室保存;胰蛋白胨、酵母提取物购自Merck KgaA公司。
1.1.2 主要试剂和仪器:限制酶、几丁质亲和填料购自NEB公司;T4 DNA连接酶、Taq DNA聚合酶购自TaKaRa公司;其它试剂均为国产分析纯。Biostat-15L发酵罐购自B.Braun公司;电泳图像分析系统购自Alpha Innotech公司;层析工作站购自Pharmacia公司;PACKS24型血小板聚集仪购自Helena公司。
1.1.3 培养基:LB、SOB、2xYT及M9培养基(Amp100ug/mL,pH7.4)见文献[5];补料1:500mL(含酵母提取物100g,MgSO4*7H2O 0.5g,NaCl 10g);补料2:50%甘油400mL;补料3:10%氨水200mL;补料4:消泡剂10mL。
1.2 PCR扩增Ecs基因
根据文献[4]提供的序列,设计引物5'-GGTGCTCATATGGAATGCGAATCCGGT-3'和5'-TGTTGCTCTTCCGCAAGTACCGGACCTTTGT-3',其中分别在5'端引入Nde I、3'端引入Sap I酶切位点,并加入相应的保护碱基,以pBV220-Ecs为模板,PCR扩增Ecs基因。反应条件:94℃5min;94℃30s,55℃30s,72℃15s,循环35次;72℃5min,2%琼脂糖电泳观察结果。回收并纯化目的条带,将PCR产物与pUC118载体在16℃连接,连接产物转化JM109,蓝白斑筛选阳性克隆并进行DNA序列分析。
1.3 Ecs重组质粒的构建
用Nde I和Sap I酶切pUC118-Ecs,回收目的基因片段,与表达载体pTXB1体外连接,转化E.coli BL21(DE3)。PCR和序列分析鉴定重组子,取单个菌落接种于2mL LB(Amp100ug/mL)中,37℃振荡培养过夜,按1:50扩种至50mL LB(Amp100ug/mL)中,37℃振荡培养至OD600=0.6~0.8,加入IPTG(终浓度为0.08mmol/L)诱导4h,取样进行12%SDS-PAGE分析,经电泳图像分析系统扫描得到目的蛋白占全部可溶性菌体蛋白的百分含量.选用表达量最高的单克隆作为发酵用种子.
1.4 菌体密度和菌体湿重测定
752紫外分光光度计测定600nm处菌液的OD600值;用分析天平称量菌体湿重.
1.5 发酵培养
15L发酵罐装料10L,在IPTG诱导后,每隔10min加入补料1和补料2各15~20mL,在泡沫较多时加入补料,每次0.5mL,监测pH值降低时逐滴加入补料3"依次分别改变培养基种类、培养时间、诱导时间以及溶解氧浓度等参数,具体操作按照发酵罐说明进行。
1.6 融合蛋白的纯化
离心收集菌体沉淀,用TE按1:10重悬,冰浴超声破菌,18000g离心25min,收集上清,0.45um滤膜过滤。几丁质亲和填料装柱,用平衡液(20mmol/L Tris-Cl,0.5mol/L NaCl,1mmol/L EDTA,pH8.0)平衡20个柱体积(CV);用平衡液1:10稀释超声上清,上样,收集穿透峰行SDS-PAGE分析"上样完毕,用含1mol/L NaCl的平衡液至少洗涤20个CV;再用3个CV含30~50mmol/L DTT的平衡液以5~8mL/min的流速过柱,此过程在30min内完成,用柱帽封口,4℃放置20~40h。次日用平衡液洗柱,分别收集3个CV的洗脱峰,18%SDS-PAGE鉴定。用G-25除去粗样品中的盐和DTT,得到精样品。纯化产物的鉴定采用18%SDS-PAGE,考马斯亮蓝染色。
1.7 Ecs抗血小板聚集实验
健康志愿者静脉采血20mL,制备富血小板血浆(PRP)和贫血小板血浆(PPP),用PPP调整PRP,使血小板数约为250x109/L。取400uL调整后的PRP于测试杯中,分为阴性对照组、测试组和阳性对照组,分别加入0.9%NaCl、纯化Ecs和天然Ecs各50uL"磁珠搅拌37℃温育2min,每管加0.2mmol/L诱聚剂ADP50uL,用比浊法测定血小板聚集率,测定时间为5min。记录聚集曲线,并计算血小板聚集抑制率。血小板聚集抑制率=[(阴性管血小板最大聚集率-测试管血小板最大聚集率)/阴性管血小板最大聚集率]x100%"
2 结果
2.1 目的基因扩增及DNA序列分析
Ecs由49个氨基酸组成,设计的PCR预期扩增产物为包含全编码序列的约170bp长的片段(包括引物所带的酶切位点序列)。电泳结果显示,在100和250bp DNA分子量标准之间,获得了特异性的目的扩增。测序结果显示,测得Ecs的DNA序列与已知的Ecs序列一致[4]"
2.2 重组质粒的鉴定
挑取重组子转化的阳性菌落,快速小量抽提质粒,PCR扩增目的基因,1~4号克隆均在预期位置出现特异条带,选取2号质粒进行DNA序列测定。测序结果表明Ecs基因已成功克隆到载体pTXB1的NdeI/Sap I位点。
2.3 发酵培养基和培养时间选择
使用2xYT培养基发酵,菌体湿重和目的蛋白表达量都明显优于其它3种培养基(表1),故确定2xYT做为发酵用培养基"随后,控制细菌培养时间,使其菌密度OD600分别等于0.6、1.0、2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0时进行诱导。当OD600为510~610时开始诱导,菌体得率和目的蛋白表达量都较高。
2.4 诱导时间确定
加入IPTG诱导后,每隔1h取样,做全菌蛋白SDS-PAGE分析"诱导4h后,融合蛋白的表达趋于稳定,表达量占到菌体总蛋白的30%左右,相对分子量约为32kDa(图1)。

2.5 Ecs工程菌的高密度发酵
根据以上优化条件,用2xYT培养基,37℃培养6h左右,IPTG诱导4h,控制溶解氧浓度为60%~80%,补加10%氨水以保持pH恒定。经电泳图像分析系统分析,目的蛋白表达量占全菌总蛋白的35%(图2),菌体湿重为75g/L。

2.6 重组质粒的稳定性
参考文献[6]的方法"Ecs融合基因工程菌在无选择压力条件下连续培养50代以上,质粒保持稳定(表2)"

2.7 纯化和DTT切割
超声上清过几丁质亲和柱后,用DTT将Ecs单体从融合蛋白上裂解下来,用平衡液洗脱,收集第1到第3个CV的洗脱峰,经18%SDS-PAGE分析,考马斯亮蓝染色呈单一条带,Ecs单体主要存在于第一个洗脱峰中(图3),得率约28mg/L发酵液"

2.8 活性检测
通过抑制ADP活化的人血小板聚集试验,我们发现重组Ecs与天然Ecs活性相近,重组Ecs的抑制聚集率为73.6±2.35(%),天然Ecs的抑制聚集率为75.1±1.96(%),二者在统计学上无显著性差异。
3 讨论
Ecs是一种小肽,小肽的表达通常比较困难,本室首先进行了单独表达Ecs的研究工作,但效果并不理想,分析其原因可能是由于Ecs分子量小,表达产物不稳定,容易被宿主细胞蛋白酶降解,因此表达量很低。之后采用了将Ecs基因与蛋白质剪切元件intein(内蛋白子)融合,构建Ecs原核表达体系BL21/pTXB1-Ecs的方法。该体系实现了外源蛋白的高效表达,而且在intein与Ecs连接处可实现精确剪切"当超声上清通过几丁质亲和层析柱后,只有融合蛋白能够和几丁质结合,再用DTT裂解后,仅有Ecs蛋白被洗脱下来,而融合蛋白前体intein仍结合于柱上,这样便将融合蛋白的纯化与DTT裂解结合在了一起,极大的方便了外源蛋白纯化。国内外研究者所进行的Echistatin融合蛋白表达的研究中,外源蛋白的表达量不是很高,而且在纯化时采用溴化氰切割,工艺比较复杂[4,7]。本文采用的几丁质亲和层析克服了这些缺点,实现了融合蛋白高效表达和一步过柱法纯化Ecs的目的。
工程菌发酵是个很复杂的过程,在发酵过程中,细菌生长过快,耗氧增多,代谢产物也产生过多,就会影响细菌的生长和外源蛋白的表达,此时要适当加入营养(碳源和氮源),并不断加入氧气,但氧分压也不能过高,否则对细菌生长有抑制作用,一般不超过90%。在进入对数生长期后,随着代谢产物的增多,溶液pH值会下降,当降至7.0以下时,需加入氨水,应特别注意氨水要逐滴加入,以免矫枉过正。根据作者的经验,每加一滴,pH值升高0.01,因此切不可流速过快,流量过多。在本研究中并没有出现高密度发酵在提高收菌量的同时,目的蛋白表达量却有所下降的情况[8,9]。恰好相反,我们实现了收菌量和目的蛋白高表达的双赢目标,利用高密度发酵的方法使菌体收量比摇瓶发酵法提高了10倍。由此可见,在发酵过程中,工程菌得率的高低与目的蛋白表达量之间没有直接相关性,只要选择适当培养基选择合适的诱导时机和诱导时间,满足菌体生长对营养和氧气的代谢需求,并控制培养基的pH,即可以实现目的蛋白的高表达。