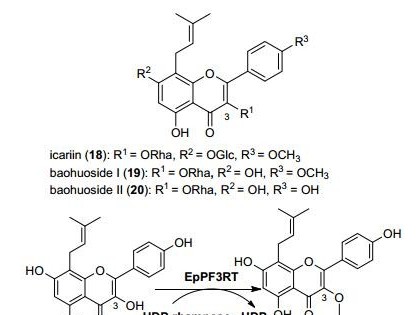
1 大豆中胰蛋白酶抑制剂的分布
胰蛋白酶抑制剂在大豆中的各部位均有分布,但主要存在于大豆的种子中。大豆种子中胰蛋白酶抑制剂的含量可达总蛋白的6%~8%。
2 大豆中胰蛋白酶抑制剂的生化特性
2.1 胰蛋白酶抑制剂的结构与功能 胰蛋白酶抑制剂是分子量较小的、具有生理活性的功能性蛋白质,大豆中胰蛋白酶抑制剂可分为以下两类:
2.1.1 Kunitz类抑制剂。主要对胰蛋白酶直接地、专一地起作用,这类抑制剂与胰蛋白酶的结合是定量地进行的,即1g分子的抑制剂可以结合1g分子的胰蛋白酶。
2.1.2 Bowman Birk类抑制剂。可分别与胰蛋白酶和糜蛋白酶结合,由于抑制剂分子内有两个活动中心,故被称为双头抑制剂。
Kunitz类和Bowman Birk类抑制剂是大豆中最主要的两类胰蛋白酶抑制剂,它们在大豆中的含量分别为1.4%和0.6%。这两类胰蛋白酶抑制剂对热、酸、碱的稳定性有所差异,纯化的Kunitz类抑制剂在30℃以下温度和pH1~12范围内保持其活性,在80℃短时间加热能使它可逆地变性,而在90℃加热则使它不可逆地失活。Bowman Birk类抑制剂比Kunitz类抑制剂对热、酸、碱的稳定性强,当在干燥状态、105℃加热或用其0.02%水溶性在100℃加热10min,仍可保持它们的活性(Fennema1985)。关于它们对热的稳定性也有相反的报道,认为Bowman Birk类抑制剂比Kunitz类抑制剂对热更不稳定(Dilietroh和Liener211989)。
2.2 胰蛋白酶抑制剂与靶酶的反应机理
大豆中的胰蛋白酶抑制剂属于丝氨酸蛋白酶抑制剂,它可以和胰腺分泌的丝氨酸蛋白酶系发生反应,胰蛋白酶抑制剂与靶酶相互作用,通常如酶与底物之间的相互作用一样,属于互补型作用机理。两者反应时,抑制剂暴露在外的活动中心与靶酶的活动中心通过氢键相连接,形成稳定的共价型复合物,从而导致酶活动中心的闭锁,使靶酶的活性丧失,与通常的酶催化反应相比,蛋白酶与抑制剂之间反应的米氏常数很低,故蛋白酶与抑制剂的亲和力大,二者可以迅速结合形成复合物。与一般酶的底物不同,抑制剂与酶结合后其活动中心的肽链并不裂解或裂解速度极慢。因此,该复合物虽然可以分解成游离的酶和变性或未变性的抑制剂,但解离速度非常缓慢。
以上说明抑制剂从某种意义上讲可以看作是酶的底物,其与酶的接触部位主要集中于抑制剂活动中心附近的氨基酸残基。
3 大豆中胰蛋白酶抑制剂的毒理
胰蛋白酶抑制剂对动物的有害作用主要是引起生长抑制和使某些动物引起胰腺肥大。
胰蛋白酶抑制剂对动物生长产生抑制作用,一般认为有以下两方面的原因:
3.1 胰蛋白酶抑制剂能和小肠中的胰蛋白酶及靡蛋白酶结合,形成稳定的复合物,使酶失活,导致食物蛋白质的消化率降低,引起外源性氮的损失。
3.2胰蛋白酶抑制剂可引起胰腺分泌活动增强,导致胰蛋白酶和靡蛋白酶的过度分泌。由于这些蛋白酶含有非常丰富的含硫氨基酸,所以使用于合成体组织蛋白的这些氨基酸转而用于合成蛋白酶,并与抑制剂形成复合物而最终通过粪便排出体外,从而导致内源性氮和机体含硫氨基酸的大量损失。大豆蛋白质本来就缺乏含硫氨基酸,加上抑制剂所引起的含硫氨基酸的额外损失,导致体内氨基酸代谢不平衡,因而阻碍了动物的生长。有研究认为,摄入含有蛋白酶抑制剂的日粮时,通过含硫氨基酸的内源性损失对机体氮平衡的影响,比通过日粮中氨基酸的损失(外源性损失)所致的影响要大(Barth等,1994)。
4 大豆中胰蛋白酶抑制剂的去除方法
4.1热处理法 大豆中胰蛋白酶抑制剂本身为蛋白质或蛋白质的结合体,对热不稳定,充分加热可使之变性失活,从而消除其有害作用。
大豆的加热处理方法有煮、蒸汽处理(常压或高压蒸汽)、烘烤、红外辐射处理、微波辐射处理、挤压膨化(干法或湿法挤压膨化)等。湿法加热(蒸汽、煮等)。通过采用常压蒸汽加热30min或98kPa压力的蒸汽处理15~20 min,可使胰蛋白酶抑制剂失活。此外,挤压膨化的效果也比较好。
4.2 化学处理法 一些研究表明,大豆中的胰蛋白酶抑制剂可以通过化学处理法使其灭活。此类方法的作用机理一般都是利用化学物质破坏胰蛋白酶抑制剂的二硫键,从而改变胰蛋白酶抑制剂的分子结构以达到灭活的目的。已采用过的化学物质有亚硫酸钠、偏重亚硫酸钠、硫酸铜、硫酸亚铁、硫代硫酸钠、戊二醛以及一些带硫醇基的化合物(胱氨酸)、N—乙酰胱氨酸)等。侯水生等(1994)报道,采用0.5%偏重亚硫酸钠处理生大豆一周以上,可使胰蛋白酶抑制剂降低59.83%。张建立等(1999)报道,用5%尿素+20%水处理生大豆30d,使胰蛋白酶抑制剂的失活率达到78.55%。
4.3 酶处理法 国外有人研究用某些真菌和细菌的菌株所产生的特异性酶来灭活大豆中的胰蛋白酶抑制剂,有一定的效果(Meijer和Spekking1993Huo等,1993)。
4.4 作物育种法 国内外对大豆Ti基因(不含胰蛋白酶抑制剂的隐性基因)及其遗传规律的研究,为通过作物育种手段降低大豆胰蛋白酶抑制剂的活性提供了依据。Hymowitz于1986年已成功地培养出了低胰蛋白酶抑制剂的大豆新品种,其胰蛋白酶抑制剂的活性比一般大豆低50%。