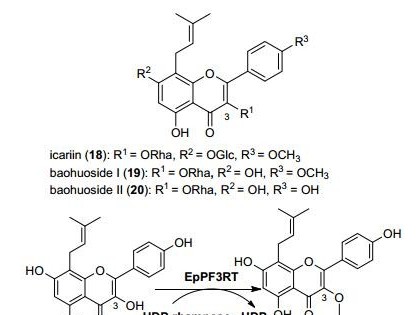
1 医药用酶的研发进展与应用前景
1.1 酶在疾病诊断方面的研发进展与应用前景
人类疾病的治疗效果好坏与否,在很大程度上决定于诊断的准确性。疾病诊断的方法很多,其中酶学诊断特别引人注目。由于酶具有专一性强、催化效率高、作用条件温和等显著的催化特点,酶学诊断已经发展成为可靠、简便又快捷的诊断方法,具有广阔的应用前景。
酶学诊断方法包括两个方面,一是根据体内原有酶活力的变化来诊断某些疾病,二是利用酶来测定体内某些物质的含量,从而诊断某些疾病。
(1) 根据体内酶活力的变化诊断疾病
一般健康人体内所含有的某些酶的量是恒定在某一范围的。当人们患上某些疾病时,则由于组织、细胞受到损伤或者代谢异常而引起体内的某种或某些酶的活力发生相应的变化。故此,可以根据体内某些酶的活力变化情况,而诊断出某些疾病。举例如表1(表略)。
(2) 用酶测定体液中某些物质的变化诊断疾病:
人体在出现某些疾病时,由于代谢异常或者某些组织器官受到损伤,就会引起体内某些物质的量或者存在部位发生变化。通过测定体液中某些物质的变化,可以快速、准确地对疾病进行诊断。
酶具有专一性强、催化效率高等特点,可以利用酶来测定体液中某些物质的含量变化,从而诊断某些疾病。举例如表2(表略)。
1.2 酶在疾病治疗方面的研究与应用前景
酶可以作为药物治疗多种疾病,用于治疗疾病的酶称为药用酶。药用酶具有疗效显著,副作用小的特点,在疾病的治疗方面的应用越来越广泛。举例如表3(表略)。
1.3 酶在药物制造方面的研发进展与应用前景
酶在药物制造方面的应用是利用酶的催化作用将前体物质转变为药物。这方面的应用日益增多。现已有不少药物包括一些贵重药物都是由酶法生产的。举例如表4(表略)。
2 药用酶改性技术研究进展与应用前景
酶的改性(enzyme improving)是指通过各种方法对酶的催化特性进行改进的技术过程。
酶的改性技术主要包括:
酶固定化、 酶分子修饰、酶的非水相催化、 酶的定向进化
2.1 酶固定化(enzyme immobilization)
将酶固定在载体上,制备固定化酶的技术过程,称为酶固定化。
固定在载体上,在一定的空间范围内进行催化反应的酶称为固定化酶(immobilized enzyme)。
固定化酶具有提高稳定性,可以反复使用或连续使用较长的一段时间,易于与产物分离等显著特点。
已经有多种固定化酶用于大规模工业化生产。举例如下:
(1) 氨基酰化酶:这是世界上第一种工业化生产的固定化酶,可以用于生产各种L-氨基酸药物。1969年,日本田边制药公司将从米曲霉中提取分离得到的氨基酰化酶,用DEAE-葡聚糖凝胶为载体通过离子键结合法制成固定化酶,将L-乙酰氨基酸水解生成L-氨基酸,用来拆分DL-乙酰氨基酸,连续生产L-氨基酸。剩余的D-乙酰氨基酸经过消旋化,生成DL-乙酰氨基酸,再进行拆分。生产成本仅为用游离酶生产成本的60%左右。
(2) 青霉素酰化酶:这是在药物生产中广泛应用的一种固定化酶。可用多种方法固定化。1973年已用于工业化生产,用于制造各种半合成青霉素和头孢菌素。用同一种固定化青霉素酰化酶,只要改变pH等条件,就既可以催化青霉素或头孢菌素水解生成6-氨基青霉烷酸(6-APA)或7-氨基头孢霉烷酸(7-ACA),也可以催化6-APA或7-ACA与其他的羧酸衍生物进行反应,以合成新的具有不同侧链基团的青霉素或头孢霉素。
(3) 天门冬氨酸酶:1973年日本用聚丙烯酰胺凝胶为载体,将具有高活力天门冬氨酸酶的大肠杆菌菌体包埋制成固定化天门冬氨酸酶,用于工业化生产,将延胡索酸转化生产L-天门冬氨酸。
1978年以后,改用角叉菜胶为载体制备固定化酶,也可将天门冬氨酸酶从大肠杆菌细胞中提取分离出来,再用离子键结合法制成固定化酶,用于工业化生产。
(4)天门冬氨酸-β-脱羧酶:将含天门冬氨酸-β-脱羧酶的假单胞菌菌体,用凝胶包埋法制成固定化天门冬氨酸-β-脱羧酶,于1982年用于工业化生产,催化L-天门冬氨酸脱去β-羧基,生产L-丙氨酸。
2.2 酶分子修饰(enzyme molecule modification)
酶分子修饰是通过各种方法使酶分子的结构发生某些改变,从而改变酶的某些特性和功能的技术过程。
酶分子修饰技术已经成为酶工程中具有重要意义和广阔应用前景的研究、开发领域。通过酶分子修饰,可以提高酶活力,增加酶的稳定性,消除或降低酶的抗原性等。 举例如下:
(1) α-淀粉酶分子中大多数含有钙离子,有些则含有镁离子或锌离子等其它离子,所以一般的α-淀粉酶是杂离子型的。如果将其它杂离子都换成钙离子,则可以提高酶活力并显著增强酶的稳定性。结晶的钙型α-淀粉酶的活力比一般结晶的杂离子型α-淀粉酶的活力提高3倍以上,而且稳定性大大增加。
(2) 每分子核糖核酸酶与6.5分子的右旋糖酐结合,可以使酶活力提高到原有酶活力的2.25倍;每分子胰凝乳蛋白酶与11分子右旋糖酐结合,酶活力达到原有酶活力的5.1倍等。
(3) 具有抗氧化、抗辐射、抗衰老的功效,但是其在血浆中的半衰期仅为6~30min, 经过大分子结合修饰,其稳定性显著提高,半衰期延长70~350倍。
(4) 具有抗癌作用的精氨酸酶经聚乙二醇结合修饰,生成聚乙二醇-精氨酸酶(PEG-arginase)后其抗原性被消除;对白血病有显著疗效的L-天门冬酰胺酶经右旋糖酐或者聚乙二醇结合修饰后,都可以使抗原性显著降低甚至完全消除,其中经过聚乙二醇结合修饰的L-天门冬酰胺酶(PEG-asparaginase),1994年已经得到美国FDA批准,正式作为治疗急性淋巴性白血病的药物使用;笔者等人利用单甲氧基聚乙二醇(MPEG1)修饰木瓜凝乳蛋白酶,可以使酶的抗原性显著降低。
2.3 酶的非水相催化(enzyme catalysis in non-aqueous phase)
酶在非水介质(有机溶剂介质、气体介质、超临界流体介质、离子液介质等)中进行催化反应的技术过程称为酶的非水相催化。
酶在非水介质中的催化具有提高非极性底物或产物的溶解度、进行在水溶液中无法进行的合成反应、减少产物对酶的反馈抑制作用、提高手性化合物不对称反应的底物选择性、基团选择性、区域选择性、对映体选择性等显著特点。
酶的非水相催化在手性药物的拆分,发光高分子聚合物、导电高分子聚合物的生产、生物柴油的研制等方面显示出良好的应用前景。
酶在手性化合物拆分方面的研究、开发和应用越来越广泛。举例如下:
(1)环氧丙醇衍生物的拆分:2,3-环氧丙醇单一对映体的衍生物是一种多功能手性中间体。它可以用于合成β-受体阻断剂、爱滋病毒(HIV)蛋白酶抑制剂、抗病毒药物等多种手性药物。其消旋体可以在有机介质体系中用酶法进行拆分,获得单一对映体。例如,用猪胰脂肪酶(PPL)等在有机介质体系中对2,3-环氧丙醇丁酸酯进行拆分,得到单一的对映体。
(2)芳基丙酸衍生物的拆分:2-芳基丙酸(CH3CHArCOOH)是手性化合物,其单一对映体衍生物是多种治疗关节炎、风湿病的消炎镇痛药物,如布洛芬、酮基布洛芬、萘普生等的活性成分。用脂肪酶在有机介质体系中进行消旋体的拆分,可以得到S-构型的活性成分。
(3) 苯甘氨酸甲酯的拆分:苯甘氨酸的单一对映体及其衍生物是半合成β-内酰胺类抗生素,如氨苄青霉素、头孢氨苄、头孢拉定等的重要侧链。脂肪酶在有机介质中通过不对称氨解反应,可以拆分得到单一对映体。
2.4 酶的定向进化(enzyme directed evolution)
酶的定向进化技术是模拟自然进化过程(自然随机突变和自然选择等),在体外进行基因的人工随机突变,建立突变基因文库,通过人工控制条件的特殊环境,定向选择得到具有优良催化特性的酶的突变体的技术过程。
酶定向进化的特点:酶的定向进化不需要事先了解酶的结构、催化功能、作用机制等有关信息,应用面广;
通过全基因组重排、基因家族重排、DNA重排、易错PGR等技术,在体外人为地进行基因的随机突变,短时间内可以获得大量不同的突变基因,建立突变基因文库;
在人工控制条件的特殊环境下进行定向选择,进化方向明确,目的性强。
通过酶的定向进化,可以显著提高酶活力、增加酶的稳定性、改变酶的底物特异性等。
例如,1993年,Chen KQ等人通过易错PCR技术进行定向进化,使枯草杆菌蛋白酶在60%的DMF中进行非水相催化的比活力提高157倍;
1994年,Stemmer通过DNA重排技术(DNA Shuffling)进行定向进化,使β-内酰胺酶的活力提高32000倍;
2000年,Wang等人用易错PCR技术进行定向进化,使天冬氨酸酶的米氏常数(Km)降低4.6倍,大大提高了酶与底物的亲和力,酶活力提高28倍,同时使热稳定性和pH稳定性显著提高;
2004年,Aharoni,A等人用全基因组重排技术进行定向进化,使大肠杆菌磷酸酶对有机磷酸酯的活力提高40倍,同时使该酶对有机磷酸酯的特异性提高2000倍。
3 新型药用酶研究进展与应用前景
3.1 核酸类酶
核酸类酶(ribozyme)是一类具有生物催化功能的核糖核酸(RNA)分子。它可以催化本身RNA的剪切或剪接作用,还可以催化其它RNA、DNA、多糖、酯类等分子进行反应。
核酸类酶具有抑制人体细胞某些不良基因和某些病毒基因的复制和表达等功能。表达的功能。据报道,一种发夹型核酸类酶,可使爱滋病毒(HIV)在受感染细胞中的复制率降低90%,在牛血清病毒(BLV)感染的蝙蝠肺细胞中也观察到核酸类酶抑制病毒复制的结果。这些结果表明,适宜的核酸类酶或人工改造的核酸类酶可以阻断某些不良基因的表达,从而用于基因治疗或进行艾滋病等病毒性疾病的治疗。
3.2 端粒酶
端粒酶(Telomerase)是催化端粒合成和延长的酶。端粒酶是一种核糖核蛋白,包含蛋白质和RNA两种基本成分。其RNA组分中含有构建端粒重复序列的核苷酸模板序列。在合成端粒的过程中,端粒酶以其本身的RNA组分作为模板把端粒重复序列加到染色体DNA的末端,使端粒延长。
端粒的存在不但可以避免外界因素对DNA的破坏,而且可以在复制过程中,通过牺牲自我而避免染色体DNA受损,以维护染色体结构和功能的完整性。
单细胞四膜虫等纤毛虫类的端粒很短,细胞内始终保持高活性的端粒酶,酶活性的抑制将导致细胞寿命缩短。人的正常体细胞内有很长的端粒,却没有检测到端粒酶的活性。这是由于人体端粒的合成和延长是在胚胎发育期进行的,随着细胞分化,在人体的正常细胞内(除了生殖细胞和干细胞等以外),端粒酶的生物合成和酶活性都受到抑制。而在分化程度较低的癌细胞中却可明显地检测得到端粒酶的活性。
因此可以通过测定细胞内的端粒酶活性,诊断细胞是否发生了癌变。
3.3 抗体酶
抗体酶(abzyme)又称为催化性抗体(catalytic antibody)。是一类具有生物催化功能的抗体分子。
抗体(antibody)是由抗原诱导产生的能与抗原(antigen)特异结合的免疫球蛋白。要使抗体成为具有催化功能的抗体酶,只要在抗体的可变区赋予酶的催化特性,就可能成为抗体酶。
抗体酶同时具有抗体的高度特异性以及酶的高效催化能力。是通过人工设计,采用现代生物技术而获得的一类新的生物催化剂,有些是在自然界原本不存在的。
抗体酶的制备方法主要有诱导法和修饰法。修饰法是对抗体进行分子修饰,在抗体与抗原的结合部位引进催化基团,而成为具有生物催化活性的抗体。具体方法请参看本书第四章。诱导法是抗体酶制备的主要方法,是在特定的抗原诱导下合成抗体酶的方法。根据所采用的抗原不同,诱导法有半抗原诱导法和酶蛋白诱导法。