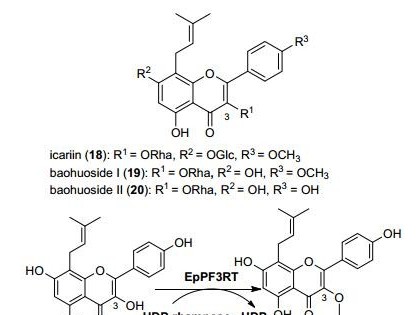
1 重要的纤维素酶产生菌
不同微生物合成的纤维素酶在组成上有显著的差异,对纤维素的降解能力也大不相同。由于放线菌的纤维素酶产量极低,研究很少;细菌的产量也不高,且主要是内切葡聚糖酶,大多数菌所产纤维素酶对结晶纤维素没有活性,另外,所产生的酶是胞内酶或吸附于细胞壁上,很少能分泌到细胞外,增加提取纯化难度,在工业上很少应用。而丝状真菌具有产酶的诸多优点:产生的纤维素酶为胞外酶,便于酶的分离和提取;产酶效率高,且产生纤维素酶的酶系结构较为合理;同时可产生许多半纤维素酶、果胶酶、淀粉酶等。从纤维素酶工业化制备及其应用角度看,研究和采用丝状真菌产酶具有更大意义。目前,用于生产纤维素酶的微生物菌种大多都是丝状真菌,其中产酶活力较强的菌种为木霉属(Trichoderma)、曲霉属(Aspergillus)和青霉属(Penicillium),特别是里氏木霉(Trichoderma reesei)及其近缘菌株较为典型,它遗传性状稳定,具有较好的抗代谢阻遏能力而产酶活力高、纤维素酶系完全,具有分解天然纤维素所需要的内切葡聚糖酶(EG)、外切葡聚糖酶(CBH)、β-葡萄糖苷酶(BG)3类酶组分,已知共8种不同的纤维素酶,能协同水解纤维素底物,有效地将纤维素转化为葡萄糖。同时,其生长环境粗放、酶易提取,且菌株安全无毒,因而里氏木霉被公认为是最具有工业应用价值的纤维素酶生产菌。
里氏木霉常分离于从森林或常年堆放木材、秸秆处取来的土样,或者直接从朽木、腐烂的秸秆材料上分离。在刚果红纤维素平板上显示明显水解圈,具有较强的滤纸崩解能力,菌种鉴定特征为:在察氏培养基上,肉眼观察菌落迅速蔓延,形成较薄的菌丝层,菌落初期为白色,平坦,后期因产生分生孢子而呈深绿色。产孢区常排列成同心轮纹状,菌落背面无色,有时也呈浅黄色。镜检菌丝透明,有隔,细胞壁光滑,分生孢子梗由菌丝直立生出,无色,分枝多,对生或互生二至三级分枝,整体像树枝;分枝与分生孢子梗近似直角,末端为小梗,小梗瓶形;分生孢子球形或长椭圆形,表面粗糙,布满小刺,单孢,靠黏液在小梗上聚集成球状绿色的分生孢子头。据此初步鉴定为半知菌亚门、丝孢纲、丝孢目、丛梗孢科、木霉属、里氏木霉。
2 纤维素酶产生菌的遗传改良
2.1 理化诱变育种
从自然界中直接分离出来的里氏木霉产酶菌株,产酶性能一般较差,必须要进行菌种的遗传改良。理化诱变育种是一种简单有效的方法,能够大幅度改变菌种的遗传特性,从而获得高产突变菌株。常用于纤维素酶产生菌的诱变剂有紫外线、60Co-γ射线、亚硝基胍、亚硝酸、硫酸二乙酯等。从诱变的筛选策略来看,由于纤维素酶作用的终产物葡萄糖会阻遏酶的进一步合成,这被认为是天然菌株纤维素酶产量低的一个主要原因。因此,除了传统的依据水解圈大小鉴别正向突变株的方法外,还可以通过筛选抗阻遏突变株的方法来获得高产纤维素酶菌株。
管斌等用紫外线、亚硝基胍诱变处理里氏木霉,以2-脱氧葡萄糖作为终产物阻遏物(葡萄糖)的结构类似物进行抗性筛选,选育得到1株抗终产物阻遏作用的突变株,其滤纸酶活力和CMC酶活力分别达到3.63IU/mL和24.64IU/mL,比出发菌株提高了3倍。宋小炎等采用葡萄糖浓度梯度纤维素双层平板筛选经紫外线处理过的拟康氏木霉,获得1株葡萄糖浓度高达10%仍能产生纤维素水解透明圈的突变株。该突变株干曲的CMC酶活力、滤纸酶活力和β-葡萄糖苷酶活力分别达1145.7U/g,55.6U/g和24U/g,分别是出发菌株的2.4倍、3.0倍和12.6倍。杜娟等以1株具有较高纤维素酶活性的野生菌株灰绿曲霉XC9为出发菌株,经过紫外线、氯化锂、甲基磺酸乙酯(EMS)等理化诱变剂多重处理,获得了抗葡萄糖阻遏的突变株E2-26,E5-65,U6-31和EU7-22,其CMC酶活与出发菌株相比分别提高至1.7,1.4,1.3,2.0倍。
目前,已被深入研究和生产上广泛采用的里氏木霉突变株RutC-30即是以里氏木霉野生型菌株T.reesei QM6a为出发菌株,经过一系列诱变育种工作而得到的。该突变株所产生的酶,分解纤维素的能力比野生型菌株更有效,并且纤维素酶基因的表达不受终产物葡萄糖的阻遏。进行纤维素酶生产时有许多公司采用这个菌株,该菌株具有极大的工业化制酶的价值。
2.2 原生体融合育种
近年来,采用原生质体融合技术改良纤维素酶生产菌株的研究日益增多。比如,里氏木霉能大量合成外切葡聚糖酶、内切葡聚糖酶,但是其β-葡萄糖苷酶活力低,而黑曲霉(A.niger)的β-葡萄糖苷酶活力很高,为了充分利用里氏木霉和黑曲霉这2个远缘属种间的互补优势性状,可将里氏木霉和黑曲霉进行原生质体融合,筛选到的融合子可能具有两属的优点。但目前对原生质体融合子的遗传稳定性还需做进一步的探讨。
2.3 基因工程途径构建纤维素酶高效工程菌
利用现代分子生物学技术已从不同的物种中克隆了大量的纤维素酶基因,从中选择那些比活力高、酶性质优良的纤维素酶基因,将它们同高效的启动子或染色体起始位点相融合,实现纤维素酶基因的异源或同源高效表达,将是提高纤维素酶生产效率的有效途径。目前已克隆了里氏木霉外切葡聚糖酶基因cbh1,cbh2及内切葡聚糖酶基因eg1,eg2,eg3,eg4,eg5等7个纤维素酶基因,且都在大肠杆菌中得到表达。但由于大肠杆菌不能分泌表达,而且表达量低、提取率低等因素使之不适合作为酶工业生产的受体菌。近年来,工业上用一些生长速度快、不产毒素、易于培养、能胞外分泌的受体菌如毕赤酵母(Pichia)、米曲霉(A.oryzae)、黑曲霉(A.niger)和最新开发的镰孢霉(Fusarium venenatum)等作为表达真菌酶的理想宿主系统。如,乔宇等将里氏木霉eg2基因转入巴斯德毕赤酵母,获得高效表达里氏木霉内切葡聚糖酶II的毕赤酵母工程菌株Gp2025,甲醇诱导发酵,所得酶的活力高达1573.0U/mL。Takashima等将里氏木霉eg1基因在米曲霉中成功表达,在米曲霉淀粉酶基因强启动子调控下,用麦芽糖作为主要碳源进行诱导,所得内切葡聚糖酶I的CMC酶活力达到59.8U/mg。另外,将黑曲霉的β-葡萄糖苷酶基因克隆到里氏木霉中高效表达以提高其β-葡萄糖苷酶活力,或者将里氏木霉自身的纤维素酶基因同源多拷贝表达,构建高效生产纤维素酶的里氏木霉工程菌株也是目前基因工程改良菌种的研究热点。
与理化诱变和原生质体融合育种相比,基因工程途径育种具有很好的定向性,为构建高效纤维素酶生产菌开辟了新途径,最有可能使纤维素的分解利用问题得到突破性解决。然而,由于纤维素水解需要多种酶成分的协同作用,而通过基因工程技术获得的异源表达的纤维素酶一般仅是纤维素酶复合体的单个或少数几个组分,无法实现出发菌株纤维素酶系的全部表达,因此,基因工程纤维素酶很少能水解结晶状态的纤维素,也不能克服天然纤维素中木质素、半纤维素所形成的障碍,使得纤维素酶的基因工程菌在应用上还存在一定的局限性。同样的原因,以里氏木霉为基础的基因工程改造菌株则具有应用上的优势。这些基因工程改造策略除了上面提及的异源或同源纤维素酶基因在里氏木霉的表达之外,还可以针对里氏木霉纤维素酶基因的启动子进行优化,删除其中的葡萄糖抑制因子结合位点,增加转录激活元件,以此实现纤维素酶基因的高效表达,或者针对里氏木霉纤维素酶合成相关的转录因子进行改造,以去除有关葡萄糖抑制因子的作用而增强其激活纤维素酶基因表达的功能。
2.4 纤维素酶的分子改造
纤维素酶应用领域广泛,不同的应用过程由于环境条件的不同而对酶的性质有不同的要求,如用于饲料,要求纤维素酶耐酸性,用于纺织、洗涤、造纸业,则要求纤维素酶能耐碱性。除此之外,在酶的实际应用中,人们总是期待酶的活力和热稳定性越高越好,这样可以加快反应速度、提高酶的利用率、降低酶的使用成本。而天然的来自真菌的纤维素酶大多为酸性酶,在碱性条件下不能有效地发挥作用,而且纤维素酶的活性和热稳定性有限,不能满足使用的需要。20世纪80年代兴起的蛋白质工程技术和随后产生的酶的体外定向进化技术为天然纤维素酶分子的改造提供了有效的途径。人们可以在基因水平上,通过定点突变、易错PCR、DNA改组(DNA Shuffling)、交错延伸过程(StEP)、杂合酶技术等手段产生各种各样的突变体,再从中筛选出符合人们需要的性质改善的突变酶,如耐碱性酶、比活力提高的酶、热稳定性提高的酶等,最后,将该突变酶的基因高效表达,或者引回原宿主同源置换野生型基因,即获得了经分子改性的高效纤维素酶产生菌。
在纤维素酶的分子改造方面已有不少成功的报道,如山东大学Wang T等以里氏木霉内切葡聚糖酶Ⅲ基因eg3出发,采用易错PCR和致错突变株技术,获得一个最适pH向碱性偏移0.6pH单位的突变体N321T;Murashima等利用易错PCR和交错延伸过程,构建了嗜纤维梭菌EngB和EngD的杂合突变体库,从中筛选出3个突变体,它们的热稳定性均明显高于亲本酶,其中热稳定性最好的突变体酶1-40,其在52℃下的半衰期是两亲本酶的7倍;Kim等将来自枯草芽孢杆菌的内切葡聚糖酶基因经过DNA改组,筛选到CMC酶的比活力是野生酶2.2倍的突变体酶。Ni J、李祥等将来自白蚁的4个内切葡聚糖酶基因进行了家族DNA改组(family shuffling)以获得热稳定性提高的突变酶,所得PA68突变体酶的热稳定性提高了10℃,同时其CMC比活力达到其中一个亲本酶rRsEG的13.1倍。通过酶的分子改造,使得纤维素酶的性质更加趋于人们的需要,在这方面还有很多工作要做,纤维素酶改性的潜力还很大。