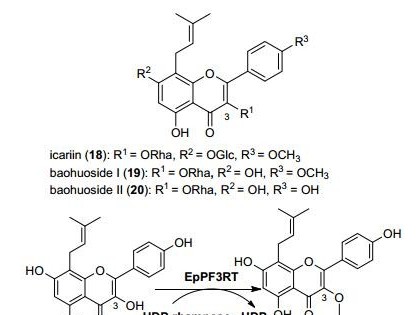
摘要:概述了细菌纤维素酶的水解机制及其基因的克隆和表达,总结了近年来纤维素酶结构和功能方面的研究成果,展望细菌纤维素酶领域的研究前景。
关键词:细菌;纤维素酶;基因克隆;结构与功能
作者简介:陈春岚(1971-),女,广西昭平人,广西贺州学院讲师,广西大学硕士研究生,主要从事微生物学细菌纤维素研究。
1 引言
目前,纤维素是最丰富的可再生有机资源,其生物降解主要由微生物——细菌和真菌完成。细菌主要产中性纤维素酶和碱性纤维素酶,这类酶制剂对天然纤维素的水解作用较弱,长期以来没有得到足够的重视。但原核生物的基因一般不含内含子,可直接从基因组DNA中克隆到目的基因用于工程菌的构建。因此细菌纤维素酶基因的克隆,既利于研究纤维素酶基因的多样性,也利于高效纤维素酶基因工程菌的构建。随着中性纤维素酶和碱性纤维素酶在棉织品水洗整理工艺及洗涤剂工业中的成功应用,以及耐热性纤维素酶在燃料酒精生产中应用,细菌纤维素酶制剂已显示出良好的应用性能和巨大的经济价值。
2 纤维素分解性细菌的类群
纤维素分解性细菌是指能分解纤维素的细菌,分三大类群:(1)厌氧发酵型:芽孢梭菌属(Clostridium)、牛黄瘤胃球菌属(Ruminococcus)、白色瘤胃球菌(Ruminococcusalbus)、产琥珀酸拟杆菌(Bacteroides succinogenes)、产琥珀酸丝状杆菌(Fibrobactersuccinogenes)、溶纤维菌(Butyrivibrio fibrisolvens)、热纤梭菌(Clostridium thermocellum)、解纤维梭菌(Clostridiumcellulolyticum);(2)好氧型:粪碱纤维单胞菌(Cellulomonasfimi)、纤维单胞菌属(Cellulomonas)、纤维弧菌属(Cellvibrio)、发酵单胞菌(Zymomonas)、混合纤维弧菌(Cellvibrimixtus);(3)好氧滑动菌,如噬胞菌属(Cytophaga)。
3 细菌纤维素酶基因的克隆与表达
细菌中编码纤维素酶的基因在基因组的分布为随机的或形成基因簇。在基因簇中,有转录终止子,没发现有启动子。人们已从40多种细菌中克隆到了纤维素酶基因,其中一些酶基因已经在大肠杆菌和酵母中得到表达。如从Stropyomyces、Clostridium、Thermoanaer obacter、Themomonspora、Erwinia、Pseudomonas、Cellvibrio、Ruminococcus、Cellulomonas、Fibrobacter 和 Bacillus 中成功分离出葡聚糖基因,并先后克隆了瘤胃的Bacteroides、succi nogenes 、Butyrivibrio sp Ruminococcus albus等细菌的纤维素酶基因,同时热梭菌中的11种内切纤维素酶(CelA、CelB、CelD、CelE、CelF、CelG、CelH、CelI、CelJ、CelK、CelS)的基因已经被克隆,嗜纤维梭菌的5种内切纤维素酶(EngA、EngB、EngC、EngD、EngE)已经测序并在大肠杆菌中得到表达。杨智源、刘永生、游银伟等从不同的细菌中克隆了内切葡聚糖酶基因[1-3]。Kim等克隆了Aquifex aeolicus VF5编码EG的 ce18Y基因,在E.coli XL1 -Blue中成功表达,Hakamada等运用盒式连接介导PCR 和反向PCR 克隆到了基因egl-257。人们将纤维素酶、纤维二糖等外源基因转入运动发酵单胞菌(Zymomonas mobilis)中并得到不同程度的表达,有望将它改造为能将纤维素转化为乙醇的重组菌株并在工业中广泛应用。细菌葡聚糖酶基因在S.cerevisiae的启动子和信号肽的控制下构建在同一质粒载体上,然后转入S.cerevisiae, 重组菌可向培养基分泌保留70%活性的葡聚糖内切酶和外切酶,这种酶能够分解滤纸和木浆中的纤维素。
4 细菌纤维素酶分类
细菌纤维素酶是多酶复合体系,根据各酶的功能可分为三大类:(1)内切葡聚糖酶(1,4-D-glueanohydrolase或endo-1,4-β-D-glucanase,EC 3.2.1.4),简称Cen。作用于纤维素内部的非结晶区,随机水解β-1,4-糖苷键,将长链纤维素分子截短,产生大量非还原性末端的小分子纤维素,其分子量大小约为23-146KD。(2)外切葡聚糖纤维二糖水解酶(1,4-β-D-glucan cellobio-hydrolase或exo-1,4-β-D- glucanase,EC3. 2.1.91),简称Cex。作用于纤维素线状分子末端,水解β-1,4-D-14糖苷键,依次切下一个纤维二糖分子,故又称为纤维二糖水解酶(cellobiohydrolase),分子量约38-118 KD。(3)β-葡萄糖苷酶(β-1,4-glucosidase, EC3.2.1.21)简称BG或称纤维二糖酶。这类酶一般将纤维二糖或可溶性的纤维糊精水解成葡萄糖分子,其分子量约为76KD。
5 细菌纤维素酶水解机制
好氧细菌的三种纤维素酶是以各自独立的形式分泌到细胞外水解纤维素的;厌氧细菌的三种纤维素酶以多酶复合体形式结合在细胞壁上对纤维素进行水解。细菌纤维素酶通过多酶复合体系各组分协同作用彻底有效降解天然纤维素。Cen负责进攻纤维素的非结晶区,随机水解β- 1,4 - 糖苷键,将长键纤维素分子截短,产生大量带非还原性末端的小分子纤维素,Cex负责从纤维素线状分子的非还原性末端水解切下纤维二糖单位,BG则将纤维二糖水解成葡萄糖,但对于Cen和Cex 的作用顺序尚未定论。
在已知结构的细菌纤维素酶分子中,通过在异头碳原子位通过构型的保留或构型的转化完成催化反应,其中两个保守的羧基氨基酸分别作为质子供体和亲核试剂,如C . thernmocellum的内切酶CelC催化域中Glu-280和Glu-140分别作亲核试剂和质子供体, C .fimi的外切酶Cex的Glu-574和Glu-645分别作亲核试剂和质子供体,证明了细菌纤维素酶降解纤维素的水解双置换机制。由于纤维素底物的高度复杂性以及底物的多样性,纤维素水解过程的并没有完全清楚。因此,纤维素酶系的降解机理还有待进一步研究和探讨。
6 细菌纤维素酶的结构和功能
通过对粪碱纤维单胞菌(Cellulomonas fimi)的一个外切酶Cex和一个内切酶CenA的研究表明,细菌纤维素酶的纤维素结合结构域(CBD)位于氨基端或羧基端,它借助连接桥(Linker)与催化结构域(CD)连接。在多种细菌的纤维素酶中发现有相似的结构[8]。
6.1 催化结构域(CD)
纤维素酶分子的催化结构域主要体现酶的催化活性及对特定水溶性底物的特异性。不同来源纤维素酶分子量差别很大,但其催化区的大小却基本一致,活性位点的三级结构都是保守区域。Juy M et 等采用x光衍射的方法对热纤梭菌的Cel D的催化域进行了结晶和解析[4]。结果表明,内切酶的活性位点位于一个开放的“裂缝”(Cleft)中,可与纤维素链的任何部位结合并切断纤维素链;外切酶的活性位点位于一个长“环”(1oop)所形成的“内部通道”(tunnel)里,它只能从纤维素链的非还原性末端切下纤维二糖。细菌的外切酶有两个酶切位点,有限酶切时,可将CBD和连接桥分别切去。Meinke A 等利用蛋白质工程的方法将粪碱纤维单胞菌的外切酶Cbh A分子的Loop删除后,发现该酶的内切酶活性提高[5]。根据其氨基酸序列的相似性已知的纤维素酶的CD可分为70多个家族,在同一家族内具有相似的分子折叠模式和保守的活性位点,因此在同一家族内,其反应机制和对底物的特异性都可能相同,这已通过实验得到证实。
6.2 纤维素结合结构域(CBD)
许多纤维素酶主要依靠在肽链N端或C端的CBD结合底物,该结构又称纤维素结合模块,其功能是将相邻的催化结构域传递到晶体纤维素底物上。细菌纤维素酶的CBD由100-110个氨基酸组成,同源性较低。细菌CBD平坦的表面只露出2个或3个芳香族氨基酸残基和一些形成氢键的残基,多项研究证实,这些残基与CBD对结晶纤维素的结合有关。一些细菌的CBD结构有一定的共同特点:带电荷氨基酸含量很低;羟基氨基酸含量很高;都含有Trp、Asn和Gly,而且两个Cys在N、C末端的位置完全相同。汪天虹等用多维核磁共振和X射线衍射技术,证实了族Ⅱ C. Fimi Cex、Cen以及族Ⅲ C.thermocelhun Cip的CBD有相似的结构:由2个β片层面对面折叠在一起,形成一个β三明治结构,CBDcex含有一个单一的二硫桥连接N-末端和C-末端,CBDcip有一个Ca2+的高亲和性结合位点[6]。然而,有的CBD的作用似乎不在于跟底物结合,而是破坏晶体纤维素链间的非共价相互作用;或者不仅结合底物,还提供结合不同底物结构的优先权。杨永彬等通过实验证实家族Ⅱ的CBD能够促使纤维素中氢键的断裂,从而释放单根纤维素分子链[7]。C.fimi的 CenA或Cex单独的CBD不具备对纤维素的水解活力,但能破坏棉纤维,形成短纤维,具有疏解结晶纤维素的能力。实验证明,细菌纤维素酶中的CBD对酶的催化活力是非必需的,但它们具有调节酶对可溶性和非可溶性底物专一性活力的作用。
6.3 连接桥(1inker)
连接肽(1inker)一级结构的研究发现,细菌纤维素酶分子的连接肽富含脯氨酸(Pro)和丝氨酸(Thr),完全由Pro-Thr这样的重复序列约100多个氨基酸残基组成。在高级结构的分子形状上,细菌连接肽、CD、CBD之间呈135o。连接肽的作用可能是保持CD和CBD之间的距离,有助于不同酶分子间形成较为稳定的聚集体。
6.4 细菌纤维素酶关键氨基酸残基
运用定点诱变技术,以合成的寡核苷酸作诱变物,在已知的核苷酸序列中准确地诱变密码子中的一个或数个碱基,改变组成蛋白质的一个或数个氨基酸残基,以确定功能性氨基酸基团,目前对糖基水解酶中第5、6、7、9、45族的催化机制和功能性氨基酸的研究成果较多。
Bacillus sp.的纤维素酶是糖基水解酶族5 中研究较早的纤维素内切酶,结构上具有(α/β)8折叠桶结构, 通过底物异头碳原子位的构型保留进行催化反应,研究发现这些高度同源的纤维素酶的酶反应最适pH有较大的差异[8]。如B .subtili 的BSC为中性纤维素酶, Bacillus sp. N4的NK1为碱性纤维素酶。在碱性环境下用Asn 和Ser 分别代替NK1 region 5中的Ser287 和Ala296,结果使得NK1 的酶反应pH范围与BSC的几乎一致,这表明Ser287 和Ala296 对NK1在碱性环境的活性起着重要的作用。但在酸性范围内, NK1 region5中的各种氨基酸取代都不影响其酶反应pH 范围。根据这一发现,推断Ser287和Ala296为影响酶反应pH 范围的功能性氨基酸残基,并且认为Ser287和Ala296的替代造成了底物吸附位点或催化位点的氢键网重组。
C. fimi 纤维素酶Cel6A属于糖基水解酶族6,结构上具有七股平行链组成的β-折叠桶中心结构,通过底物异头碳原子位构型转化进行催化反应。对C. fimi Cel6A 的四个保守Asp 残基Asp216,Asp252,Asp287, Asp392 的突变研究表明,Asp252 和Asp392分别作为其酸催化剂和碱催化剂,Asp287 对Asp252 起辅助催化作用,Asp216对催化几乎不影响。Wolfgang DE等对照C.fimi Cel6A 研究了T .fusca Cel6A 的Asp 79 Asp117,Asp 156和Asp265。结果发现Asp79 对应于C .fimi Cel6A 的Asp 216 却有很大不同,它不但能提高Asp 117 的pKa,而且对于催化活性也很重要,而且研究还发现,Asp265Asn 突变株仍然保留野生型酶7 %的活性。这表明Asp265 并不起碱催化剂的作用,这与高度同源的C.fimi Cel6A的实验结果显然不同。
Clostridium . stercorarium CelZ 属于族9纤维素酶。Riedel 等推断其催化残基为Asp84 和Glu447,位于蛋白的N - 末端,取代CelZ 的一个或两个催化残基,结果完全消除了其对微晶纤维素的攻击能力,但在水解CMC时, 却检测到了Asp84 替代物的内切酶活性,这可能是发生在CMC 上的羧化作用而引起的“催化拯救”作用造成的,这与族6 纤维素酶的研究情况非常相似。
H .insolens Cel45A是族45纤维素酶的代表, , 通过底物异头碳原子位构型的转化进行催化反应,具有很强的除垢功能。对其底物吸附沟的残基Tyr147 进行了研究,诱变动力学分析表明,这一区域的芳香族氨基酸对吸附有很重要的作用。研究发现其结构由一个带有互相连接长环的六链桶组成,而且在酶的表面有一个40Å 的沟,包含催化残基Asp10 (可能为碱催化剂) 和酸催化剂Asp121。
7 展望
细菌以多酶复合体结构彻底有效降解天然纤维素,纤维小体是研究较多的细菌纤维素酶复合体。纤维小体的作用方式是理解纤维素降解和利用纤维素资源的关键。进一步了解纤维小体结构的普遍性,不同来源的纤维小体的组成同源性和多样性,纤维小体蛋白质之间的相互作用,纤维小体组织结构的形态发生等,从而为工程改造纤维小体,利用纤维素资源提供基础。
提高纤维素酶的分离纯化技术,利用基因工程和蛋白质工程的手段,对它的空间结构作进一步的研究,以便更好地了解它的结构、酶学特性和协同作用的降解机制,为纤维素酶蛋白质分子的改造和设计提供理论基础。
通过构建培养和未培养细菌的基因组DNA文库,筛选到高效的、多样性的纤维素酶基因,利用体外DNA分子定向进化等基因操作技术,构建适应不同需要的高效工程菌,比如把纤维素酶基因克隆到Z.molis或酿酒酵母中,可以直接利用纤维素转化生产酒精。
参考文献
[1] 杨智源,陈荣忠,杨丰.短小芽孢杆菌葡聚糖内切酶基因的克隆及序列测定.微生物学报,2001,41(1):76-81.
[2] 刘永生,冯家勋,段承杰.GXN151的分离鉴定及其一个纤维素酶基因(cel5A)的克隆和测序分析.广西农业生物科学,2003,22(2):132-138.
[3] 游银伟,汪天虹.适冷海洋细菌交替假单胞菌(Pseudoalteromonas sp.)MB-1内切葡聚糖酶基因的克隆和表达.微生物学报,2005,45(1):142-144.
[4] Juy M. Amit G. Amit M,et al .Crystal structure of a thermostable bacterial cellulose degrading enzyme. Nature,1992,35(3):89-91.
[5] Meinke A,Damude G,Tomme P,et al. Enhancement of the endo-beta-1,4-glucanase activity of an exocellobiohydrolase by detetion of a surface loop. J.Bio. chem. 1995,27(9): 4383-4386.
[6] 汪天虹,王春卉,高培基.纤维素酶纤维素吸附区的结构与功能.生物工程进展,2000,20(2):37-40.
[7] 杨永彬,黄谚谚,林跃鑫.纤维素酶的结构及分子多样性.生命的化学,2004,24(3):211-213.
[8] 胡利勇,钟卫鸿.纤维素酶基因克隆及其功能性氨基酸研究进展.生物技术,2003,13(2):43-45.