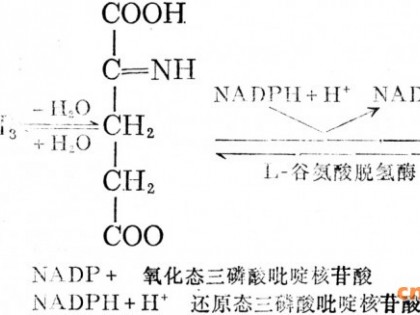
新型甜味剂阿斯巴甜是以天冬氨酸和苯丙氨酸为原料缩合而成的二肽甲酯,甜度为蔗糖的180~200倍。它的2种氨基酸组份主要来源于发酵法和酶法转化。利用直接发酵法生产氨基酸,关键在于使经过基因工程改造的菌株克服代谢调控过程中关键酶的反馈抑制作用,使得反应终产物能够大量积累[1,2]。一般是利用营养缺陷型突变株和抗氨基酸结构类似物的突变株,再进行基因克隆表达[3],耗时长,工作复杂。利用基因工程技术将1个或数个重要酶基因导入合适的菌株,利用酶法反应将前体物经一步或二步直接转化生成目的产物,可以有效地解决反馈抑制作用带来的问题,步骤简单、效率高。
在微生物中,由aspA基因编码的天冬氨酸酶(AspA)可以催化反丁烯二酸和铵反应生成天冬氨酸。而另一方面,天冬氨酸又恰好可以在由tyrB编码的芳香族氨基酸转氨酶(TyrB)催化合成苯丙氨酸的反应中作为氨基供体。我们用聚合酶链式反应从大肠杆菌基因组DNA中扩增得到aspA与tyrB基因,并串联在同一个质粒载体上,导入大肠杆菌P2392氟苯丙氨酸抗性菌株中大量表达,将2种催化反应在同一种细菌中组合在一起(图1)。只要在菌株发酵过程(或反应溶液)中加入相应的前体物就可用酶法生产氨基酸[4]。2种酶促反应既可以分开,又可以偶联进行。如果需要生产天冬氨酸,可添加反丁烯二酸和氨来生产;如果要生产苯丙氨酸,则只要同时加入反丁烯二酸和铵盐及苯丙酮酸,无需添加其他氨基酸作为氨基供体,经两步的生化反应即可合成苯丙氨酸,大大缩减了生物合成步骤,简化了生产工艺。因此,将aspA与tyrB基因串联在同一菌种中表达,对于阿斯巴甜的2种基本原料———天冬氨酸和苯丙氨酸的生产具有重要的应用价值。

1 材料与方法
1.1 菌株与质粒
(1)E coliK12:基因克隆供体菌。
(2)E coliTop10:基因转化受体菌。
(3)E coliP2392氟苯丙氨酸抗性菌株:基因表达菌株。
(4)pBluescriptSK,Ampr抗性标记,用于基因克隆、测序。
(5)pλPR,Ampr抗性标记,高温诱导表达质粒,基因表达载体。
1.2 培养基
(1)液体培养基:1%NaCl,1%蛋白胨,0.5%酵母粉,pH7.5。
(2)固体培养基:液体培养基中加入1.2%琼脂粉。需要时添加100μg/mL氨苄青霉素。
1.3 酶和其他试剂限制性内切酶、Taq酶、连接酶,购自Takara公司。测定酶活性所用试剂购自Sigma公司。
1.4 aspA和tyrB基因克隆及表达载体的构建
根据Woods等[5]报道的aspA基因的序列,设计了PCR扩增的引物。通过PCR方法从E coliK12诱变菌株基因组DNA中扩增得到aspA基因,克隆于pBluescriptSK质粒上。tyrB基因克隆参见Fan等报道的文献[2]。构建了3种表达质粒:pλPR-aspA、pλPR-tyrB和pλPR-tyrB-aspA用于研究(图2)。DNA的操作参照文献[6]。DNA测序委托上海博亚生物技术有限公司进行。
1.5 酶活力的测定
菌体培养及酶的粗提纯参照文献[4],
(1)天冬氨酸酶(AspA)参照文献[7]测定,酶活力以30min内每毫克干菌体转化Asp生成的反丁烯二酸(FA)毫摩尔数表示。
(2)转氨酶(TyrB)测定参照文献[2]。酶活力定义为:30min内1mg干细胞转化PPA生成苯丙氨酸的毫摩尔数。
1.6 总蛋白质与氨基酸的测定蛋白参照文献[8]。氨基酸测定参照文献[9]。
2 结果与讨论
2.1 aspA和tyrB基因的获得及其重组质粒的构建基因aspA以大肠杆菌K12DNA为模板,通过PCR获得;tyrB来源于pCZ GAB[2]。目的基因首先克隆在pBluescriptSK质粒上,再转移到表达载体pλPR上,获得3种重组质粒。它们的基因大小、酶切位点和串联顺序如图2所示。将重组质粒转化入E.coliP2392氟苯丙氨酸抗性菌株中。经Amp筛选得到转化子,抽其质粒并进行酶切鉴定、DNA测序,所有结果证实我们构建的重组质粒与预测的结果一致。

2.2 基因表达蛋白质的检测
AspA、TyrB是被克隆基因在大肠杆菌中的基因表达产物。用SDS PAGE蛋白质电泳检测,可见明显表达条带(图3),其结果与预计的53kDa和44kDa分子量相符。

2.3 AspA,TyrB酶活力测定
菌株培养至对数期,42℃热诱导4h,离心收集细胞,超声波破壁,硫酸铵盐析法获得酶粗制品。对转化不同质粒的E coliP2392的酶粗抽提物进行酶活检测,结果见表1。数据表明,克隆基因的表达产物均有相应的酶活性,各重组菌株与对照菌株相比,酶活性均有2~3倍的提高。

2.4 完整细胞的AspA与TyrB酶偶联催化L-苯丙氨酸合成分析
菌株培养至对数期,42℃热诱导4h,离心收集细胞置于下列反应液中:200mmol/LPPA,250mmol/LFA,300mmol/LNH4Cl,0.167mmol/L5.磷酸吡哆醛,0.083%hexadecyl trimethyl ammoniumbro mide,0.1mol/LTris HClbuffer(pH8.4)。(干)菌体浓度10mg/mL。37℃反应。按时取样测定phe产量和产物分析,获得结果如图4所示。图4(A)是反应液中苯丙氨酸合成的时间进程曲线,从中可看出,tyrB aspA基因双串联表达的菌株(3)无论是Phe合成速度还是合成产量均明显优于tyrB单基因表达菌株(2),更优于对照菌株(1)。该基因串联表达菌株在2h之内的苯丙氨酸生成量直线上升,与反应时间呈正比;3h之后逐渐达到稳定。产量测定的数据表明基因串联表达菌株E coliPBA在酶反应体系中3h的PPA转化Phe的效率为93%,Phe的产率达到每小时0.6g/g(细胞),是tyrB单基因克隆菌株E coliPB的2.4倍,是对照菌株E coliPO的4.7倍。图4(B)是反应液中合成产物的纸层析结果,该层析图谱表明反应液中合成产物(Phe,Asp)的纯度很高,非常有利于合成产物的分离纯化。由于反应液中的FA浓度大于PPA,所以图4(B)中Asp和Phe同时存在,若适当调整反应液中FA和PPA的浓度比例,则有可能使Asp减少而Phe增加。

3 讨 论
本研究的目的在于探索一条酶法与发酵法相结合的苯丙氨酸生产新方法。我们曾经利用基因工程构建苯丙氨酸生产菌株,先诱变筛选,得到反馈抑制不敏感的突变株,然后将其进行基因克隆表达[1,2]。由于苯丙氨酸代谢途径复杂,关键酶众多,必须同时导入多个基因才能有效地提高产量。串联的基因过多,表达载体过大会使质粒拷贝数较低,造成宿主菌生长缓慢[9,10]。在本研究中,利用温度诱导的基因表达载体pλPR,构建了aspA与tyrB串联表达的工程菌株,可以在培养后期,进行温度诱导表达aspA与tyrB基因,并添加适量前体物反丁烯二酸和苯丙酮酸,用氨水控制pH。这样就可以直接利用化合物合成生产L-苯丙氨酸,缩短了生物合成途径,在一定程度上能解决生产成本过高的问题。但尚需在TyrA和AspA酶偶联反应条件以及基因表达量方面进行进一步优化提高。
利用酶法转化前体物生产苯丙氨酸有其工艺简单的优势,但目前生产上使用的酶法生产原料价格偏高。如果能够通过基因工程技术改良现有生产菌种,使现有的tyrB与aspA串联菌株在前期进行直接发酵产苯丙氨酸,在后期流适当加酶底物合成苯丙氨酸,就可以综合发酵法的成本低廉和酶法工艺简单的两者优势,使工业化生产苯丙氨酸有更好的前景。