(天津科技大学食品科学与生物工程学院天津300222)
摘要? L-缬氨酸在医药及饲料领域中有着广泛的用途,根据L-缬氨酸的生物合成途径及其代谢调 节机制,利用代谢调控理论,重点阐述了L-缬氨酸生产菌的育种思路及培养条件 的优化,为缬氨酸发酵生产提供理论指导。?
关键词? L-缬氨酸? 育种? 发酵
??? L-缬氨酸作为支链氨基酸之一,系人体必须氨基酸,具有多种生理功能,主要用以配制 复合氨基酸输液、合成多肽药物和食品抗氧化剂等,尤其是在医学研究和治疗中的作用,日 益 受到重视。它在血脑屏障、肝昏迷、慢性肝硬化以及肾功能衰竭的治疗,先天性代谢缺陷病 的膳食治疗,败血症及术后糖尿病患者的治疗,加快外科创伤愈合,肿瘤患者的 营养支持治疗中应用广泛[1]。随着其研究的不断深入,应用范围也将进一步扩大 。因此,L-缬氨酸的生产具有非常广泛的应用前景。
1??? L-缬氨酸的发酵生产
??? 目前,L-缬氨酸的生产方法有提取法[2]、合成法[3~4]、发酵法[5]等。动物血粉、蚕蛹及 毛发水解液中L-缬氨酸的含量较高,应用离子交换技术从混合氨基酸中分离缬氨酸,分离 效率高,提取操作简单,生产周期短,但是成本高,不适于现代工业生产。化学合成法是 以异丁醛为原料,与氨及氢氰酸作用生成胺腈,再水解得DL-缬氨酸,经拆分得L-缬氨酸 。 化学合成法生产成本高,反应复杂,步骤多,且有许多副产物。而利用微生物发酵法生产具 有原料成本低,反应条件温和及可大规模生产等优点,是一种非常经济的生产方法。国外 曾对发酵法所用缬氨酸优良生产菌的诱变育种和代谢调控作了一些研究[6~7]。而 国内发酵生产L-缬氨酸的种类及规模有限,大规模发酵生产缬氨酸更是一个新的领域。本 文总结了近年来世界各国生产状况,对发酵生产的育种思路及条件优化作了系统论述,以期 为大规模生产研究提供参考。
1.1 L-缬氨酸的代谢调控育种?
??? 工业发酵若想获得较高产量的目的产物,必须突破(或解除)微生物细胞自我调节控 制机制,最常用且最有效的方法就是从遗传的角度选育解除微生物正常代谢调节机制的突变 株。L-缬氨酸发酵生产的代谢调控育种的基本途径有:切断或改变平行代谢途径(选育营养缺陷型突变株),解除菌体自身的反馈抑制(选育抗反馈调节突变株),选育营养缺陷型恢复突变株,增加前体物质的合成,切断进一步代谢途径和利用基因工程技术构建缬氨酸工程菌。
1.2 代谢调控育种的应用?
1.2.1? 出发菌株的选择? 目前,世界利用发酵生产缬氨 酸的出发菌株有北京棒杆菌[8]?(Corynebacterium pekineise)?,谷氨酸棒杆菌[9]?(Corynebacterium glutacium)?,乳糖发酵 短杆菌[1,4]?(Brevibacterium lactofermentum)?,大肠杆菌属[10]? ?(Escherichia coli)?, 黄色短杆菌[11]?(Brevibacterium flavum)?,? 粘质赛氏杆菌[12]?(Serratia marcescens)?等,这些菌株均可以作为出发菌 株选育出L-缬氨酸生产菌。
1.2.2? 诱变育种的应用? L-缬氨酸的生物合成途径是从丙酮酸开始,经过几步反应形成缬氨酸。根据缬氨酸的生 物合成途径及细菌的代谢调节机制,分析L-缬氨酸工业发酵高产菌的选育途径。?
(1)切断或改变平行代谢途径
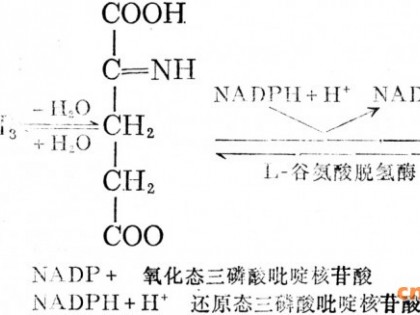
??? Nakazawa[13]等人以黄色短杆菌为出发菌株,选育出异亮氨酸与甲硫氨酸缺陷型突 变株,此 突变株发酵可以生产缬氨酸。Katasurada[1]等人以北京棒杆菌和谷氨酸棒杆菌为 出发菌株 ,通过选育异亮氨酸与亮氨酸缺陷型突变株使L-缬氨酸的产量达19~28g/L。由图1可以看 出 ,缬氨酸和异亮氨酸的生物合成途径是平行进行的,缬氨酸、亮氨酸与异亮氨酸的生物合成 途径中公用了三种酶:即乙酰乳酸合成酶、乙酰乳酸异构还原酶和二羟基脱水酶。选育亮氨 酸、异亮氨酸营养缺陷型突变株可以使用于合成三种氨基酸的公用酶系完全用于缬氨酸的生 物合成,进而提高缬氨酸的产量。同时α?酮戊酸是合成缬氨酸和亮氨酸的共同前体物。切 断亮氨酸的合成途径不仅可以节省碳源而且解除了菌体生成缬氨酸酶系的反馈抑制和多价阻 遏,使α-异丙基苹果酸合成酶脱敏显著提高缬氨酸的产量。
 图1? L-缬氨酸生物合成途径
图1? L-缬氨酸生物合成途径
(2)解除菌体自身的反馈抑制?
??? 缬氨酸合成中的第一个限速酶—乙酰乳酸合成酶受缬氨酸的反馈抑制,同时缬氨酸和异 亮氨酸的合成酶系受三个末端:即缬氨酸、异亮氨酸和亮氨酸的多价阻遏。因此,如果解除 乙酰乳酸合成酶的反馈抑制和缬氨酸、亮氨酸、异亮氨酸生物酶系的阻遏,必将大大提高缬 氨酸的积累。为此可选育缬氨酸结构类似物抗性突变株来解除缬氨酸的反馈调节。常用的缬 氨酸结构类似物有2-噻唑丙氨酸(2-TA)、α-氨基丁酸(α-AB)、氟亮氨酸、缬氨酸 等。 Tsuchida[14]等人选育出了具有β-羟基亮氨酸、β-2噻吩丙氨酸以及具有1,2 ,4-三唑丙氨酸抗性的大肠杆菌突变株AJ?11470,以此来解除产物的反馈抑制,发酵生产L-缬氨酸。Naka m ura[15]等人报道选育α-氨基丁酸抗性突变株ATCC221118生产L-缬氨酸,发酵72 ~96h,L-缬氨酸的产量可达27~37g/L。徐旭东等[16]以乳糖发酵短杆菌XT4为出发菌株,采用 NTG诱变 处理,获得一株积累L-缬氨酸的高产菌A15,此菌株具有2-噻唑丙氨酸(2-TA)和α-氨基丁酸(α-AB)抗性,摇瓶产酸达33g/L,可用于工业化生产。
(3)增加前体物质的合成?
??? 由图1可以看出生物合成的前体物质是丙酮酸,为了积累更多的缬氨酸,必须提高丙酮酸的 产量,可以选育以琥珀酸为唯一碳源生长慢、丙氨酸缺陷型以及氟丙酮敏感突变株。 Kyowa 等[5]选育出的缬氨酸突变株在以葡萄糖为唯一碳源的培养基中进行培养时,对丙酮酸类似物比较敏感,通过选育丙酮酸类似物敏感突变株,降低了丙酮酸脱氢酶的活性,达到了积累丙酮酸的目的。丙酮酸的积累有利于高产L-缬氨酸。
??? 根据上述选育突变株的几条途径可选育组合型突变株,如营养缺陷型突变株和抗性结构 类似物双重突变株,以提高目的产物的产量。张伟国等[17]所选育的L-缬氨酸 高产菌XQ?6就是双重突变株,此菌具有异亮氨酸缺陷、2-噻唑丙氨酸(2-TA)和α-氨基丁酸(α-AB)抗性以及AHV抗性。发酵培养72h ,L-缬氨酸的产量可达45g/L。?
1.2.3? 构建目的工程菌 大肠杆菌由丙酮酸生成L-缬氨酸酶系的基因组成两个主要的操纵子,即?ilv和leu?操纵 子。?Ilv操纵子包括了ilvG,ilvE,ilvD,ilvA,ilvC和ilvB?基因,其中DACB基因编码 了合成异亮 氨酸和缬氨酸途径共用的4种同工酶,即二羟基脱水酶,苏氨酸脱氢酶,乙酰乳酸异构还原 酶,乙酰乳酸合成酶,E基因编码缬氨酸转氨酶,而G基因编码乙酰乳酸合成酶。通过诱变野生型的ilvGMEDA?操纵子或通过基因重组技术修饰,将?ilv?操纵子破坏或将?ilvE? 基 因从?ilv?中除掉,就可以减弱苏氨酸脱氨酶的活性,切断苏氨酸到L-异亮氨酸的代谢支 路,使得代谢途径中的4种同工酶完全用于缬氨酸的合成,提高缬氨酸的产量。
??? 通过常规的诱变育种所选育的突变株大多是黄色短杆菌和谷氨酸棒杆菌,发酵周期长,营养 物质要求高。而大肠杆菌发酵周期短,生产效率高, Hoechst等[18]将来源于大肠 杆菌ATCC11303的?ilvE?基因片段克隆到pBR322质粒中,?ilvE?基因主要编码缬氨酸转 氨基酶,将重组质粒转化到大肠杆菌DG30中,所构建的工程菌株发酵可以高产缬氨酸。Mits ubishi等[19]将棒杆菌中编码乙酰氧肟酸基因的一段特殊DNA序列插入到质粒载 体中,转化到棒杆菌中高产缬氨酸。
2?? 发酵条件的优化
??? 除了应用代谢控制理论选育L-缬氨酸突变株和构建重组菌株提高发酵产量以外,对生产菌的发酵条件优化也是提高发酵产量的一条重要而有效的途径。
2.1? 培养方式
??? (1)补料分批培养?
??? L-缬氨酸工业生产多采用分批发酵方式,高浓度初糖往往会抑制菌体产酸能力使糖酸转化率下降,而补料分批培养则能较好解决这一问题。屈明波等[5]通过研究得到了L-缬氨酸发酵的一个较优化的控制模式,即“低供氧和恒速补糖分批发酵”,缬氨酸的产量及糖酸转化比率均有一定的提高,超过国内文献报道。
? ? (2)混合培养?
??? Kanegafuchi等[20]研究了混合培养生产L-缬氨酸的方法。将能吸收盐酸作为碳源的缬氨酸生产菌与盐酸生产菌混合培养,发酵产物中缬氨酸产量高。最后将缬氨酸从发酵产物中分离出来。
??? (3)直接培养?
??? 传统的工业上大规模使用的是发酵法,但发酵法具有一定的局限性。Mitsubishi[21]研究利用直接培养法生产L-缬氨酸。这种新的方法使用的是未杀菌的培养基。
2.2? 发酵条件的优化
? 培养条件的优化与否直接影响到代谢方式及代谢流量的变化,从而影响到目的产物的产量。 保证菌体生长和发酵生成产物所必须的各种最佳条件可以使目的产物产量大幅度的提高。对 于基因工程菌而言,培养条件对目的基因的高效表达,质粒稳定性等具有重要影响。
2.2.1? 培养条件参数的优化
? (1)溶氧?
? 氧的供给和传递对缬氨酸发酵是个关键因子。Mitsubishi[11]等研究了氧供应对缬 氨酸发酵生产的影响。结果表明,发酵开始一段时间,降低溶解氧浓度利于缬氨酸的生物合成。这种需氧特点可能与缬氨酸生物合成过程中耗氧少有关。缬氨酸的合成不是经由三羧酸循环,而是由丙酮酸为前体合成。当供氧不足时,葡萄糖降解通过TCA循环的氧化受到抑制、,细胞内丙酮酸库水平提高,即缬氨酸合成前体增加,因而有利于缬氨酸的积累。
? (2)碳源?
? 可以作为缬氨酸生产菌的碳源有碳水化合物,有机酸。碳水化合物如葡萄糖、甘油、果糖、蔗糖、麦芽糖、甘露糖、淀粉水解物、糖蜜等。有机酸如丙酮酸、延胡索酸、乳酸和乙 酸等。其他如有机烃和乙醇也可以作为碳源。Nakazawa[13]比较了几种碳源对产酸 量的影响 ,发现以乙酸作为碳源具有菌体生长好,产酸量高、副生酸含量低的优点。Yugawa[22]等为经济而有效地生产缬氨酸,将菌株培养在以乙醇为碳源的培养基上,发酵生产缬氨酸。
? (3)氮源?
? 可以作为缬氨酸生产菌的氮源有氨,有机及无机铵盐。如氯化铵,硫酸铵和乙酸铵,尿素及其他的含氮化合物,如蛋白胨,酵母粉,牛肉膏,玉米浆,酪蛋白水解物,鱼粉等。黄海华 等[23]比较了五种不同的氮源对产酸的影响,结果表明,(NH)?2SO?4在一定的 浓度范围内,可获得较高的主酸产量,且副生酸较少。来采霞等[24]在基础培养基中添加八种营 养成分进 行发酵实验。结果表明,玉米粉对产酸有显著的刺激作用。而蛋白胨,酵母膏浸汁和胚芽粉的增产效果不明显。
? (4)生物素?
? 生物素是L-缬氨酸生产菌的生长因子,在生物素存在的条件下,出发菌可积累一定量的缬 氨 酸。当生物素亚适量时,出发菌株却积累谷氨酸的量增多。只有当生物素浓度超过一定量的 时候,L-缬氨酸的积累量才增大,这些现象与Shiio提出的渗透假说一致,只有当细胞生长 在 生物素贫乏的培养基中,谷氨酸产生菌的细胞才能分泌酸性氨基酸,而当生长在生物素丰富 的培养基中,中性氨基酸才能分泌。细胞形态观察也能说明以上假设,谷氨酸分泌时,由于 生物素亚适量,细胞壁合成不足,造成菌体膨大。有利于谷氨酸的分泌,而缬氨酸发酵,由于生物素过量,细胞壁合成完好,造成菌体收缩,有利于极性氨基酸缬氨酸的分泌。
2.2.2? 发酵过程参数的检测??? 通过对发酵过程参数的检测,可以尽可能地优化发酵过程控制,目前检测的方法主要有高效 液相色谱系统和流动注射式分析仪,对于发酵液中产物分析具有所需时间短、效率高、灵敏 度高等特点。此外工业发酵上也可以用生化工程控制方法,如神经网络和遗传算法相耦连用 于发酵培养基配方的优化。但目前对于缬氨酸尚未见此方面的报道。
3? 展望
? 最近,人们发现L-缬氨酸是合成一种免疫抗生素的重要中间体,其年消耗量猛增到数千吨 ,现在世界缬氨酸年产量已达到400吨以上。其中日本是主要生产国,而国内目前尚无大批 量生产厂家,仅配制氨基酸输液就需进口100吨。随着氨基酸输液的不断增长,缬氨酸的需 求也将增长,在国内中国科学院微生物研究所于1975年首次报道了L-缬氨酸生产,沈阳药 科大学来彩霞、张伟国等也相继进行了此方面的研究。但是目前缬氨酸工业化生产还存在着 一些问题: (1)产酸率低,产酸率最高达45g/L 以上,而L-缬氨酸在国外已经实现大规模工业化生 产,产酸水平已达到50 g/L,与国际水平尚有一定差距。 (2)重组菌株的遗传改造:重组菌株在发酵培养基中的稳定性以及工程菌工业化生产的可 行性。 (3)提高转化率:目前发酵生产L-缬氨酸的最高转化率仅为30%,提高转化率对工业化生 产有极其重要的意义。 (4)降低提取分离成本:寻找最佳的提取途径,包括所用的试剂,提取工艺及效率等。
? 解决目前存在的问题,在我国开展此方面的研究对于国内缬氨酸产业化,促进医药行业的发 展有重要的意义。
参考文献
[1] Katsurada.Process for producing L-valine b y fermentation,UP 5,188,948,1993
[2] 李良铸,李明华.最新生化药物制备技术.中国药科技术出版社,2 001
[3] Iborra J L.Analysis of a laminated enzyme membrane? reactor for continuous resolution of amino acids?L?amino acid e.g.L-valine p roduction by immobilized aminoacylase.Biotechnol.Appl.Biochem, 1992,15(1):? 22~30
[4] Bodalo?santoyo A.Production of optically pure L?v a line in fluided and packed bed reactors with immobilized L?aminoacylase.Journa l of Chemical Technology and Biotechnology,1999,75(5):403~408
[5] Kyowa.Process for producing L-valine,UP 5,521,074, 1996
[6] Mitsubishi?Petrochem.et al,Living cell reaction process? for L?isoleucine and L-valine Production?Brevibacterium flavum.J.Ind.Mic robiol.1990,5(5):289~294
[7] Tomita.Methods for producing L-valine and L?leuci ne,UP 6,214,591,2001
[8] 屈明波,龚建华,黄和容.L-缬氨酸发酵供氧与补料过程控制的研 究.生物工程学报,1992,8(2):184~191
[9] Al Ratkov.Modeling of L-valine fed?batch fermenta t ion process.The 22nd international Conference on information Technology Interfa ces,2000,13~16
[10] Tomota F.Methods for producing L-valine by fermentation,UP 5 ,888,783,1999
[11] Mitsubishi?Petrochem.Production of L-valine using glucose?conta inin g aqueous solution with biotin auxotrophic coryneform bacteria,e.g.Corynebacter ium,Brevibacterium,etc.? Brevibacterium flavum fermentation in glucose cultur e medium.JP 094373,1989
[12] Khachatryan A G.Dependence of valine production by serratia marc e scens on the ion composition of the fermentation,Prink,Biokhim.Microbiol.198 6,22(4):554~556
[13] Nakazawa.Preparation of L-valine by fermentation method,JP 56039 792,1981
[14] Tsuchida.Preparation of L-valine by fermentation method,JP 560519 89,1981
[15] Nakamura tsunerou.Production of L-valine,JP 59143595,1984
[16] 徐旭东,肖灿鹏.L-缬氨酸生产菌的选育.药物生物技术,1999,6(1):24~ 27
[17] 张伟国,钱和.L-缬氨酸发酵条件的研究.氨基酸和生物资源,2001,23(3): 28~31
[18] Hoechst.et al,New extrachromosomal element?containing aliphatic?trans aminase gene?from Escherichia coli; alanine,valine and isoleucine over producti on.EP265852,1986
[19] Mitsubishi.Acetohydroxy?acid?isomeroreductase gene?ketol?acid ?redu ctoisomerase gene cloning and expression in e.g.Brevibacterium flavum for impro ved L?leucine and L-valine production.JP 06277067,1993
[20] Kanegafuchi.Fermentative preparation of L-valine by mixed cultur e,JP 57208993,1982
[21] Mitsubishi?Petrochem.Preparation of L-valine by culturing Brevibacteri um flavum or its mutants,JP 307326,1988
[22] Yugawa.Preparation of L-valine fermentation,JP 55153596,1980
[23] 黄海华,李福德.发酵法生产L-缬氨酸的研究.微生物学杂志,1989,9(2):1 ~8
[24] 来彩霞,刘堂生,陈炜.缬氨酸产生菌菌种选育和发酵条件的考察.沈阳药科大学学 报,1997,14(2):107~110