1 色氨酸操纵子的基本结构
大肠杆菌色氨酸操纵子结构较简单,也是研究得最清楚的操纵子,结构基因依次排列为trpEDC2BA ,其中trpGD 和trpCF 基因融合。trpE和trpG编码邻氨基苯甲酸合酶, trpD编码邻氨基苯甲酸磷酸核糖转移酶, trpC编码吲哚甘油磷酸合酶, trpF编码异构酶, trpA和trpB分别编码色氨酸合酶的α和β亚基。trpE的上游为调控区,由启动子、操纵基因和162bp 的前导序列组成。5 个结构基因全长约6800bp, trpD远侧还有一个二级启动子,在细胞生长需要过量Trp时发挥作用。
一些G+菌,如枯草杆菌色氨酸操纵子的结构有所不同, 7 个结构基因中的6 个依次排列为trpEDCFBA ,存在于含有12个结构基因的芳香族氨基酸超操纵子( a ro operon ) ,第7 个结构基因, trpG存在于叶酸合成操纵子中,该酶参与Trp 和叶酸的合成。有2个启动子参与调控,一个位于aro operon的起始位置, 另一个则位于trpE 上游约200 bp处。
2 色氨酸操纵子的调控作用途径
Trp合成途径较漫长,消耗大量能量和前体物,如丝氨酸、PRPP、谷氨酰氨等,是细胞内最昂贵的代谢途径之一,因此受到严格调控,其中色氨酸操纵子发挥着关键作用。调控作用主要有三种方式:阻遏作用、弱化作用以及终产物Trp 对合成酶的反馈抑制作用。
2. 1 阻遏作用
trp操纵子转录起始的调控是通过阻遏蛋白实现的。产生阻遏蛋白的基因是trpR ,该基因距trp o2peron基因簇很远。它结合于trp 操纵基因特异序列,阻止转录起始。但阻遏蛋白的DNA结合活性受Trp调控, Trp起着一个效应分子的作用, Trp与之结合的动力学常数为1~2 ×10- 5mol·L - 1。在有高浓度Trp存在时,阻遏蛋白- 色氨酸复合物形成一个同源二聚体,并且与色氨酸操纵子紧密结合,因此可以阻止转录。阻遏蛋白- 色氨酸复合物与基因特异位点结合的能力很强,动力学常数为2 ×10- 10mol·L - 1 ,因此细胞内阻遏蛋白数量仅有20~30分子已可充分发挥作用。当Trp 水平低时,阻遏蛋白以一种非活性形式存在,不能结合DNA。在这样的条件下, trp操纵子被RNA聚合酶转录,同时Trp 生物合成途径被激活。
2. 2 弱化作用
trp操纵子转录终止的调控是通过弱化作用( attenuation)实现的。在大肠杆菌trp operon,前导区的碱基序列包括4个分别以1、2、3和4表示的片段,能以两种不同的方式进行碱基配对, 1 - 2和3 -4配对,或2 - 3配对, 3 - 4配对区正好位于终止密码子的识别区。前导序列有相邻的两个色氨酸密码子,当培养基中Trp 浓度很低时,负载有Trp 的tR2NATrp也就少,这样翻译通过两个相邻色氨酸密码子的速度就会很慢,当4区被转录完成时,核糖体滞留1区,这时的前导区结构是2 - 3配对,不形成3 - 4配对的终止结构,所以转录可继续进行。反之,核糖体可顺利通过两个相邻的色氨酸密码子,在4区被转录之前,核糖体就到达2区,这样使2 - 3不能配对, 3 - 4 区可以配对形成终止子结构, 转录停止。
枯草杆菌的弱化作用机制另有特点。因其色氨酸操纵子结构的特殊性,转录起始的调节似乎不如转录终止的调节更具重要性。枯草杆菌色氨酸操纵子表达主要受到色氨酸激活RNA结合蛋白( Trp -activated RNA - binding p rotein, TRAP)的调节。该蛋白与色氨酸结合被激活后,可与trpE上游转录产物结合, 导致转录终止。当色氨酸浓度较低时,TRAP失活,转录可以继续,结构基因得以表达。另外枯草杆菌对未负荷色氨酸的tRNATrp也很敏感,后者大量堆积, 会诱导合成抗TRAP 蛋白( anti -PRAP, AT) 。AT与Trp激活的PRAP结合,可以取消其转录终止活性。trpG表达也受PRAP调控,活化的TRAP与和trpG相重叠的S - D 序列结合,阻碍核糖体的结合,抑制trpG转录。
2. 3 反馈抑制作用
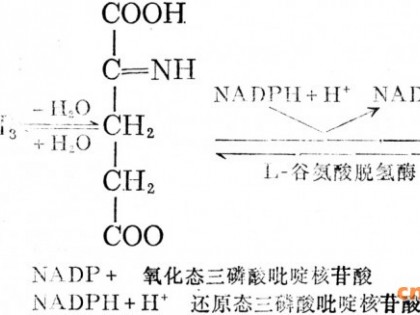
由于基因表达必然消耗一定的能源和前体物,相对于阻遏和弱化作用,反馈抑制作用更为经济和高效。终产物Trp对催化分支途径几步反应的酶具有反馈抑制作用,其50%抑制浓度分别为:邻氨基苯甲酸合酶, 0. 0015 mmol·L - 1 ;邻氨基苯甲酸磷酸核糖转移酶, 0. 15 mmol·L - 1 ; 色氨酸合成酶, 7. 7mmol·L - 1 。对于普通野生菌株,邻氨基苯甲酸合酶对Trp合成起到关键调控作用,常被称为瓶颈酶;但对高产Trp工程菌而言,上述任何一种酶的反馈抑制都会直接影响Trp产量。研究发现酶蛋白某些特殊位点突变可以导致对反馈抑制作用敏感性显著下降,如邻氨基苯甲酸合酶38位的丝氨酸被精氨酸取代,抗反馈抑制能力显著提高,当环境中Trp浓度为10 mmol·L - 1时酶活性不受影响,而相同条件下野生型酶活性不到1%。邻氨基苯甲酸磷酸核糖转移酶162位缬氨酸被谷氨酸取代,抗反馈抑制能力也有显著提高,当环境中含有0. 83 mmol·L - 1色氨酸或0. 32 mmol·L - 1 5 - 甲基- 色氨酸时,酶活性分别为野生菌的3. 6倍和2. 4倍。陈小芳等报道一株谷氨酸棒杆菌邻氨基苯甲酸合酶基因7个碱基突变导致6个氨基酸残基改变,抗反馈抑制能力显著增强,环境中Trp 浓度达到15 mmol·L - 1时,邻氨基苯甲酸合酶活性几乎没有变化。
3 色氨酸操纵子遗传改造
由于色氨酸操纵子的调控作用,自然界不可能存在高产Trp菌株,为了获得高产Trp菌株,就必须对色氨酸操纵子进行改造,解除其调节作用。早期的研究策略主要依靠传统诱变方法,经过长期努力,获得了一些有价值的研究结果,如获得了TrpR - 菌株,通过缺失某些片断解除了弱化作用,得到了一些抗反馈抑制的酶。许多Trp生产菌株都是通过随机的诱变技术筛选得到的,如王健等通过硫酸二乙酯诱变, Trp 类似物筛选等方法从谷氨酸棒杆菌中培育出一株trp 高产菌株,摇瓶发酵64 h,产trp达到7. 28 g·L - 1。
传统诱变的方法尽管有效,但其缺陷点也是显而易见的,如工作量大,效率低,突变株的菌体生长、对环境的耐受性以及遗传稳定性等都比野生型菌株差等。基因工程技术的建立和发展对色氨酸操纵子改造提供了新的技术平台。1979年Tribe等人采用DNA重组技术对大肠杆菌进行改造,扩增trp 操纵子,发酵12 h,产酸1 g·L - 1 ,产酸量尽管不是很高,但是其意义却十分重大,由此开创了基因工程技术在Trp生物合成应用的先河。随后,Aiba等将带有色氨酸操纵子的质粒引入大肠杆菌,发酵27 h,并补充邻氨基苯甲酸,得到trp 6. 2 g·L - 1 。Ikeda等通过构建稳定质粒,扩增分支途径限速酶并改造中心代谢途径, 获得产Trp 达58 mg ·L - 1 的菌株。除了扩增表达操纵子基因,对其进行理性设计和改造也开始引起关注。已知酶分子某些特殊位点突变可以导致对反馈抑制作用敏感性下降,因此可以考虑利用基因工程技术对色氨酸操纵子结构基因进行理性改造降低其对反馈抑制的敏感性,但是目前尚缺乏成功的范例,主要原因在于现有酶分子反馈抑制结构与功能关系资料不足,不能满足需要。
4 代谢工程理论与色氨酸操纵子调控研究
1991年,Bailey用代谢工程描述利用DNA重组技术对细胞的酶反应、物质运输以及调控功能的遗传操作,进而改良细胞生物活性的过程,标志着代谢工程向一门系统学科发展的转折点。代谢工程亦称途径工程,以区别于传统的单基因表达(第一代基因工程)和基因定向突变(第二代基因工程) ,是有目的地对细胞生化反应的代谢网络进行修饰的技术,在多基因水平上设计修饰细胞固有的代谢途径和遗传性状,并赋予细胞更为优越甚至崭新的产物生产品质。代谢工程在提高宿主细胞原有代谢物的产量、产生新物质、扩展和构建新代谢途径、生产代谢产物如氨基酸、抗生素、维生素以及降解环境污染物等诸多方面显示出广阔的应用前景。从理论上提高Trp产率是代谢工程的首要任务,这需要对Trp生物合成和对细胞内控制Trp 代谢的异化途径有很好的了解,同时还要有一个在较宽的微生物代谢网络内描述这些途径的有效的数学模型。早期的模型主要考虑色氨酸操纵子动力学的某个方面,仅有少数研究模型,综合考虑了色氨酸操纵子的三种作用机制。修志龙等将代谢工程理论引入trp代谢分析领域,建立了适宜的数学模型,发现在代谢稳定的条件下,阻遏水平和酶的反馈抑制强度严重地影响了目标变量,即trp 浓度。Santillan等人提出的动力模型采用Second Lyapunov’s method分析,通过对野生菌株和几株改良菌株(邻氨基苯甲酸合成酶反馈抑制和弱化作用分别解除)的性能进行比较、验证,得出结论认为酶的反馈抑制对于系统稳定性具有重要作用,而弱化作用影响较小,主要在Trp营养发生改变时发生作用。这两个模型有一定的代表性,它们考虑了酶的反馈抑制,对于Trp生物合成具有一定指导意义;但其不足也很明显,仅仅考虑了邻氨基苯甲酸合成酶的反馈抑制作用,对其它酶未作考虑,另外一个不足是缺乏高产色氨酸菌株来加以验证。